四川地区帕金森患者睡眠障碍及非运动症状相关性研究
张锦红,杜 宇,李楠楠,彭芳兰
(1.四川大学华西保健医院神经内科,四川 成都 610064;2.四川大学华西医院神经内科,四川 成都 610064;3.四川大学华西第四医院急诊科,四川 成都 610064;4.四川省金川县人民医院内科,四川 金川 624100)
四川地区帕金森患者睡眠障碍及非运动症状相关性研究
张锦红1,2,杜 宇3,李楠楠2,彭芳兰4
(1.四川大学华西保健医院神经内科,四川 成都 610064;2.四川大学华西医院神经内科,四川 成都 610064;3.四川大学华西第四医院急诊科,四川 成都 610064;4.四川省金川县人民医院内科,四川 金川 624100)
目的 探讨四川地区帕金森病(PD)患者睡眠障碍与非运动症状的相关性。方法使用帕金森睡眠量表(PDSS)评估260例PD患者,其中睡眠障碍(SD)组160例、非睡眠障碍(NSD)组100例,采用一般情况调查表、统一帕金森病评定量表(UPDRS)、H-Y分级、汉密顿抑郁量表(HAMD)、疲劳严重度量表(FSS)、简易智能状态量表(MMSE)等对患者进行评分。结果SD组PDSS总分低于NSD组,其余量表评分均高于NSD组。SD组较NSD组更易出现嗅觉障碍、疼痛、疲劳、多尿、RBD等症状(P<0.05)。RBD、UPDRSIII、抑郁、疼痛、疲劳是PD患者伴发睡眠障碍的危险因素(P<0.05)。结论PD睡眠障碍与抑郁、疼痛、疲劳等非运动症状显著相关;汉族和藏族PD睡眠障碍发生率接近,藏族PD以日间瞌睡和疲乏思睡尤为严重。
帕金森病;睡眠障碍;抑郁;疲劳;疼痛
帕金森病(parkinson's disease,PD)是常见的神经系统变性疾病,随着治疗药物的应用和手术方式改进,PD运动症状得到了较好的改善和控制,但其非运动症状常被人们忽视,研究发现PD患者存在睡眠、嗅觉、情感、认知、疼痛等多个领域损害,伴有相对独立的病理基础[1]。PD睡眠障碍在病程早期或运动症状前已存在,表现为多种睡眠结构紊乱,发生率高达60%~90%[2],严重影响患者生活和预后。四川地区多民族聚居,有关PD睡眠障碍报道较少,分析其特点及与非运动症状的关系,对于早期筛查和长期管理有重要意义。
1 资料与方法
1.1 一般资料选取2014年6月至2016年8月四川大学华西医院神经内科门诊或住院的260例PD患者,居住地均为四川,其中男129例(49.6%),女131例(50.4%);汉族155例(59.6%),藏族105例(40.4%);年龄 45~81岁[(58.28 ±10.49)岁];发病年龄37~77岁[(53.50±11.18)岁];病程 0.6~35年[(3.93±4.00)年];运用帕金森睡眠量表(PDSS)总分(110.2±25.1)分,PD统一评分量表(UPDRS)III运动评分(21.29±13.35)分,简易精神状态量表(MMSE)评分(27.56±2.25)分,均符合中国帕金森病诊断标准[3],排除标准:继发性帕金森综合征,帕金森叠加综合征,严重全身性疾病,痴呆症及不能完成问卷评估的其他情况。
1.2 方法
1.2.1 一般资料 收集由专科医师完成一般问卷的调查,包括姓名、性别、年龄、学历、病程、首发症状等,同时完成神经系统查体。
1.2.2 睡眠障碍的评定 运用PDSS评估四川地区汉藏族PD睡眠障碍严重程度。PDSS[4]是PD专用睡眠量表,能全面反映睡眠紊乱的各个方面,包括PD患者存在的睡眠障碍共15项,评估过去一周的睡眠情况,总分150分,分数越高睡眠质量越好。
1.2.3 相关量表评定 ①UPDRS评分:包括UPDRS I、Ⅱ、Ⅲ,分别评价帕金森病患者精神、行为和情绪,日常生活活动能力,运动症状。②H-Y(Hoehn-Yahr)分级:对患者的病情进行总体评价:PD患者中Ⅰ期54例(20.7%),Ⅱ期120例(46.2%),Ⅲ期78例(30.0%),Ⅳ期8例(3.1%)。③汉密顿抑郁量表(HAMD):评测患者抑郁状态。④简易精神状态量表(MMSE):评估认知功能。⑤疲劳严重度量表(FSS):FSS总分/9>4,则定为疲劳。⑥同时记录患者近一月非运动症状(NMS)嗅觉异常、身体疼痛、便秘、流涎、多汗、夜尿、性功能障碍情况,“有”为1,“不确定”或“无”记为0。
1.2.4 周期性腿动(PMLS)和快动眼睡眠期行为障碍(RBD)评定 调查护理者及家属,患者安静或睡眠中是否存在“突然、重复的腿部运动”或“睡梦中行为,包括:说话、打、踢、喊等”,前者界定为周期性腿动(PMLS),后者为快动眼睡眠期行为障碍(RBD)。
1.2.5 左旋多巴剂量 为了评估PD睡眠障碍和多巴胺治疗之间的关系,患者每日左旋多巴等效剂量(LED)被计算[5],PD患者平均左旋多巴等效剂量(521.6±264.8)mg/d。
1.3 统计学方法采用SPSS 18.0统计软件包分析数据。计量资料以均数±标准差表示,正态分布数据比较采用t检验,非正态分布数据比较采用秩和检验;计数资料比较采用卡方检验;相关性分析采用Spearman等级相关分析;危险因素判定采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料及非运动症状分析根据PDSS-1评分分组,PDSS-1<6分的160例患者为睡眠障碍(SD)组,PDSS-1>6分的100例患者为无睡眠障碍(NSD)组,两组性别、民族、年龄、病程比较差异均无统计学意义(P>0.05)。SD组与NSD组MMSE、UPDRSⅠ评分差异无统计学意义(P>0.05)。SD组PDSS总分低于NSD组,H-Y分级、UPDRSⅡ及UPDRSⅢ评分、HAMD抑郁评分、抗帕药物剂量均高于NSD组,嗅觉障碍、疼痛、疲劳、多尿、RBD发生率均高于NSD组(P<0.05);两组其他非运动症状差异无统计学意义(P>0.05),见表1。
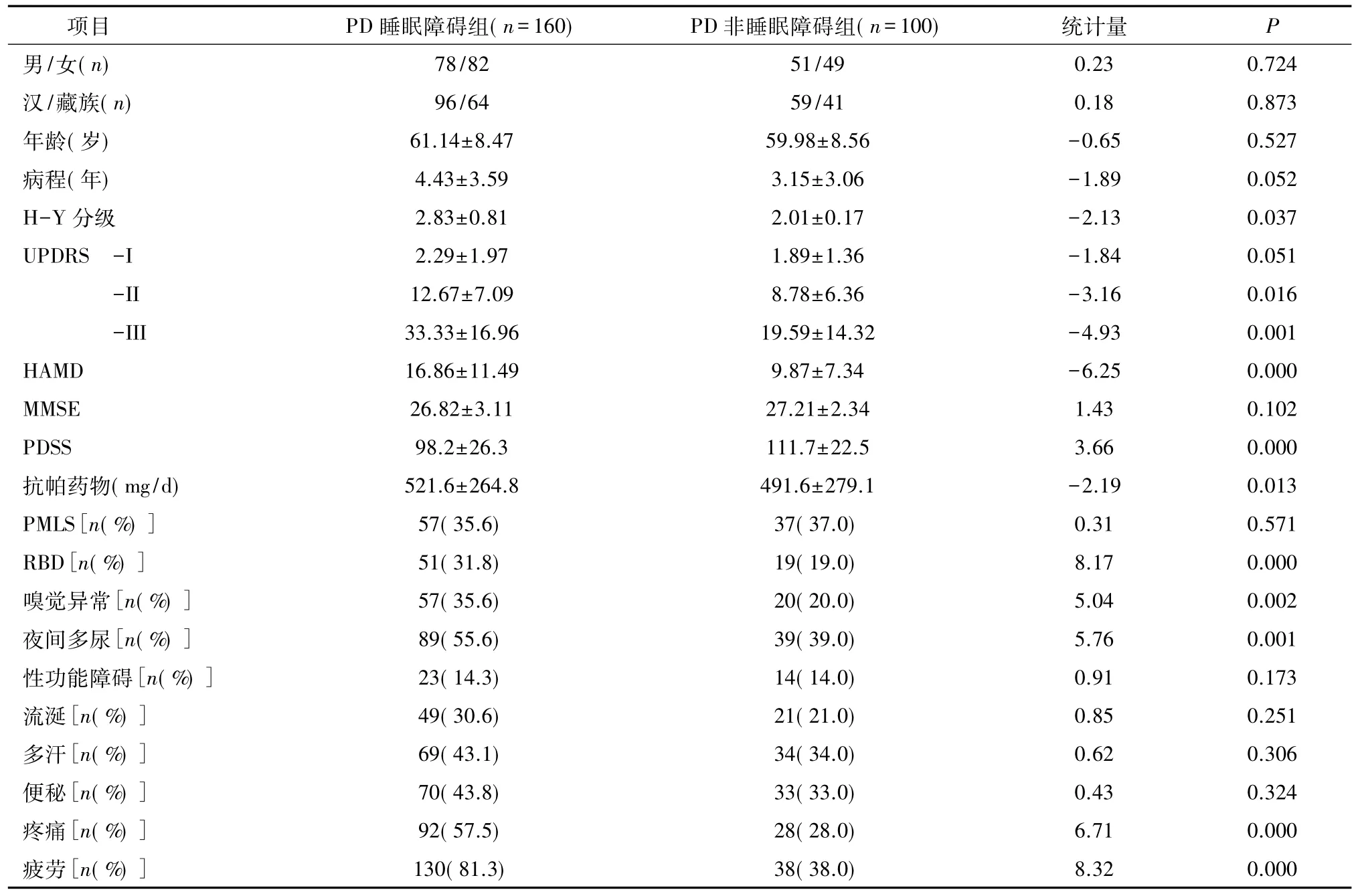
表1 两组临床资料及非运动症状比较
2.2 藏族和汉族PD患者PDSS评分比较155例汉族患者中睡眠障碍发生率为61.9%,105例藏族患者中睡眠障碍发生率为60.9%,差异无统计学意义(P>0.05)。藏族患者PDSS总分(114.4±23.2)分,汉族患者(121.4±28.6)分,差异无统计学意义(P>0.05)。PDSS单项评分中,两组都以PDSS-8(夜尿)分最低,其中藏族PDSS-14、15(疲乏思睡及日间瞌睡)两项更严重,藏、汉族患者该两项评分分别为[(6.8±2.6)分 vs(7.5±2.7)分],[(7.1±2.1)分vs(7.9±2.3)分],差异均有统计学意义(P<0.05);其余各单项评分差异无统计学意义(P>0.05)。
2.3 睡眠障碍与非运动症状相关性分析抑郁、疼痛、疲劳、多尿、RBD、H-Y分级及 UPDRSⅢ评分与睡眠障碍呈显著负相关(P<0.05),见表2。

表2 睡眠障碍与非运动症状相关性分析
2.4 睡眠障碍的危险因素分析Logistic回归分析显示抑郁、疼痛、疲劳、RBD、UPDRSⅢ评分是睡眠障碍的危险因素。见表3。

表3 PD睡眠障碍的危险因素分析
3 讨论
本研究首次采用PDSS对四川地区PD患者进行调查,其睡眠障碍总发生率61.5%稍高于北京PD人群46.5%[6];260例四川 PD患者PDSS总分与中国西南地区[7]PDSS 总分,上海地区[8]PDSS 总分,日本[9]PDSS总分相似,表明同处于亚洲板块人群PD的睡眠受损度基本一致。自Braak等[10]提出PD的六个发展阶段,PD睡眠障碍渐引起人们关注,众多研究认为年龄是PD患者睡眠障碍的主要决定因素,PD多发生于老龄患者,我们将四川地区PD患者分为SD组与NSD组,两组年龄差异无统计学意义,表明PD睡眠障碍除年龄因素外尚有其他独立机制。
本研究显示 H-Y分级、UPDRS-III、RBD与SD显著负相关,Logistic分析得出 UPDRS-III与 RBD是睡眠障碍的独立危险因素。PD患者脑内黑质细胞减少,纹状体多巴胺含量降低,PD运动功能(UPDRS-III)如:动作迟缓、肌张力增高、肌强直等随病程不断恶化,同时夜间活动能力下降、翻身困难、痛性痉挛等症状加重,特别在晚期,随着疾病进展,夜间运动症状如不安和震颤、夜间冻结、清晨肌张力障碍、静坐不能逐渐严重,加之RBD的存在,PD患者失眠的发生加剧。
同时,我们发现SD组抑郁、疼痛、疲劳的发生率显著高于NSD组,神经递质学研究显示PD黑质纹状体中的多巴胺除与运动有关外,在维持清醒状态中也发挥重要作用,参与睡眠稳态的调节[11],脑内递质失衡,使唤醒系统受损,影响了正常睡眠‐觉醒周期;病理研究发现在PD早期蓝斑、延髓中缝核、孤束核等核团受损,5-羟色胺、去甲肾上腺素能神经元含量降低是睡眠、抑郁及疲劳的共同病理基础[12];同时,皮质-基底节-丘脑环路参与了运动、情感、疼痛的认知反应,PD导致基底节对疼痛的控制作用下降[13],疼痛作为伴随消极体验的复杂情绪反应,与抑郁互为因果,让PD患者心境不断恶化;同时PD本身的不可逆性、漫长的治疗周期,患者易背负沉重精神负担和经济压力,加重悲观抑郁心理,进而导致各种睡眠问题。
既往研究发现PD药物不仅可以改善PD的运动症状,也可以改善患者的睡眠质量[14],但有研究发现多巴胺能药物对患者睡眠的影响表现为剂量相关效应:小剂量多巴胺能药物可促进睡眠,而大剂量多巴胺能药物可引起睡眠破裂和延长睡眠潜伏期[15],主要与多巴胺D1、D2受体亚型的激动有关。本研究发现SD组左旋多巴剂量高于NSD组,虽未列入睡眠障碍的独立危险因素,但一定程度上说明大剂量左旋多巴对PD患者睡眠障碍有一定贡献。
本研究首次将四川地区汉族和藏族PD人群的睡眠特点进行比较发现,两组睡眠障碍率均较高,与国外人群[2]的发生率相近。汉族与藏族睡眠障碍发生率差异无统计学意义。从睡眠紊乱的结构看,藏族PD群体比汉族更易出现疲乏思睡和日间瞌睡,严重影响藏族人群的劳动能力和社会功能,原因可能与民族体质差异有关,亦可能与藏族人群医疗条件相对落后,缺乏对这两方面睡眠障碍的治疗和关注有关。
[1]Duncan GW,Khoo TK,Yarnall AJ,et al.Health-related uality life inarly Parkinson's disease:The impact of nonmotort of nonmotorsymptoms[J].MovDisord,2014,29:195-202
[2]SchrempfW,BrandtMD,Storch A,et al.Sleepdisorders in Parkinson s disease[J].J Parkinsons Dis,2014,4:211-221.
[3]中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业委员会.中国帕金森病的诊断标准(2016版)[J].中华神经科杂志,2016,49(4):268-271.
[4]Chaudhuri KR,Pal S,DiMarco A,et al.The Parkinson's disease sleep scale:a new instrument for assessing sleep and nocturnal disability in Parkinson's disease[J].J NeurolNeurosurg Psychiatry,2002,73:629-635.
[5]Minguez-Castellanos A,Eseamilla-Sevilla F,Katati MJ,et al.Different patterns of medication change after subthalamic or pallidal stimulation for Parkinson's disease:target related effect or selection bias[J].J Neurol Neurosurg Psychiatry,2005,76:34.
[6]王雪梅,冯涛,顾朱勤,等.帕金森病睡眠障碍与非运动症状的相关性研究[J].中华老年心脑血管病,2015,17(5):507-510.
[7]张锦红,彭蓉,杜宇,等.帕金森病睡眠量表中文版在中国西南地区的信效度研究[J].中华医学杂志,2016,96(41):3294-3299
[8]Wang G,Cheng Q,Zeng J,et al.Sleep disorders in Chinese patients with Parkinson's disease:validation study of a Chinese version of Parkinson's disease sleep scale[J].J Neurol Sci,2008,271(1-2):153-157.
[9]Suzuki K,kuma Y,Hattori N,et al.Characteristics of sleep disturbances in Japanese patients with Parkinson's disease.A study using Parkinson's disease sleep scale[J].Mov Disord,2007,22(9):1245-1251.
[10]BraakH,GhebremedhinE,RttbU.et al.Stages in the development of Parkinson's disease-related pathology[J].Cell Tissue Res,2004,318:121-134.
[11]Schulte EC,Winkelmann J.When Parkinson's disease patients go to sleep:specific sleep disturbances related to Parkinson's disease[J].Neurol,2011,258:328-335.
[12]Politis M,Wu K,Loane C,et al.Depressive symptomsin PD correlate with high 5-HTT binding in rapheand limbic structures[J].Neurol,2010,75:1920-1923.
[13]Mao CP,Wei LX,Zhang QL,et al.Differences in brain structure in brain struction in patients with distinct siles of chronic pain:A Voxel-based morphometric analysis[J].Neural Regen Res,2013,8(32):2981-2990.
[14]Belaid H,Adrien J,Laffrat E,et al.Sleep disorders in Parkin-sonian macaques:effects of L-dopa treatment and peduncu-lopontine nucleus lesion[J].J Neurosci,2014,34:9124-9133.
[15]Zhang H,Gu z,An J,et al.Non-motor symptoms in treated and untreated Chinese patients with early Parkinson's disease.Tohoku[J].J Exp Med,2014,232:129-136.
Relationship between sleep disturbance and non-motor symptoms in Parkinson's disease patients
ZHANG Jin-hong1,DU Yu2,LI Nan-nan3,PENG Fang-lan4(1.Department of Neurology,West China Health Hospital,Sichuan University,Chengdu 610064,China;2.Emergency Department,The fourth West China Teaching Hospital,Sichuan University,Chengdu 610064,China;3.Department Neurology,West China Hospital,Sichuan University,Chengdu 610064,China;4.Department of Medicine,Jinchuan County People's Hospital,Jinchuan 624100,China)
Objective To investigate the relationship between sleep disturbance and non-motor symptoms in Parkinson's disease(PD)patients in Sichuan.MethodsTwo hundred and sixty PD patients were divided into sleep disturbance(SD)group(n=160)and non-sleep disturbance(NSD)group(n=100)after their sleep disturbance was assessed according to the PDSS.The sleep disturbance was scored according to the general survey scale,UPDRS,H-Y staging,HAMDS,FSS and MMSE.ResultsThe total scoreof PDSS in the SD group was lower than that in the NSD group.The HAMD,H-Y staging,UPDRSII/III,drugs of Parkinson were significantly higher in the SD group than those in the NSD group(P < 0.05).The incidence of hyposmia,pain,fatigue,polyuria and RBD was significantly higher in the SD group than that in NSD group(P <0.05).The depression,pain,fatigue,RBD and UPDRS-III score were the risk factors for sleep disturbance in PD patients(P < 0.05).ConclusionPD sleep disturbance is closely related with depression,pain and fatigue.The incidence of PD sleep disorder in Han is similar to Tibetans,but Tibetans are particularly serious in daytime sleepiness and fatigue.
Parkinson disease;Sleep disorders;Depression;Fatigue;Pain
R742.5
A
1672-6170(2017)04-0045-04
2017-03-13;
2017-05-24)
四川省卫生厅科研基金资助项目(编号:100387)

