血浆氧化还原电位在造血干细胞移植术后移植物抗宿主病监测中的临床应用
钟 凌,陈 姣,黄晓兵,李焱鑫
(四川省医学科学院·四川省人民医院 a.检验科;b.血液科,四川 成都 610072)
血浆氧化还原电位在造血干细胞移植术后移植物抗宿主病监测中的临床应用
钟 凌a,陈 姣b,黄晓兵b,李焱鑫a
(四川省医学科学院·四川省人民医院 a.检验科;b.血液科,四川 成都 610072)
目的 探讨血浆氧化还原电位在监测移植物抗宿主病(graft versus-host disease,GVHD)中的临床应用。方法随访2009年1月至2015年12月进行造血干细胞移植的患者59例,移植术后定期随访同时取空腹静脉血,测定血浆氧化还原电位。正常对照组由59例健康体检者组成。结果正常对照组血浆RP值为-56.2~-11.2 mV。42例未发生GVHD患者血浆RP值为-20.8~21.1 mV,RP值波动幅度△mV为4.4~11.3 mV。17例发生GVHD患者血浆RP值为10.6~38.8 mV,△mV为25.8~61 mV。急性GVHD I级患者血浆RP值为9.8~27.3 mV,II级为3.7~35.1 mV,III级为19.6~43.9 mV,IV级为25.4~49.5 mV。结论血浆RP值的变化与GVHD可能具有一定的关联,且无创、简便,适宜于临床推广。
氧化还原电位;血浆;造血干细胞移植;移植物抗宿主病
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)目前已被广泛应用于干细胞移植、生物免疫治疗等领域[1]。移植物抗宿主病(graft versus-host disease,GVHD)是 HSCT的主要障碍。由于免疫遗传学差异,植入的免疫活性细胞被受者抗原致敏而增殖分化,直接或间接攻击受者细胞,对受者产生炎症反应,炎症反应与HSCT后的GVHD的严重程度密切相关[2]。氧化应激增强与氧化抗氧化失衡在炎症反应中发挥重要作用[3]。血浆氧化还原电位(redox potential,RP)是反映机体内的氧化还原水平较为直接的指标[4],HSCT后GVHD的发生可能会伴随血浆RP的改变,血浆RP的变化可在一定程度上反映GVHD的严重程度。
1 对象与方法
1.1 研究对象2009年1月至2015年12月在我院进行HSCT的患者59例,其中男39例,女20例,年龄21~48岁,年龄中位数39岁。移植术后随访15个月。正常对照组为同期59例健康体检者,男39例,女20例,年龄20~50岁,年龄中位数38岁。
1.2 方法
1.2.1 标本采集 用预冷肝素抗凝管采集患者清晨空腹静脉血4 ml,1500 g离心20 min,分离出血浆,1 h内完成检测。
1.2.2 RP检测 采用IPJ-PrE稳压器,以铂电极为工作电极(表面积3.3×10-2cm2),Ag/AgCl为参比电极,测定血浆电位,记录电位变化30 min。每次测定前均需预处理测定电极[5]。
1.2.3 移植术后随访 HSCT术后患者一个月内,每天进行RP检测。头三个月每周进行血常规检查,每月进行骨髓形态学检查、流式细胞术、肝肾功能常规检查;术后第四个月起每月复查血常规,每3个月复查骨髓形态、流式细胞术、肝肾功能常规检查。如有病情变化随时复查,并进行相应的组织学检查和免疫学检查。急性GVHD的临床分级标准参照Thomas标准[6],慢性GVHD的临床分级标准参照 Schulman[7]标准。
1.3 统计学方法采用SPSS 19.0统计软件进行数据处理。计量资料以均数±标准差表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
正常对照组血浆RP值为-56.2~-11.2 mV,中位数-32.7 mV。随访期间未发生GVHD患者42例(男24例,女18例),血浆RP值为-20.8~21.1 mV,中位数0.2 mV。未发生GVHD患者的RP值长期处于较低水平,且波动幅度较小,△mV为4.4~11.3 mV。HSCT后未发生GVHD的患者随访期内血浆RP值呈两种变化:一种在观察期内其RP值保持平稳,未出现较大范围波动(图1a);另一种在观察期内其RP值出现波动,即向正值偏移,但波动幅度较小,小于 25 mV(图 1b)[6]。

图1 随访期内未发生GVHD患者的RP值变化趋势 a:在观察期内RP值保持平稳;b:在观察期内RP值向正值偏移。
依据GVHD临床诊断和分级标准,17例患者在HSCT后发生GVHD(男15例,女2例),发生GVHD时的血浆RP值为10.6~38.8 mV,中位数24.6 mV(t=5.93,P<0.05),而且发生了较大幅度的波动,△mV为25.8~61 mV。
依据急性GVHD分级标准,将发生急性GVHD的患者分为I~IV级,I级患者血浆RP值9.8~27.3 mV,II级患者血浆RP值13.7~35.1 mV,III级患者血浆RP值19.6~43.9 mV,IV级患者血浆 RP值25.4~49.5 mV。但不同分级患者的血浆RP值变化情况与其临床表现、治疗效果变化情况相符合。分级较低患者在观察期第15~18天血浆RP值出现正向波动,波动幅度△mV为39 mV,于第20天确诊发生急性GVHD,I级;随后予以治疗,临床表现和实验室检查指标趋向正常、稳定,患者的血浆RP值也逐步减低(图2a)。分级较高患者HSCT后血浆RP值处于较高水平,观察期第8~11天陡然向正值波动,波动幅度△mV为58 mV,第11天确诊发生急性GVHD,IV级;随后其血浆RP值逐渐升高,GVHD的严重程度逐步增加,于第16天死亡(图2b)。
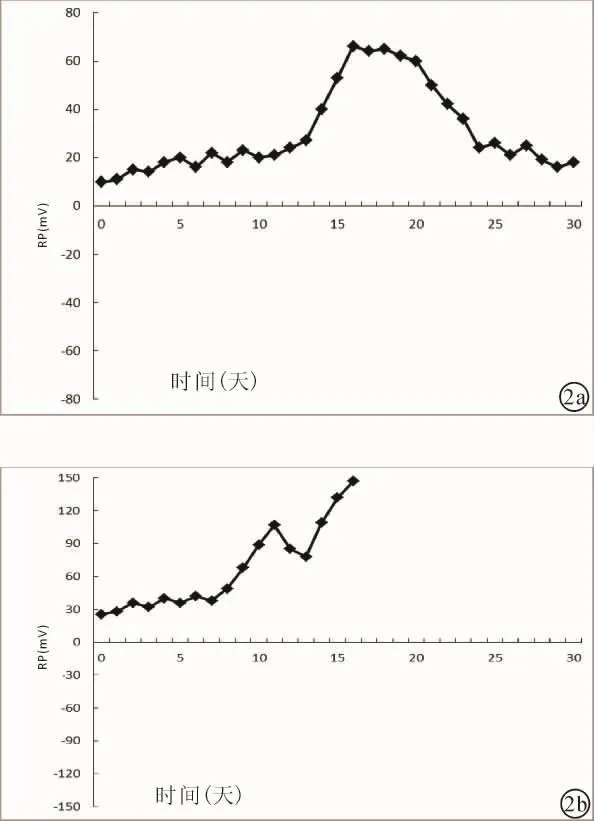
图2 随访期内发生GVHD患者RP值变化趋势 a:在观察期第15~18天血浆RP值出现正向波动,治疗后血浆RP值逐步减低;b:HSCT后血浆RP值处于较高水平,观察期第8~11天向正值波动,发生急性GVHD后血浆RP值逐渐升高,于第16天死亡。
3 讨论
目前GVHD仍是HSCT尤其是异基因HSCT的主要障碍。GVHD不是一个单独的疾病而是输入受者体内的供者淋巴细胞对“异物”做出的正常反应,是由供者源免疫活性细胞介导的攻击宿主细胞和器官的一种过度的炎症反应。因此GVHD可在很多临床条件下发生,并且急性IV级GVHD病死率几乎达 100%。如何早期、及时、非侵入性地诊断GVHD已成为移植术后亟待解决的问题之一。
炎性细胞因子是诱导和维持临床GVHD的中心环节,三阶段细胞因子网络失调是GVHD的病理生理学基础:第一阶段,辐射和化疗导致受者组织的损伤和激活,活化细胞分泌炎性细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1);第二阶段,供者T细胞的激活以Th1细胞因子IL-2、干扰素-γ(IFN-γ)的分泌为特征;第三阶段,由 IFN-γ 致敏的单核巨噬细胞分泌 IL-1、IFN-α[9]。TNF-α 是一种可引起多种生物学效应的炎症因子,包括直接诱导组织损害和引起代谢改变。植入同种异体骨髓和T细胞混合物的小鼠会发生严重的皮肤、肠和肺部损害,并伴有TNF-α水平升高,输入其抗体可抑制靶器官损害,同时给予可溶性受体也可大大降低死亡率[10]。IL-1由激活的单核巨噬细胞产生,具有许多与TNF-α相似的生物学活性。小鼠同种异体骨髓移植模型中将IL-1注入宿主,受鼠出现消耗综合征,死亡率增加。在小鼠GVHD模型中,移植后连续10天给予IL-1受体拮抗剂,防止了大多数动物发生GVHD[11]。因此,过度的炎症反应是GVHD的重要组成部分。
氧化应激是指体内促氧化与抗氧化这两个拮抗体系之间的平衡失调,促氧化作用增强,所引起的一系列病理生理损害。在正常体内,促氧化/抗氧化处于一个平衡状态,病理情况下,氧化作用超过抗氧化系统的清除能力,平衡被破坏,此时机体组织或细胞内氧自由基生成增加和/或清除能力降低,导致氧化物等在体内或细胞内蓄积而引起氧化损伤过程,由此造成脂质、蛋白质、细胞膜和DNA的损伤[12]。而炎症反应与氧化应激有密不可分的关系,炎症反应过程中各种炎症因子会刺激氧化产物的生成,从而产生更多的超氧化物,破坏促氧化/抗氧化的平衡[13~16]。血液中的RP是反应机体内促氧化/抗氧化状态最直接的指标,因此选用血浆RP来反映HSCT后患者的炎症状态[12]。
有学者尝试通过测定RP值来检测血液和其他生物体液、组织的RP[11],并研究了RP测定方法的改进和结果的解释等[17~19]。但是,由于在生物媒介中没有独立的、统一的RP值测量方法,包括测量电极的选择(铂金、黄金或碳),因此,不同研究者获得的数据在比较分析时的可靠性上存在问题[8]。Michael等[13]通过分析矿物盐溶液中铂电极表面上发生的化学过程的机制,发现了某些影响RP值测量的因素。从电化学的角度讲,所谓的生物媒介的RP值是通过测定浸入目的媒介中的铂电极的开路电位值来确定的。这一整体性特质,大致上反映了内稳态的氧化还原平衡状态。因此,测量RP为正数值表示一个平衡向氧化形式转变,这可能表明即将发生氧化应激的可能性,同样,转向负值的RP值表明抗氧化剂的优势及在体内平衡中氧化过程的化学贡献的相应减少[20~23]。现已证明测量PR值时主要的错误来源在于在测量时铂电极表面氧化组分的改变,Michael等改进了铂电极的预处理方法,从而极大地提高了RP数据的再现性[8,24]。本研究中对血浆RP的测量,采用了Michael改进后的方法,以确保检测数据的再现性和可比性。
本研究结果显示,正常对照组、未发生GVHD组、发生GVHD组之间血浆RP值存在差异,表明血浆RP用于HSCT患者术后是否发生GVHD,具有一定的诊断价值,且不同分级患者的血浆RP值变化情况与其临床表现、治疗效果变化情况可能有关。
基于RP数据分析及研究对象的临床表现的比较,我们可以看到,正向的RP值的改变范围大于25 mV(与监测过程中的初始值进行比较),表明移植术并发症或移植功能障碍如移植排斥反应的开始。一般改变的范围大小反映了并发症的严重性。而且上述改变通常先于移植机能障碍或急性排斥反应的临床症状出现之前,也先于血液标志物的改变(例如血常规、骨髓形态学检查、流式细胞术、肝肾功能常规检查等),这一点对于患者发生移植术后并发症的早期诊断具有重要的临床价值。
由于本研究纳组病例数有限,因此较难确定血浆RP值正常参考范围,有待进一步扩大研究病例以确定RP的正常值范围、移植术后监测GVHD的标准。但RP在移植术后并发症的早期提示和病情评估方面的临床价值,已经有了初步的体现。
综上所述,血浆RP值的检测,可在一定程度上提示HSCT术后发生GVHD的风险,其变化与患者临床表现、治疗效果的变化具有相关性,并且该方法简便、无创、适于临床推广。
[1]Klein AA,Lewis CJ,Madsen JC,et al.Organ transplantation.a clinical Guide[M].New York:Cambridge University Press,2011.
[2]Ferrara JLM,Cook KR,Teshima T.The pathophysiology of Graft-versus-Host-Disease in:Graft-versus-Host-Disease[M].Ed.3 th.New York:Marcel Dekker,2005:1-34.
[3]Li Z,Chen L,Rubinstein MP.Cancer immunotherapy:are we there yet[J].Exp Hematol Oncol,2013,2(1):33.
[4]Ratajczak MZ.A novel view of the adult bone marrow stem cell hierarchy and stem cell trafficking[J].Leukemia,2015,29(4):776-782.
[5]Khubutiya MS,Evseev AK,Kolesnikov VA,et al.Measurements of platinum electrode potential in blood and blood plasma and serum[J].Russ J Electrochem,2010,46:537.
[6]Johnsen HE,Beatty PG,Thomas ED,et al.Donor alloreactivity may predict acute graft-versus-host disease in HLA-matched bone marrow transplantation for leukemia in early remission[J].Eur J Haematol,1992,48(5):249-253.
[7]Schulman V,Ayash L,Lazarus H M,et al.Chronic graft-versus-host disease:clinical manifestation and therapy[J].Bone Marrow Transplant,2001,28(6):121-122.
[8]Michael MG,Mogely SK,Anatoly KE,et al.Noninvasive diagnosis of dysfunctions in patients after organ transplantation by monitoring the redox potential of blood serum[J].Transplantation,2015,99(6):1288-1292.
[9]Gupta A,Punatar S,Gawande J,et al.Risk Factors,Pattern and Clinical outcome of acute graft versus host disease in acute leukemia patients undergoing allogeneic stem cell transplant[J].Indian J Hematol Blood Transfus,2015,31(4):404-412.
[10]Lee DA.The off-target effects of nonspecific NK cells[J].Blood,2015,125(5):744-745.
[11]Lu L,Lan Q,Li Z,et al.Critical role of all-trans retinoic acid in stabilizing human natural regulatory T cells under inflammatory conditions[J].Proc Natl Acad Sci USA,2014,111(33):3432-40.
[12]Goldin MM,Volkov AG,Khubutiya MSh,et al.Redox potential measurement in aqueous solutions and biological media[J].ECS Transactions,2008,11:39.
[13]Michaelis L.Oxidation-reduction potentials[M].Philadelphia:JB Lippincott Company,1930:128-131.
[14]Ziegler E.The Redox Potential of the Blood In Vivo and In Vitro[M].Illinois:Charles C,Thomas Publ,1965.
[15]Guo W,Dong A,He M,et al.A Meta-Analysis for Effects of Elevated Pre-Transplantation Serum Ferritin on the Outcomes in Patients Undergoing Hematopoietic Stem Cell Transplantation[J].Cancer Invest,2016,3:1-8.
[16]Zhang XH,Wang QM,Chen H,et al.Clinical characteristics and risk factors of Intracranial hemorrhage in patients following allogeneichematopoietic stem cell transplantation[J].Ann Hematol,2016,95(10):1637-1643.
[17]Marmasse C,Grosz HJ.Direct experimental evidence of a functionally active electron transport system in human blood[J].Nature,1964,202:94.
[18]Grosz HJ,Farmer BB.Reduction-oxidation potential of blood as a function of partial pressure of oxygen[J].Nature,1967,213:717.
[19]White NJ,Collinson MM,Boe RA,et al.Redox monitoring reveals increased susceptibility of whole blood to oxidative stress during hemorrhagic shock[J].Circulation,2008,118:1488.
[20]Tsai AG,Cabrales P,Intaglietta M.The physics of oxygen delivery:facts and controversies[J].Antioxid Redox Signal,2010,12(6):683-691.
[21]Garber HR,Mirza A,Mittendorf EA,et al.Adoptive T-cell therapy for Leukemia[J].Mol Cell Ther,2014,2:25.
[22]Khubutiya MSh,Goldin MM,Romasenko MV,et al.Redox potentials of blood serum in patients with acute cerebral pathology[J].ECS Transactions,2010,25:63.
[23]Sergienkol VI,Khubutiya MSh,Evseev AK,et al.Diagnostic and prognostic possibilities of the redox-potential electrochemical measurements in blood plasma[J].Vestn Ross Akad Med Nauk,2015,6:627-632.
[24]Rael LT,Bar-Or R,Aumann RM,et al.Oxidation-reduction potential and paraoxonase-arylesterase activity in trauma patients[J].Biochem Biophys Res Commun,2007,361:561.
Clinical application of the redox potential of blood plasma in monitoring GVHD after HSCT
ZHONG Linga,CHEN Jiaob,HUANG Xiao-bingb,LI Yan-xina(a.Clinical Laboratory,b.Department of Hematology,Sichuan Academy of Medical Sciences & Sichuan Provincial People's Hospital,Chengdu 610072,China)
Objective To investigate the clinical application of Redox potential of blood plasma in monitoring graft-versus-host disease(GVHD)after hematopoietic stem cell transplantation(HSCT).MethodsWe followed up 59 patients accepted HSCT from Jan 2009 to Dec 2015.During the regular follow-up after HSCT,fasting venous blood samples were taken and redox potential(RP)in blood was measured.At the same time,59 healthy subjects were used as normal control.ResultsThe plasma RP values were-56.2~ -11.2 mV in normal control group.The plasma RP values were-20.8~21.1 mV in 42 patients who did not have GVHD during the period of follow-up.The fluctuation range(△mV)were in 4.4~11.3 mV.The plasma RP values were 10.6~38.8 mV and △mV were 25.8~61 mV in 17 patients who had GVHD.The RP values were 9.8~27.3 mV,13.7~35.1 mV,19.6~43.9 mV and 25.4~49.5 mV in patients with I to IV degree of acute GVHD,respectively.ConclusionThe changes of blood plasma PR values may be associated with GVHD.The measurement of PR value is invasive and simple that is suitable for promotion.
Redox Potential;Plasma;HSCT,GVHD
R446.62
A
1672-6170(2017)04-0033-04
2016-11-18;
2017-03-24)

