丙型病毒性肝炎抗病毒治疗现状
杨思思, 张继明
丙型病毒性肝炎抗病毒治疗现状
杨思思, 张继明
丙型病毒性肝炎; 抗病毒治疗; 干扰素; 直接抗病毒药物
丙型病毒性肝炎(简称丙肝),是由丙型肝炎病毒(HCV)感染引起的病毒性肝炎。据世界卫生组织(WHO)最新统计,全球感染HCV患者超过1.85亿[1],我国普通人群HCV抗体的阳性率约为0.43%[2]。在过去20年,丙肝患者的标准治疗方案是α-干扰素(α-IFN)联合利巴韦林(RBV),即PR方案,该方案的疗程与HCV基因型(genotype,GT)有关,为24周(GT-2 / 3)至48周(GT-1 / 4),少数患者需达到72周(PR应答不佳者)[3],存在药物不良反应大,患者依从性差等缺点。近3年,随着直接抗病毒药物(direct-acting antivirals,DAA)的研发,短疗程、高效、可耐受的DAA联合疗法为丙肝治疗带来了突破性的进展,使丙肝的治愈成为可能。本文就目前丙肝抗病毒治疗的研究现状做一简要综述。
1 DAA药物的研发现状
随着人们对HCV 复制周期以及HCV重要病毒蛋白结构认识的深入,Pawlotsky等[4]发现了其复制过程中3个重要的药物作用靶点:①NS3 / 4A蛋白酶——与HCV多聚蛋白转录后加工处理有关;②NS5B ——为 RNA依赖的RNA聚合酶,是催化HCV RNA合成的关键酶;③NS5A蛋白——与形成复制复合物有关。针对这3个靶点的DAA药物有蛋白酶抑制剂,NS5B聚合酶核苷类似物抑制剂和NS5B聚合酶非核苷类似物抑制剂,NS5A抑制剂4类,见图1[5]。目前第一代DAA药物(telaprevir和boceprevir)除了在部分亚太国家用于联合PR治疗外,大部分国家都已不再使用。自2013年以来,第二代DAA药物在美国、欧盟及部分亚太地区陆续被批准用于抗丙肝治疗,目前在国外上市的第二代DAA药物有9种,药物注册信息见表1[3,6]。
2 PR治疗的价值
PR方案价格相对DAA药物来说便宜很多,仍是目前一些不能获取DAA或资源有限的国家或地区治疗丙肝的主要手段[6]。HCV GT-2 / 3患者对于PR治疗方案高度敏感,西方国家数据显示HCV GT-2 经PR治疗24周后可实现80%的持续病毒学应答(sustained virologic respone,SVR)率[7-11],而我国十一五重大传染病专项丙型肝炎的临床研究表明HCV GT-2 / 3患者治疗24周,SVR率为90%[2]。PR方案治疗HCV GT-1 / 4患者的疗效与白细胞介素(IL)28B基因多态性有关,IL28B基因型CC型患者经PR治疗后应答较好[12-13],而亚太地区患者IL28B基因型以CC型为主[6],PR治疗应答较好。因此,对于不能获取DAA或资源有限的国家或地区,HCV GT-1 / 4 / 6,低病毒载量且IL28B基因型CC型的初治患者和HCV GT-2 / 3的初治患者,可考虑采用PR治疗[6]。对于经PR治疗复发的丙肝患者中只有IL28B基因型CC型患者再次经过PR治疗时可以取得SVR;通过联合DAA药物,可提高经治复发或经治无应答患者的SVR率[6]。
但是PR方案存在诸多缺点,比如干扰素治疗的不良反应和不良事件较多。据一项来自亚洲的报道显示,高达50%的丙肝患者被认为不适合通过干扰素治疗[6];PR方案通过静脉给药,疗程长,为24周(GT-2 / 3)至48周(GT-1 / 4),少数患者需达到72周(PR应答不佳者),需要足够的人力和设施保障治疗过程中的安全性及患者的依从性。因此,面对短疗程、高效、易耐受的DAA疗法,PR方案将被逐步替代,只有在不能获得DAA的情况下才主张采用PR治疗方案。
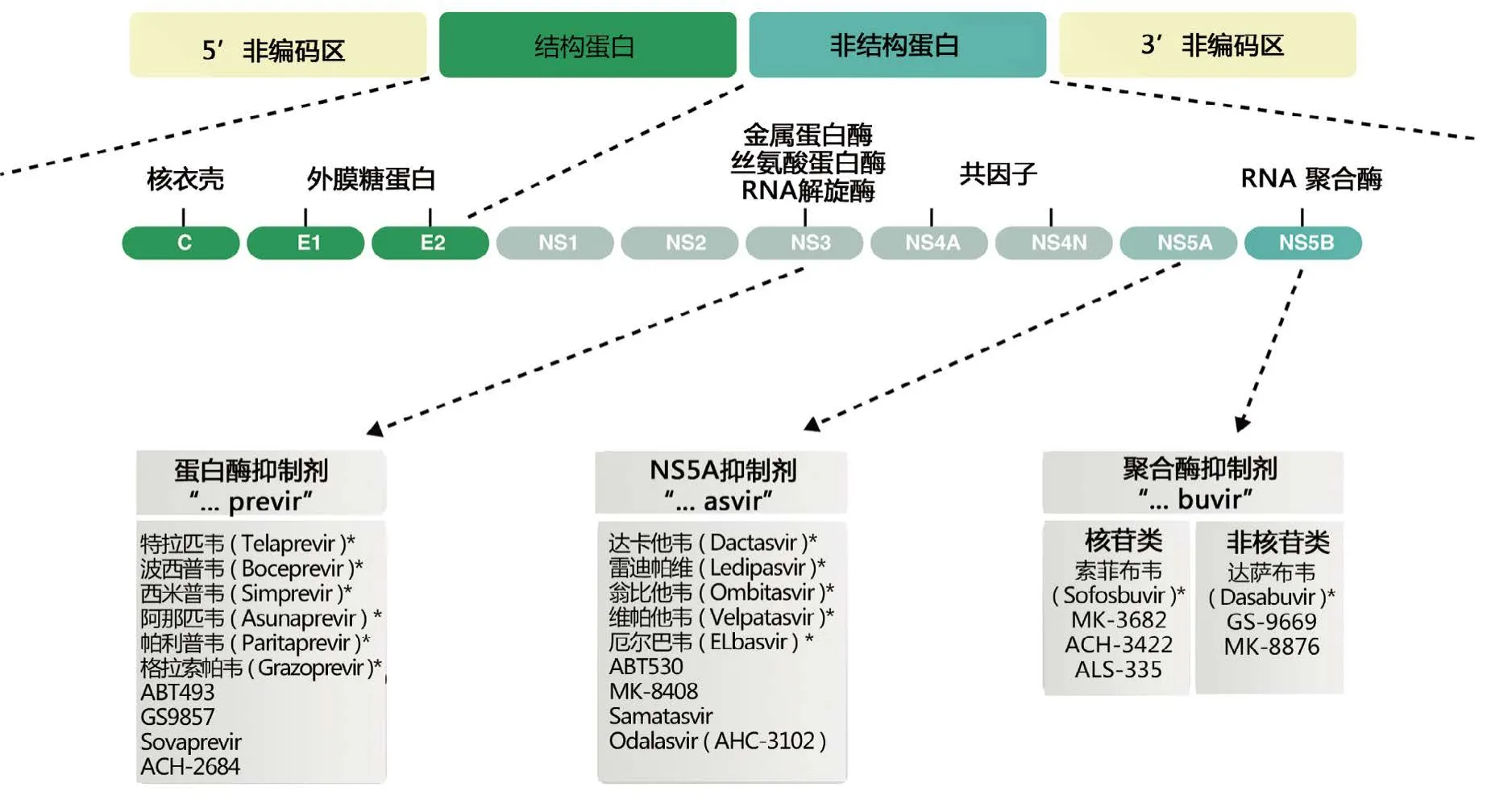
图1 HCV的药物作用靶点及相应的DAA药物
3 不伴肝硬化丙肝患者的治疗
目前不伴肝硬化丙肝患者的治疗主要有PR方案及以DAA为基础的抗病毒方案,其中PR方案疗程24~48周,详见前述,不作为首选,而以DAA 为基础的抗病毒方案包括1个DAA联合PR、多个DAA联合RBV以及不同DAA联合治疗方案,基本可以涵盖所有类型的HCV 现症感染者,尤其适用于PR治疗后复发或对PR治疗应答不佳患者。对于能负担DAA药物治疗的国家,主张采用DAA全口服治疗方案,疗程12~24周,目前推荐使用的不伴肝硬化丙肝患者全口服DAA治疗方案可参考表2[3,6]。对于DAA负担不起的国家可以采用PR单用或联用DAA方案,如PR联合索菲布韦,疗程12周。
4 伴肝硬化丙肝患者的治疗
代偿性肝硬化(Child-Pugh A级)患者的治疗方案有PR方案、PR联合DAA方案及DAA全口服方案。PR方案详见前述,DAA联合PR方案中主要有PR联合索非布韦,疗程12~24周,但这些含干扰素的方案并不作为首选,优先推荐无干扰素的DAA全口服方案,疗程12~24周。目前欧盟及部分亚太国家推荐使用的伴代偿性肝硬化丙肝患者全口服DAA治疗方案可参考表3[3,6]。
失代偿性肝硬化(Child-Pugh B / C级)患者不可进行干扰素治疗,应选择DAA联合RBV的治疗方案,其中蛋白酶抑制剂(帕利普韦、格拉索帕韦、西米普韦、阿那匹韦)是失代偿肝硬化的治疗禁忌。RBV的使用要慎重,起始剂量为600 mg / d,可依次加至1 000 mg / d(体重<75 kg)或1 200 mg / d(体重≥75 kg),根据患者的血红蛋白情况调整剂量。所有基因型患者均可以采用索菲布韦联合维帕他韦和RBV的治疗方案,疗程12周(GT-1 / 2 / 4 / 5 / 6)或24周(GT-3)[14]。对于HCV GT-1 / 2 / 4 / 5 / 6患者,可采用索非布韦联合达卡他韦和RBV的治疗方案,疗程12周[3,15]。索非布韦联合雷迪帕韦和RBV的方案也可用于GT-1 / 4 / 5 / 6患者,疗程12周[16-17]。以上用于治疗失代偿性肝硬化患者的DAA一般不需调整剂量[3],如果患者出现肝肾综合征且肾小球滤过率(eGFR)<30 mL / (min·1.73 m2)时尽量避免使用索非布韦,必要使用时需根据eGFR调整剂量。
所有肝硬化患者获得SVR后仍需定期随访肝脏超声监测肝细胞肝癌。
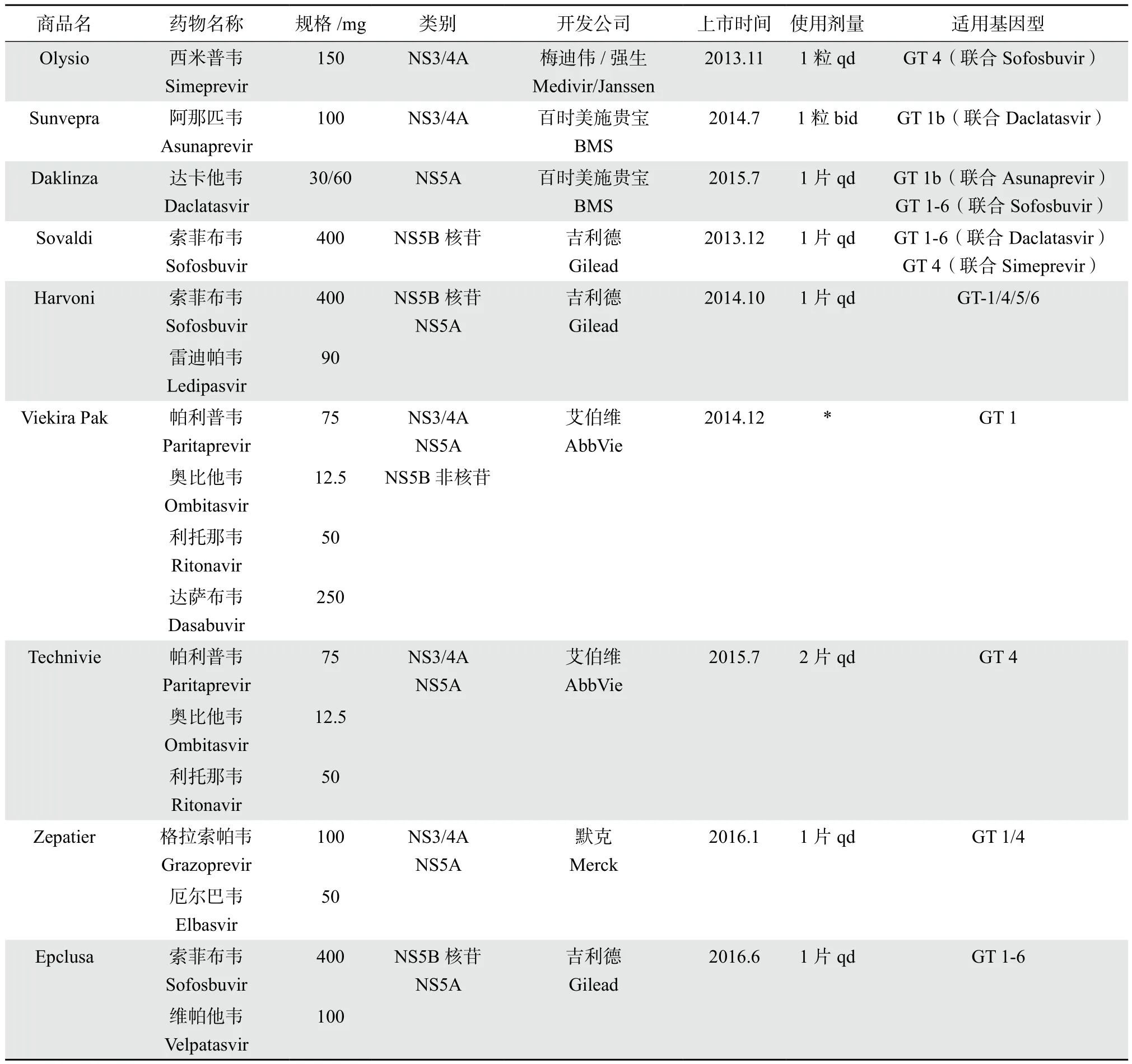
表1 美国、欧盟及部分亚太国家批准上市的DAA药物
5 既往经DAA治疗失败患者的治疗
既往经蛋白酶抑制剂(帕利普韦、格拉索帕韦、西米普韦、阿那匹韦)或NS5A抑制剂(达卡他韦、雷迪帕韦、翁比他韦、维帕他韦、厄尔巴韦)或非核甘类蛋白酶抑制剂(达萨布韦)治疗失败的患者可分别在NS3蛋白酶区、NS5A及聚合酶区找到耐药相关位点(RAS)突变,因此经DAA治疗失败的患者如无紧急治疗的指征,可先进行RAS的检测,指导再次治疗时的药物选择[3]。
既往经DAA治疗失败的患者应再次进行无干扰素的DAA方案治疗,且应选择高耐药屏障的DAA药物,目前来说只有索非布韦[18-19],因此再次治疗的DAA方案应包括索非布韦。索菲布韦基础上联用1~3个其他DAA药物,药物之间最好不存在交叉耐药位点,再联用RBV,一般患者疗程12周,而难治性患者如失代偿期肝硬化患者,疗程应延长至24周;对于存在RBV治疗禁忌证或不能耐受RBV治疗的患者,可不联合RBV,疗程24周[3]。
目前关于DAA治疗失败患者的治疗方案的循证医学证据较少,有待更大样本的研究。经索非布韦单药或索非布韦联合RBV或索非布韦联合PR治疗失败的患者可考虑索菲布韦联合维帕他韦或索非布韦联合达卡他韦(所有基因型)、索非布韦联合雷迪帕韦(GT-1 / 4 / 5 / 6)、格拉索帕韦联合厄尔他韦(GT-1 / 4)、3-D(GT-1)、2-D或索非布韦联合西米普韦(GT-4)等方案。经索非布韦联合西米普韦治疗失败的GT-1 / 4患者可进行索非布韦联合雷迪帕韦或索非布韦联合维帕他韦或索非布韦联合达卡他韦的治疗方案。经NS5A抑制剂治疗失败的GT-1 / 4患者可选用格拉索帕韦联合厄尔巴韦或索非布韦联合西米普韦和达卡他韦,或索非布韦联合3-D(GT-1)和索非布韦联合2-D(GT-4)。经NS5A抑制剂治疗失败的GT-1 / 4患者可考虑索菲布韦联合维帕他韦和RBV治疗24周[3]。
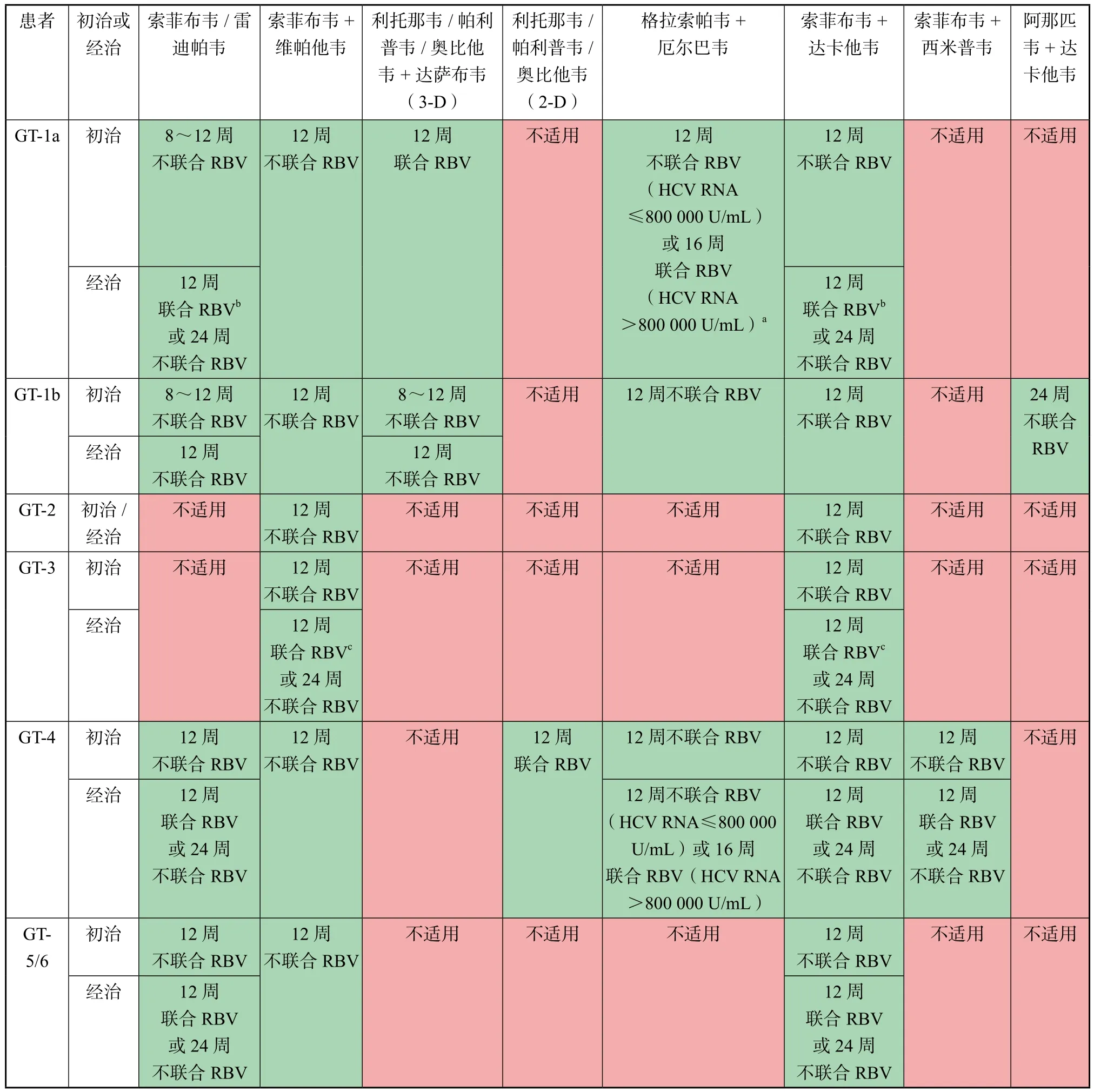
表2 针对不合并肝硬化HCV感染者的抗HCV治疗方案(初治或PR经治疗失败)
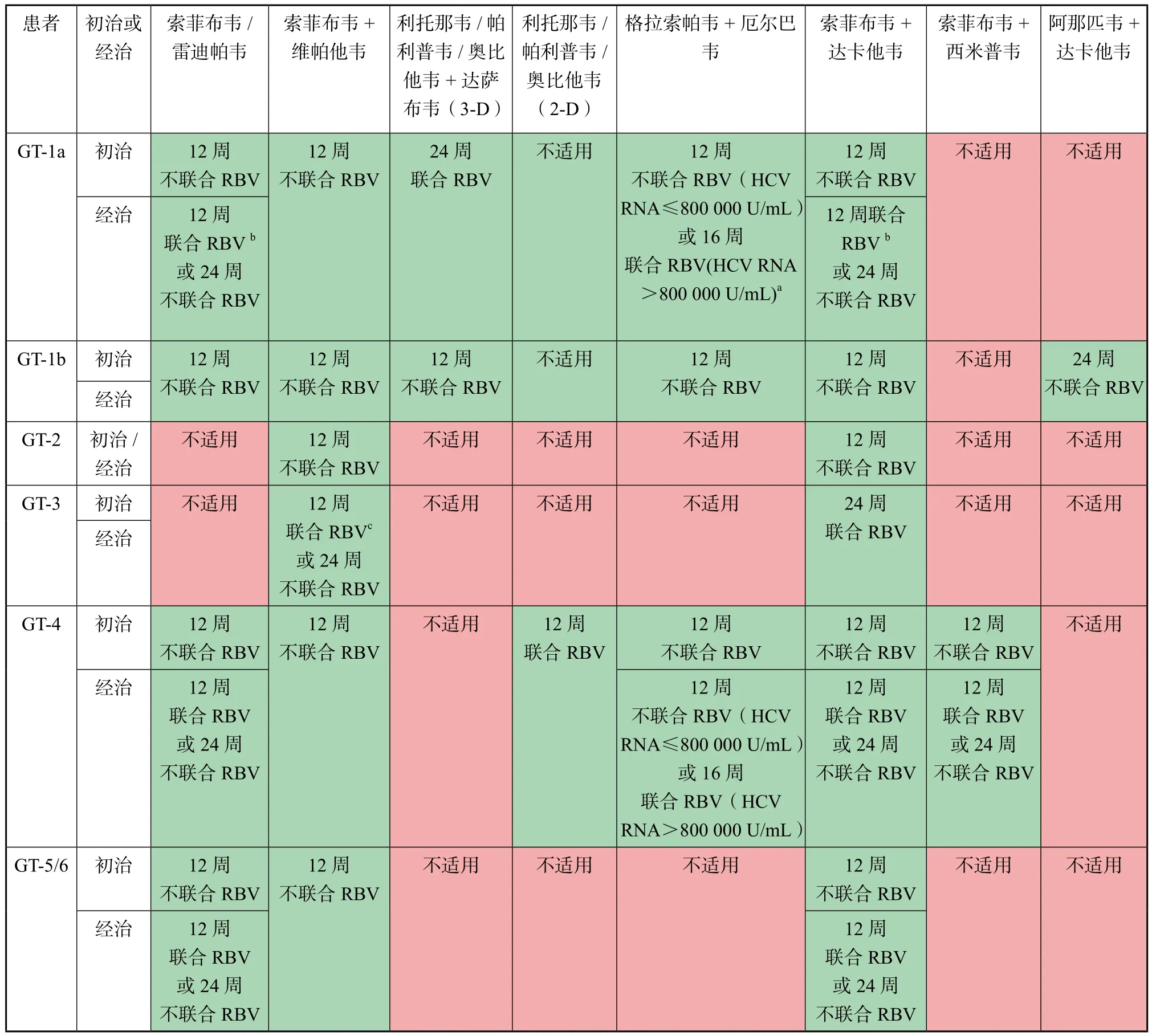
表3 针对合并代偿性肝硬化HCV感染者的抗HCV治疗方案(初治或PR经治疗失败)
6 结语
丙肝治疗取得了巨大的进展,PR方案不再是首选治疗方案,取而代之的是DAA治疗方案,而丙肝的DAA治疗方案正朝着高治愈率、泛基因型活性、不良反应小、耐药率低、疗程短、经济可负担等方向发展,这些不断优化的治疗方案使丙肝的治愈成为可能。
[1] WORLD HEALTH ORGANIZATION. Guidelines for the screening care and treatment of persons with chronic hepatitis C infection: updated version[M]. Geneva: World Health Organization, 2016.
[2] 陈红松, 窦晓光, 段钟平, 等. 丙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015,31(12):1961-1979.
[3] European Association for Study of Liver. EASL recommendations on treatment of hepatitis C 2015[J]. J Hepatol, 2015,63(1):199-236.
[4] PAWLOTSKY JM, CHEVALIEZ S, MCHUTCHISON JG. The hepatitis C virus life cycle as a target for new antiviral therapies[J]. Gastroenterology, 2007,132(5):1979-1998.
[5] ASSELAH T, BOYER N, SAADOUN D, et al. Direct-acting antivirals for the treatment of hepatitis C virus infection:optimizing current IFN-free treatment and future perspectives[J]. Liver Int, 2016,36(Suppl 1):47-57.
[6] OMATA M, KANDAT, WEI L, et al. APASL consensus statements and recommendation on treatment of hepatitis C[J]. Hepatol Int, 2016,10(5): 702-726.
[7] SHIFFMAN ML, SUTER F, BACON BR, et al. Peginterferon alfa-2a and ribavirin for 16 or 24 weeks in HCV genotype 2 or 3[J]. N Engl J Med, 2007,357(2):124-134.
[8] MANGIA A, SANTORO R, MINERVA N, et al. Peginterferon alfa-2b and ribavirin for 12 vs. 24 weeks in HCV genotype 2 or 3[J]. N Engl J Med, 2005,352(25):2609-2617.
[9] HADZIYANNIS SJ, SETTE H JR, MORGAN TR, et al. Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose[J]. Ann Intern Med, 2004,140(5):346-355.
[10] ZEUZEM S, HULTCRANTZ R, BOURLIERE M, et al. Peginterferon alfa-2b plus ribavirin for treatment of chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3[J]. J Hepatol, 2004,40(6):993-999.
[11] LAGGING M, LANGELAND N, PEDERSEN C, et al. Randomized comparison of 12 or 24 weeks of peginterferon alpha-2a and ribavirin in chronic hepatitis C virus genotype 2 / 3 infection[J]. Hepatology, 2008,47(6):1837-1845.
[12] TANAKA Y, NISHIDA N, SUGIYAMA M, et al. Genomewide association of IL28B with response to pegylated interferonalpha and ribavirin therapy for chronic hepatitis C[J]. Nat Genet, 2009,41(10):1105-1109.
[13] SUPPIAH V, MOLDOVAN M, AHLENSTIEL G, et al. IL28B is associated with response to chronic hepatitis C interferonalpha and ribavirin therapy[J]. Nat Genet, 2009,41(10):1100-1104.
[14] CURRY MP, O'LEARY JG, BZOWEJ N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated Cirrhosis[J]. N Engl J Med, 2015,373(27):2618-2628.
[15] MANGIA A, ARLEO A, COPETTI M, et al. The combination of daclatasvir and sofosbuvir for curing genotype 2 patients who cannot tolerate ribavirin.[J]. Liver Int, 2016, 36(7):971-976.
[16] AFDHAL N, ZEUZEM S, KWO P, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection[J]. N Engl J Med, 2014,370(20):1889-1898.
[17] AFDAL N, REDDY KR, NELSON DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection[J]. N Engl J Med, 2014,370(16):1483-1493.
[18] SARRAZIN C. The importance of resistance to direct antiviral drugs in HCV infection in clinical practice[J]. J Hepatol, 2016,64(2):486-504.
[19] PAWLOTSKY JM. Hepatitis C virus resistance to direct-acting antiviral drugs in interferon-free Regimens[J]. Gastroenterology,2016,151(1):70-86.
Current antiviral therapy for hepatitis C
YANG Sisi, ZHANG Jiming. (Department of Infectious Diseases, Huashan Hospital, Fudan University, Shanghai 200040, China)
R512.63
A
1009-7708 ( 2017 ) 04-0474-06
10.16718/j.1009-7708.2017.04.024
2016-12-08
2017-01-11
复旦大学附属华山医院感染科,上海 200040。
杨思思(1992—),女,硕士研究生,主要从事肝炎病毒研究。
张继明,E-mail: jmzhang@fudan.edu.cn。

