黏膜相关恒定T细胞水平在脓毒症患者中的临床意义
毛玉林, 陆珠凤, 黄俊峰, 冒海蕾, 张 颖, 张晓明, 诸杜明
黏膜相关恒定T细胞水平在脓毒症患者中的临床意义
毛玉林1, 陆珠凤1, 黄俊峰1, 冒海蕾1, 张 颖2, 张晓明2, 诸杜明1
目的 研究脓毒症患者外周血循环黏膜相关恒定T细胞(MAIT细胞)的数量及活化状态。方法 使用流式细胞技术测定外周血MAIT细胞的数量、比例和CD69活化分子的表达。结果 脓毒症患者在疾病早期外周血MAIT细胞数量显著下降;在入住ICU的第1天与第3天,脓毒症组患者MAIT细胞的CD69表达量维持在较高水平。结论 严重感染为特征的患者外周血MAIT细胞数量显著减少提示可能会发生脓毒症。
黏膜相关恒定T细胞; 脓毒症; 抗感染免疫; 预后
在2016年的《脓毒症和脓毒症休克第三次国际共识定义(sepsis-3)》中,脓毒症被定义为感染引起宿主调节紊乱而导致的威胁生命的脏器功能障碍[1]。在脓毒症的发病过程中,机体免疫系统会出现不同程度的缺陷,促炎因子与抗炎因子比例失调,固有免疫细胞持续激活,效应细胞数量缺少或功能障碍,抑制性免疫细胞的功能活动相对增强,导致机体不能产生有效的清除病原体的免疫活动,但造成这种免疫紊乱的根源目前仍不清楚[2]。
有学者认为,固有免疫反应紊乱可能是脓毒症的主要决定因素[3]。黏膜相关恒定T细胞(mucosal-associated invariant T cells,MAIT细胞)是一群进化保守的固有样T淋巴细胞,此类细胞因其嗜组织性,倾向于分布在肠道黏膜固有层而得名[4]。其实,除了黏膜组织,MAIT细胞在肝脏、外周血中的含量也相当丰富[5]。近年来发现,MAIT细胞与B族维生素代谢产物有关[6],在炎症早期可识别多种细菌、真菌并启动自身活化,分泌炎性反应细胞因子,杀伤病原微生物,并构建起衔接固有免疫和适应性免疫的桥梁[7-8]。目前,对MAIT细胞与感染性疾病的研究,主要集中在结核病、肺炎、AIDS、肝炎等疾病[9],Grimaldi等[3]发现重症脓毒症患者外周血MAIT细胞频数明显减少,但国内外文献关于MAIT细胞在脓毒症中作用的报道较少。本研究旨在通过研究脓毒症患者外周血循环MAIT细胞的改变来探索早期预测脓毒症发生发展的方法,从免疫微环境的角度为临床疾病的诊断提供新的线索。
1 材料与方法
1.1 一般资料
1.1.1 病例选择 选择2015年8月-2016年8月在复旦大学附属中山医院就诊的外科患者36例,平均年龄(68.5±9.4)岁,其中男28例,女8例。患者中因感染性疾病手术术后合并发生脓毒症22例,设为术后脓毒症组(S组);非感染性疾病手术正常康复患者14例,设为术后正常恢复组(F组)。另选取13例正常健康人,设为健康对照组(N组)。S组患者均符合2016年美国胸科医师学院(ACCP) / 美国危重病医学会(SCCM)共识会议制定的Sepsis 3.0所列诊断标准:感染所致的序贯性脏器功能衰竭(sequential organ failure assessment,SOFA)评分≥2可诊断脓毒症;脓毒症休克是脓毒症中较严重的一种类型,即经过充分的液体复苏,患者仍需要升压药来维持,平均动脉压(MAP)>65 mmHg,同时血清乳酸水平>2 mmol / L。
1.1.2 排除标准 先天性或获得性免疫功能缺陷;存在心、肝、肾等慢性器质性病变;自身免疫性疾病(病毒性肝炎、HIV感染等);精神疾病;入院前3个月内使用过皮质类固醇或其他免疫抑制剂。
1.1.3 病情危重程度及预后评估方法 ① SOFA评分;②急性生理和慢性健康评分(APACHE II评分)。
1.1.4 伦理审批及知情同意 本研究已提呈复旦大学附属中山医院伦理委员会并通过审批,课题开展前向家属及意识清醒患者告知研究目的和方法并取得知情同意。
1.2 方法
1.2.1 标本采集 采集外周血,每次5 mL。所得血样2 h内即行血细胞计数并提取外周血单个核细胞(PBMC)。
1.2.2 采血时间 S组患者于术后确定脓毒症诊断的24 h内和第3天动态采集血样,F组患者术后第1个24 h内抽取血样,N组为健康体检时采集血样。
1.2.3 PBMC 染色所用抗体及荧光通道,见表1。
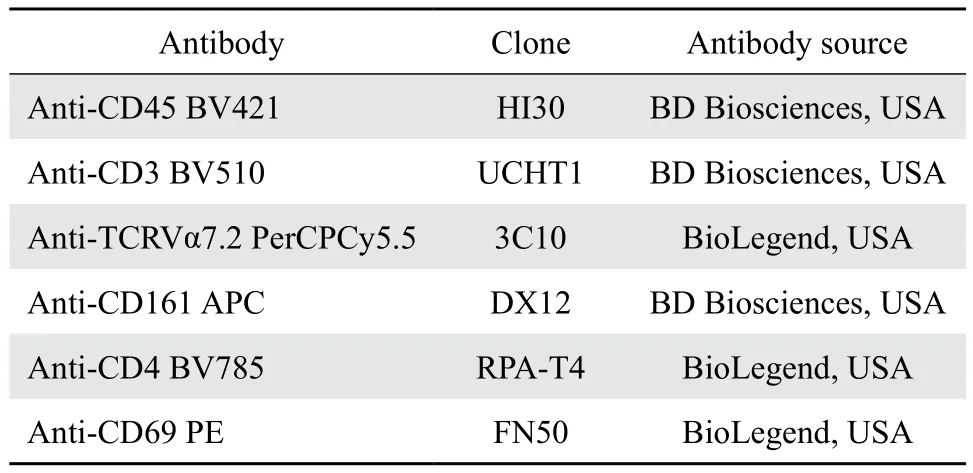
表1 流式细胞染色所用抗体Table 1 Antibodies used in f l ow cytometry
1.2.4 实验方法 将上述抗体进行滴定后按适当比例混合成抗体混合物(mixture),每(1~2)×106PBMC中加入50 μL混合抗体,避光,常温染色15 min,洗涤后2 %甲醛固定,LSR Fortessa流式细胞仪检测,S组最后入组的6例患者和N组、F组患者同时测定T细胞CD69表达量。实验步骤参照厂家实验操作指南进行。
1.2.5 数据分析 流式细胞仪所获得数据用FlowJo V9.3.2进行调节补偿并数据分析。
1.2.6 统计学方法 数据资料用SPSS 22.0软件进行统计学处理,组间比较采用各组第1次取样数据。数据采用均数±标准差(x±s)或中位数(四分位数间距P25,P75)表示,符合正态分布、方差齐性的两组数据比较采用独立样本T检验,三组数据间比较采用单因素方差分析;不符合正态分布的三组数据比较采用Kruskal-Wallis H秩和检验,组间两两比较采用Mann-Whutney U秩和检验;S组第1天与第3天的配对数据采用Wilcoxon检验。P<0.05为差异有统计学意义。
2 结果
2.1 入组病例基本情况
三组病例入组年龄无统计学差异。S组并发脓毒症的病因为消化道穿孔16例、化脓性胆管炎6例。患者病情危重程度和预后采用SOFA评分和APACHE II评分。S组APACHE II评分明显高于F组患者评分,P<0.05,差异有统计学意义。见表2。
2.2各组病例血常规绝对值和相对值比较
S组和F组患者外周血中性粒细胞数量均高于N组,差异有显著统计学意义。而S组患者外周血淋巴细胞数量明显少于F组和N组。S组和N组患者单核细胞数量差异无统计学意义。见表3。

表2 各组病例一般资料Table 2 General data of patients compared between groups
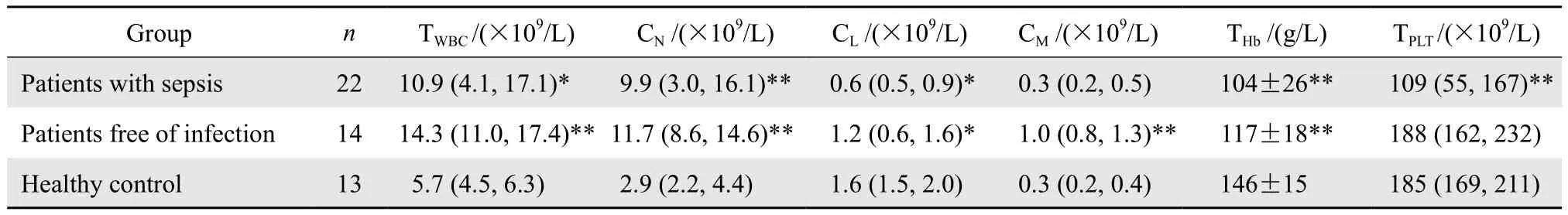
表3 各组血样血细胞计数Table 3 Blood cell counts compared between groups[mean ± SD or median (P25, P75)]
2.3 MAIT细胞绝对值和相对值的分析

图1 MAIT 细胞的流式分析途径Figure 1 Strategy for f l ow cytometric analysis of mucosal associated invariant T (MAIT) cells
MAIT 细胞绝对计数S组对F组、F组对N组,P<0.01,差异有统计学意义;S组对N组,P<0.001,差异有显著统计学意义。
MAIT细胞在T细胞中所占百分比S组对N组,P<0.01, S组明显降低,差异有显著统计学意义;F组对N组、S组对F组,P>0.05,差异无统计学意义,见图2。
2.3.2 S组组内数据分析 与第1天基线值相比,S组患者第3天的MAIT绝对数和MAIT细胞占T细胞百分比有轻度升高,但差异无统计学意义,见图3。
2.4 MAIT 细胞活化状态分析
2.4.1 活化MAIT细胞比例分析 CD69是一种Ⅱ型跨膜糖蛋白,又称活化诱导分子,体内外T淋巴细胞活化均可激活CD69,它是T淋巴细胞活化最早表达的膜表面分子。
CD69+MAIT细胞在总MAIT细胞相对占比分析:S组对N组,P<0.001,S组表达量明显增高,差异有显著统计学意义;S组对F组、F组对N组,P<0.01,差异有显著统计学意义。
CD69+CD3+CD4-非MAIT(Non-MAIT)细胞占总CD3+CD4-non-MAIT细胞相对值分析:S组对N组,P<0.05,差异有统计学意义。见图4。
在CD3+CD4+T细胞群中,CD69表达量在各组差异无统计学意义。
2.4.2 S组组内活化MAIT细胞的动态变化 选取6例S组患者在确诊后1 d和3 d对MAIT细胞活化指标进行了动态观察,发现S组患者在确诊的第1天与第3天MAIT细胞持续高表达CD69,见图5。

图2 三组患者外周血 MAIT 细胞百分比与绝对数比较Figure 2 The number and percentage of circulating mucosal associated invariant T (MAIT) cells compared between three groups
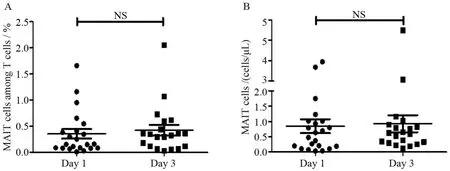
图3 S 组患者第1天与第3天外周血 MAIT 细胞百分比与绝对数比较Figure 3 The number and percentage of circulating mucosal associated invariant T (MAIT) cells on day 1 and day 3 in patients with sepsis
2.5 MAIT细胞数量与预后的关系
在三组病例中,最后S组出现了4例死亡,病死率18.18 %。死亡组患者MAIT细胞数量及百分比与存活组的数据相比,差异无统计学意义。F组和N组未出现随访期间(28 d内)死亡。
3 讨论
MAIT细胞是一群在进化上高度保守的T淋巴细胞,它有一条相对固定的T细胞抗原受体(T cell antigen receptor,TCR)α链并被Ⅰb型主要组织相容性复合体相关分子(major histocompatibility complex class Ib molecule,MHC class I-related protein 1,MR1)限制[5]。在血循环中,MAIT细胞占总T细胞的1 %~10 %,但由于其具有能识别细菌来源的B族维生素代谢产物而触发激活,表达IFN-γ、TNF-α、颗粒酶(granzyme)、穿孔素(perforin)等杀伤性细胞因子,构建固有免疫屏障的防线而引起关注[10]。随着进一步研究,科学家们还发现MAIT细胞还能分泌IL-2、IL-17等细胞因子,和B细胞有互相作用,是沟通固有免疫和适应性免疫应答之间的桥梁[11]。MAIT细胞富集于肝脏、肠道、呼吸道黏膜等器官组织,与其高表达及迁移相关的趋化因子受体有关。
本研究发现在脓毒症患者中,循环MAIT细胞数量明显减少,其绝对值和占总T细胞相对值都出现统计学意义的下降,两者之中下降比例以相对值下降为更甚,表明发生严重感染时,MAIT细胞亚群在T细胞参与抗炎免疫时,群体数量不足。本研究的发现与国外对干燥综合征、急性胆囊炎、斑疹伤寒、肝炎、结核、铜绿假单胞菌感染、炎性肠病、红斑狼疮、类风湿性关节炎等的研究发现类似,MAIT细胞表达量下降常预示疾病的严重状态[12-13]。

图4 三组患者 T 细胞各亚型表达 CD69 百分比Figure 4 The expression of CD69 on different T cell subsets compared between three groups
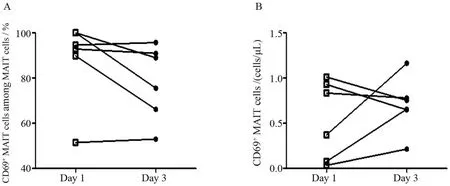
图5 脓毒症患者 CD69+MAIT细胞百分比及其绝对数Figure 5 The percentage and number of CD69+mucosal associated invariant T (MAIT) cells in septic patients
CD69是淋巴细胞的一个极早期活化分子,正常人外周血T淋巴细胞很少表达,但遭受抗原刺激1~2 h之内,就可迅速表达CD69。有研究发现,CD69可以通过诱导胞内转化生长因子β(transforming growth factor β,TGF-β)的产生发挥负向免疫调节作用[14],并且,CD69是Treg细胞(regulatory T cells)发挥调节性抑制功能的一个重要受体[15]。我们发现,相比N组,F组和S组患者外周血循环MAIT细胞的CD69表达量依次逐渐升高,从另一个方面反映了三组人群的免疫状态。在严重感染早期CD69+MAIT细胞的比例显著升高,S组与同期F组和N组均存在显著统计学差异,表明这可能是一个反映疾病严重状态的重要信号。
本研究发现,患者的外周血循环MAIT细胞数量显著减少,提示患者可能易发生脓毒症。由于MAIT细胞具有调节炎症微环境、分泌细胞因子直接杀伤感染细胞、加强适应性免疫应答的作用,MAIT细胞可能是有效控制炎性感染的诊断和治疗靶点之一。MAIT细胞发现的时间并不长,该群细胞的功能、调控机制、上下游信号通路还有很多未知。本研究是我们对脓毒症患者的一个探索性研究,由于样本量较少,MAIT细胞数量的变化趋势与患者预后的关系并不明朗,有待通过大样本验证,进一步评价MAIT细胞相关指标的临床意义。
[1] SINGER M, DEUTSCHMAN CS, SEYMOUR CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016,315(8):801-810.
[2] STEARNS-KUROSAWA DJ, OSUCHOWSKI MF,VALENTINE C, et al. The pathogenesis of sepsis[J]. Ann Rev Pathol, 2011,6(1):19-48.
[3] GRIMALDI D, LE BOURHIS L, SAUNEUF B, et al. Specif i c MAIT cell behaviour among innate-like T lymphocytes in critically ill patients with severe infections[J]. Intensive Care Med, 2014,40(2):192-201.
[4] TREINER E, DUBAN L, BAHRAM S, et al. Selection of evolutionarily conserved mucosal-associated invariant T cells by MR1[J]. Nature, 2003,422(6928):164-169.
[5] MARTIN E, TREINER E, DUBAN L, et al. Stepwise development of MAIT cells in mouse and human[J]. PLoS Biol,2009,7(3):e54.
[6] KJER-NIELSEN L, PATEL O, CORBETT AJ, et al. MR1 presents microbial vitamin B metabolites to MAIT cells[J]. Nature, 2012, 491(7426): 717-723.
[7] SZABO PA, ANANTHA RV, SHALER CR, et al. CD1d- and MR1-restricted T cells in sepsis[J]. Front Immunol, 2015,6:401.
[8] NAPIER RJ, ADAMS EJ, GOLD MC, et al. The role of mucosal associated invariant T cells in antimicrobial immunity[J]. Front Immunol, 2015,6:344.
[9] WONG EB, NDUNG'U T, KASPROWICZ VO. The role of mucosal-associated invariant T cells in infectious diseases[J]. Immunology, 2017,150(1):45-54.
[10] KURIOKA A, USSHER JE, COSGROVE C, et al. MAIT cells are licensed through granzyme exchange to kill bacterially sensitized targets[J]. Mucosal Immunol, 2014,8(2):429-440.
[11] DUSSEAUX M, MARTIN E, SERRIARI N, et al. Human MAIT cells are xenobiotic-resistant, tissue-targeted, CD161hi IL-17-secreting T cells[J]. Blood, 2011,117(4):1250-1259.
[12] LEEANSYAH E, GANESH A, QUIGLEY MF, et al. Activation, exhaustion, and persistent decline of the antimicrobial MR1-restricted MAIT-cell population in chronic HIV-1 infection[J]. Blood, 2013,121(7):1124-1135.
[13] WANG JJ, MACARDLE C, WEEDON H, et al. Mucosalassociated invariant T cells are reduced and functionally immature in the peripheral blood of primary Sjogren's syndrome patients[J]. Eur J Immunol, 2016,46(10):2444-2453.
[14] ZHANG X, JIANG Z, GU Y, et al. Inflammation-induced CD69+ Kupffer cell feedback inhibits T cell proliferation via membrane-bound TGF-beta1[J]. Sci China Life Sci, 2016,59(12):1259-1269.
[15] CORTES JR, SANCHEZ-DIAZ R, BOVOLENTA ER, et al. Maintenance of immune tolerance by Foxp3+ regulatory T cells requires CD69 expression[J]. J Autoimmun, 2014,55:51-62.
Clinical implications of circulating mucosal associated invariant T (MAIT) cells in septic patients
MAO Yulin, LU Zhufeng, HUANG Junfeng, MAO Hailei, ZHANG Ying, ZHANG Xiaoming, ZHU Duming. (Department of Critical Care Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
Objective To investigate the number and activation status of circulating mucosal associated invariant T (MAIT) cells in patients with sepsis. Methods Flow cytometric method was used to determine the number and percentage of MAIT cells and their expression of activation molecule CD69. Results The circulating MAIT cells dropped signif i cantly at early stage of sepsis in septic patients. The MAIT cells in the sepsis group continued to express high levels of CD69 on day 1 and day 3 after admission to ICU. Conclusions Remarkable decrease of circulating MAIT cells may portend the possibility of sepsis in patients with severe infection.
mucosal associated invariant T cells; sepsis; anti-inf l ammatory immune response; prognosis
R631.2
A
1009-7708 ( 2017 ) 04-0376-06
10.16718/j.1009-7708.2017.04.006
2017-02-28
2017-04-20
国家自然科学基金(31470879);复旦大学附属中山医院青年基金(2016ZSQN20)。
1. 复旦大学附属中山医院重症医学科,上海 200032;2. 中国科学院上海巴斯德研究所。
毛玉林(1988—),男,硕士研究生,住院医师,主要从事脓毒症细胞免疫学方面的研究。
诸杜明,E-mail:duming_zhu@163.com。

