大鼠心肌缺血模型制备方法的比较及改进浅析
张世田,庞路路,唐汉庆*,黄岑汉
(1.右江民族医学院,广西 百色 533000; 2.广西中医药大学,南宁 530000)
大鼠心肌缺血模型制备方法的比较及改进浅析
张世田1,庞路路2,唐汉庆1*,黄岑汉1
(1.右江民族医学院,广西 百色 533000; 2.广西中医药大学,南宁 530000)
虽然大鼠冠心病心肌缺血模型的制备方法在许多文献记载中描述比较详细,实用价值比较高,并被诸多学者选择作为研究人类疾病及药物药理作用的动物疾病模型,但其操作性和可行性仍有一定不足。本文通过实验重新选择冠脉结扎部位、简化操作步骤、改进实验方法重新造模,取得了满意的效果。本文就大鼠冠心病心肌缺血模型制备方法的选择、具体操作过程、影响因素等进行综合评述,为研究者选择合适的动物疾病模型提供参考。
冠心病;心肌缺血;动物模型;方法;心脏;手术
动物疾病模型是人类研究疾病的重要工具,在生物医学研究中广泛应用[1]。制备具有与疾病相似度高、重复性好,尽可能模拟人类疾病的发生、发展状态及典型病理变化等优点的动物疾病模型,用于探索疾病的病因、发病机制、治疗和预防,是动物实验研究到临床研究过程中必不可少的一步,动物疾病模型的准确制备为临床研究和治疗提供很好的研究平台。尽管已有很多参考文献记载冠心病心肌缺血模型的具体操作过程,但对于初次研究者,在实际研究或操作过程中,一些细节问题相关文献没有具体描述或描述不清,导致造模失败或成功率较低,多走一些弯路,造成一些不必要的损失。为提高大鼠冠心病心肌缺血模型制备的成功率,下面以结扎大鼠左心回旋支为例,介绍冠心病心肌缺血模型制备过程中改进的一些方法和建议,为后续研究者为此动物疾病模型的制作提供参考和指导。
1 动物心肌缺血模型与临床冠心病的区别
动物心肌缺血模型的制备是通过对健康动物冠状动脉采取手术结扎或药物阻断冠状动脉供血,引起心肌缺血、缺氧导致心肌坏死。临床冠心病[2],是在多种危险因素,如年龄、吸烟、高血压、高脂血症、糖尿病、肥胖、高同型半胱氨酸血症等原因,在冠状动脉血管内壁逐步引起冠状动脉粥样硬化病变导致血管腔狭窄、闭塞,造成心肌缺血、缺氧甚至坏死而导致的心脏病。从病因和病理变化过程来看两者有着本质的区别,而缺血后的病理生理变化和转归两者有很大的相似性。因此,冠状动脉心肌缺血模型与临床冠心病既有区别,又有一定程度的相似性,在借用该动物模型进行生物医学研究时,应该根据研究的目的和意义,正确选择和利用动物疾病模型与人类疾病的相似点作为研究的方向。
2 心肌缺血模型动物及造模方法的比较与选择
2.1 心肌缺血模型动物选择
常用的实验动物有小型猪、犬、猫、兔、大鼠等[3],动物越大,其生理学特性、结构及功能越与人接近,动物越小,器官越小,结构和功能差异越大,手术操作的难度增大。大鼠具有体型大小适中,价格低廉,适应性强,繁殖快,切口出血少,抗感染能力强,易饲养管理、给药方便等优点,是冠心病心肌缺血模型制作的良好动物选择。根据多次实验得出结论,体重一般选择在250 ~ 300 g之间成年Wistar或SD大鼠造此疾病模型比较合适[4],体重太小,耐受性差,心脏太小,不易操作,成活率低;体重太大,适应及可塑性差,死亡率高。因此,动物疾病模型,不仅要选择合适的动物,还要根据临床疾病的特点,依据动物年龄和体重,判断最佳的造模时间。
2.2 心肌缺血模型造模方法选择
大鼠冠心病心肌缺血模型比较成熟的的制作方法有开胸手术结扎法和药物法两种[3],开胸手术法是通过开胸后直视下做冠状动脉结扎,阻断其血流,致使心肌缺血坏死,如果结扎一段时间,使冠状动脉再通,那就是心肌缺血再灌注模型。开胸手术法目的明确,方法简单,结扎部位准确,造模成功率高,但手术创伤、感染、定位不准确、操作不熟练等原因,易造成实验动物损伤、手术并发症等原因死亡而导致造模失败。药物法常使用异丙肾上腺素(isoprenaline,ISO)或垂体后叶素(pituitrin,Pit)[5],通过尾静脉注射,引起心肌需氧量增大、冠状动脉痉挛、收缩,导致心肌缺血坏死,不同剂量的药物造成不同程度心肌缺血性损伤,此方法简单,但缺血的程度、部位、梗死范围很难作出定量和定性分析,导致造模的准确性无法判断。鉴于两种模型的优缺点,多数人一般选择造模准确度高、可控性好的直视下开胸手术冠脉结扎法。
3 大鼠冠脉的解剖特点及其结扎部位选择
大鼠心脏冠状动脉走行及分支与人有很大的区别,心脏的血液供应既来自冠状动脉,也来自起源于颈内动脉和锁骨下动脉的冠外动脉[1]。通过解剖大鼠可知心脏腹面冠状动脉走行不明显(图1),而在心脏背面的左心回旋支和右冠脉走行清晰(图2),左心回旋支主干支及其末梢分支支配左心室(图3)。据文献报道[6],冠脉结扎采取的部位多是左心耳下缘与肺动脉圆锥之间,进行直视下结扎或盲扎,但通过实验解剖多只大鼠观察得知,左心耳下缘与肺动脉圆锥之间腹面走行的左冠状动脉(图3),血管位置细而隐藏,走行不明显,而绕左心室侧面向腹面走行,支配左心室的左回旋支主干及其末梢分布比较清晰,可在其分支比较密集的末梢处结扎。相比之下,此处血管走行明显、密集,结扎时动脉容易发现,心肌较厚,不容易穿透心肌,是很好的结扎部位。结扎回旋支主干易导致心肌大面积坏死,死亡率较高,而结扎末梢处,梗死面积大小可依据结扎血管的数量来决定,有一定的可控性,死亡率较低。由于心脏供血丰富,血管密集,也可在左心室外壁按照上述方法采取盲扎法,同样可引起部分心肌坏死,达到同样的造模效果(图4)。
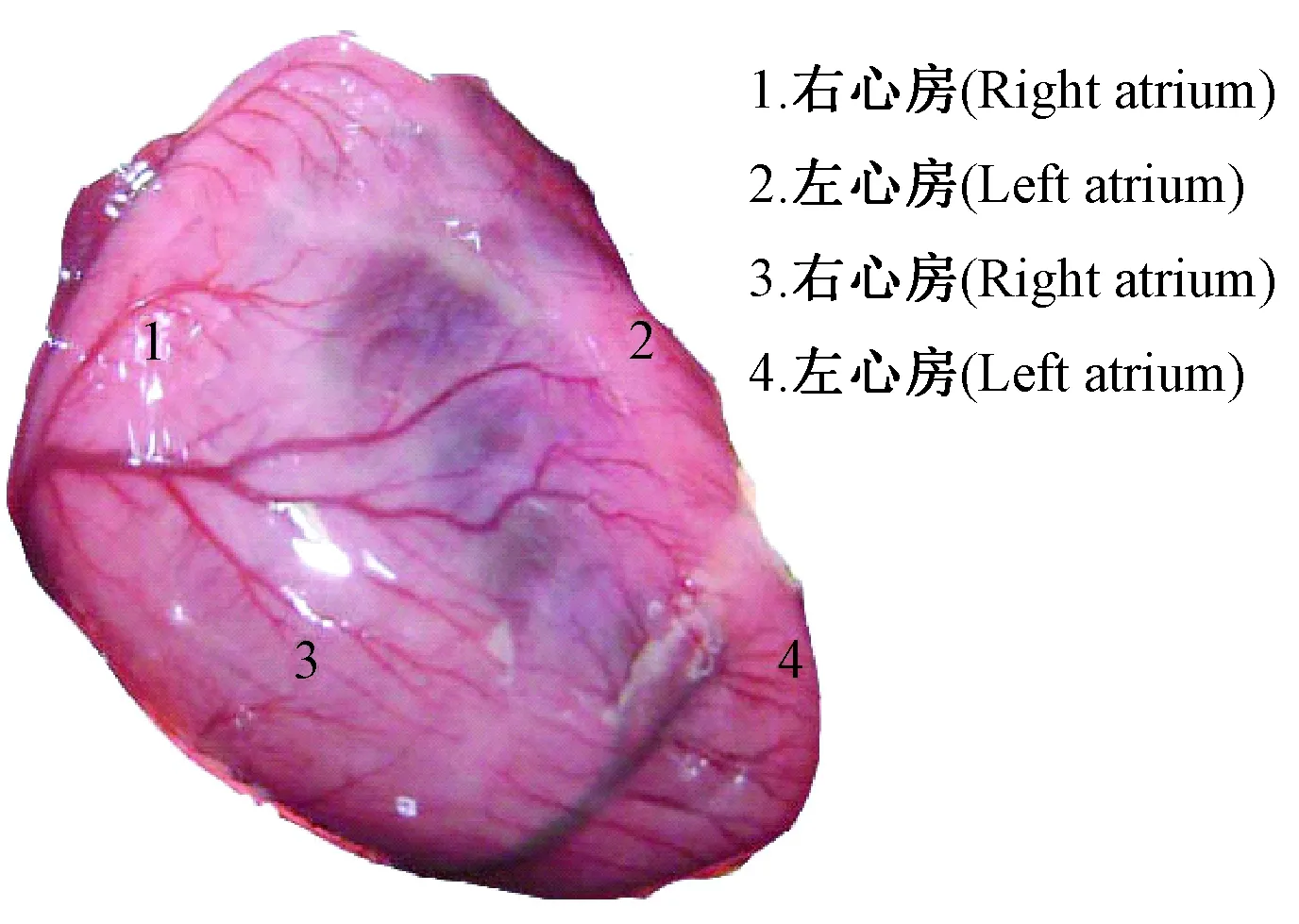
图1 大鼠心脏腹面图Fig.1 Ventral view of the rat heart
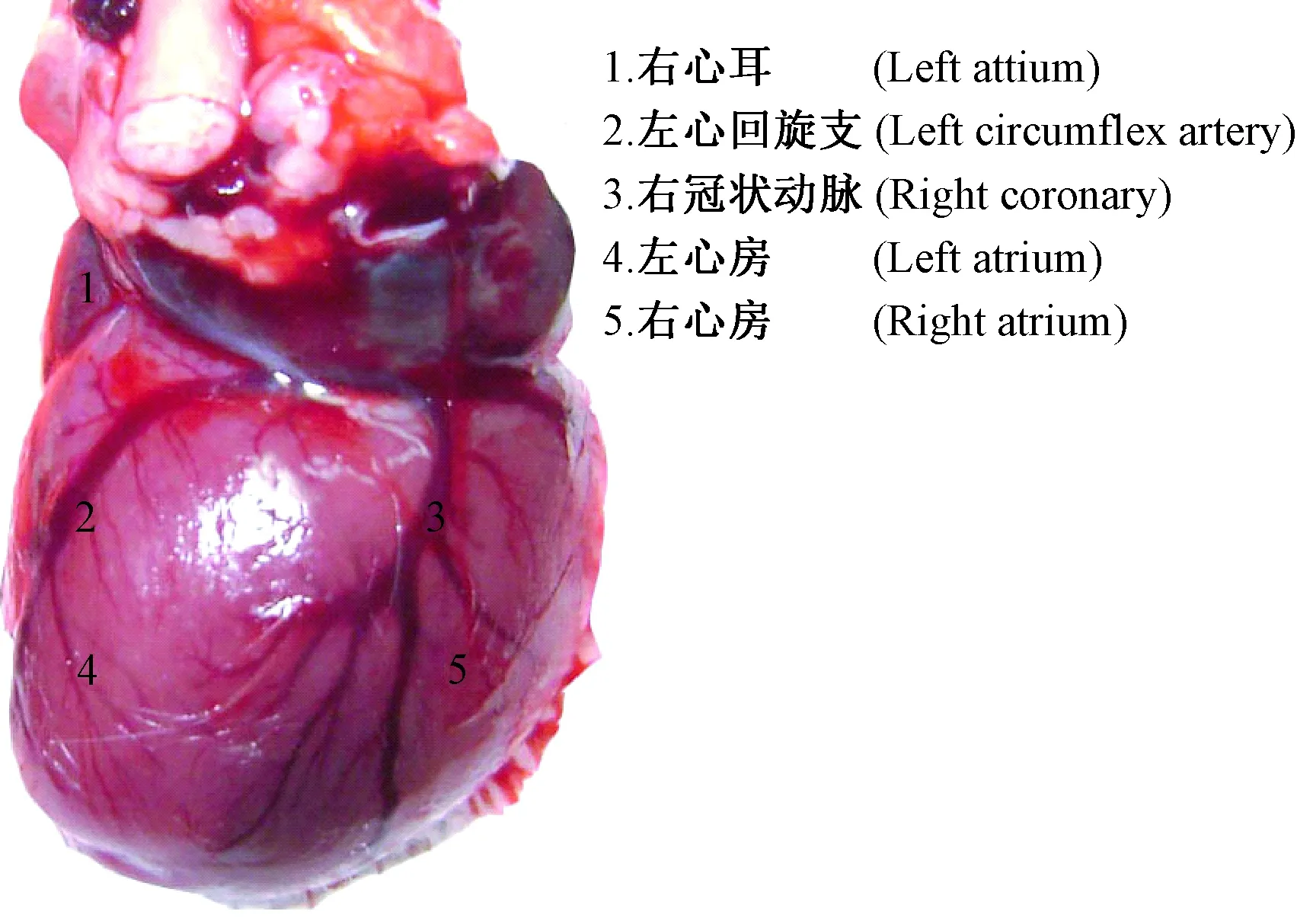
图2 大鼠心脏背面图Fig.2 Back view of the rat heart
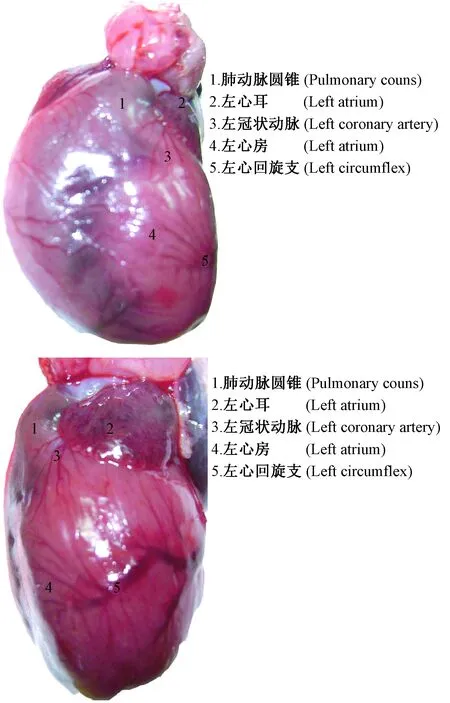
图3 大鼠心脏侧面图Fig.3 Lateral view of the rat heart
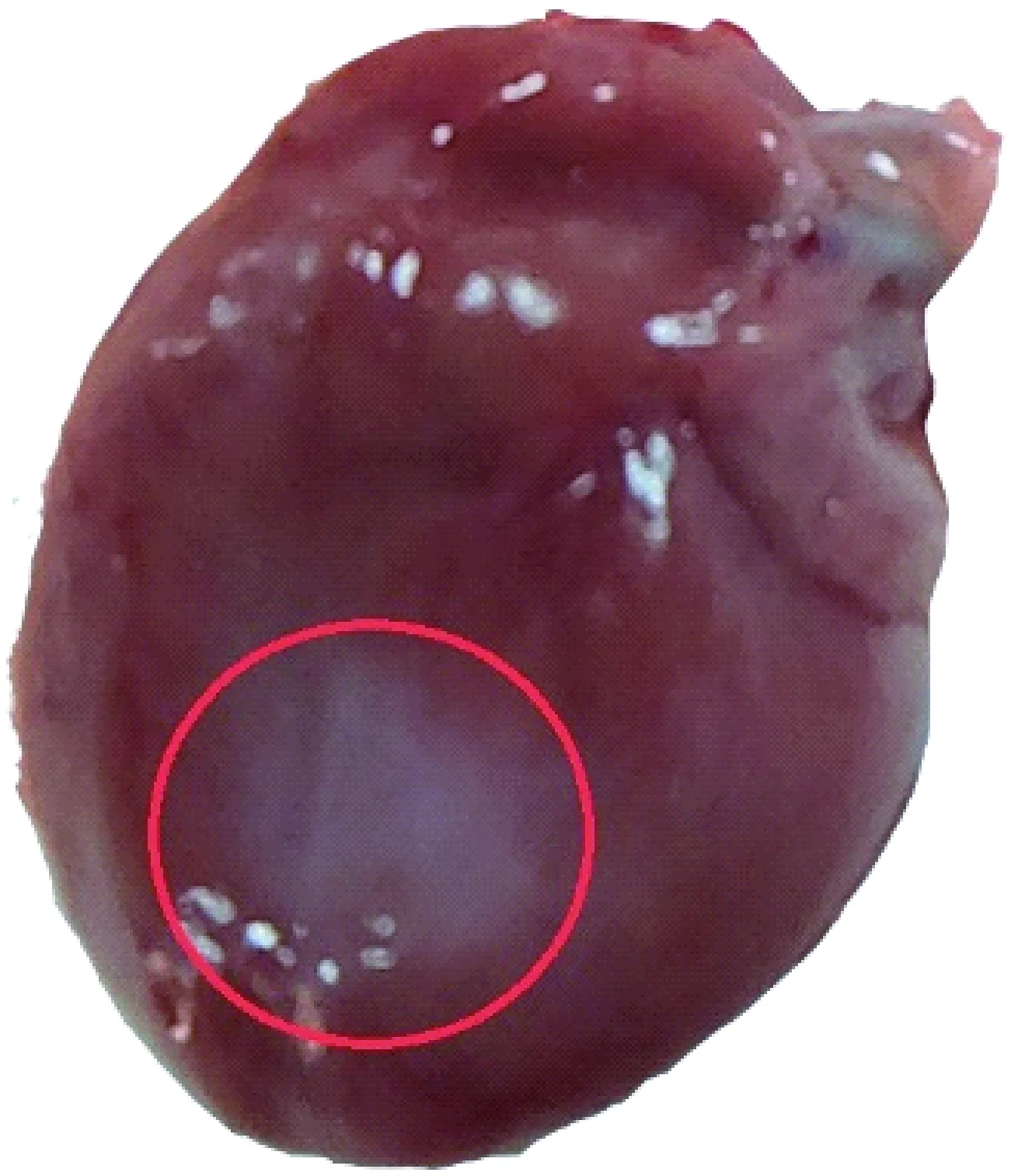
图4 心肌缺血模型(苍白处为坏死区)Fig.4 External appearances of a model rat of myocardial ischemia (The circle indicates a pale necrotic area)
4 心肌缺血模型的制作过程
(1)术前准备:手术器械酒精常规消毒,备好碘伏消毒液、生理盐水、无菌纱布、棉棒、备皮工具(手术剪或理发器)、大鼠解剖板,开口器(开睑器或回形针自制开口器)、小手术无影灯等。
(2)麻醉、备皮:术前称重,按照0.35 mL/100 g,10%水合氯醛腹腔注射麻醉,1 ~ 2 min之后,判断大鼠意识和麻醉程度,然后在解剖板上固定四肢,四肢连接心电图机,打印正常状态下的肢体Ⅱ导联心电图,用手术剪或理发器等备皮工具于气管切开部位和开胸部位备皮,手术区域用碘伏常规消毒。
(3)气管插管:用手术剪在颈部正中,做一纵行约1 cm切口(切口尽量要小),逐层分离皮肤浅筋膜,筋膜下组织(注意保护甲状腺)、颈前肌肉,暴露气管,用两把小的止血钳固定气管,用大号注射器针头开口或者眼科剪在第2、3软骨环处做一横向切口(切口尽量要小于气管插管,以防漏气),行气管插管,达到合适的深度,打开调整好的呼吸机(频率80次/min,吸呼比1∶1,潮气量3 ~ 4 mL/100 g),插管用胶布固定(不用手术线固定),切口敷以生理盐水纱布保护。
(4)开胸结扎:气管插管后,在心脏波动最明显、胸骨左缘1 cm处作纵行切口,逐层钝性分离胸大肌和前锯肌,暴露3、4肋间,顺肋间隙方向用止血钳钝性分离肋间肌至胸腔,用开口器撑开两肋骨,看到粉色海绵状的肺脏和跳动的心脏,如果切口不在结扎部位,可剪断附近肋骨,寻找结扎部位。用镊子剥离心包膜,用湿生理盐水棉签分离心脏附近心包及肺组织,寻找左心室回旋支及其末梢,用手指挤压胸廓固定心脏,用6-0的手术缝合线结扎包含末梢血管的心肌组织(宽度和深度约0.10 × 0.15 cm)或根据血管的走行盲扎含有血管的心肌组织,结扎心肌周围颜色变暗,留线在心脏,4-0手术缝合线迅速缝合肋骨,挤压两侧胸壁排除胸腔内空气,缝合肌肉和皮肤,消毒切口。拔出气管插管,对齐并缝合气管前肌和皮肤,消毒颈部切口(手术总过程约20 min左右)。
(5)术后处理:术后完成Ⅱ导联心电图记录,肌肉注射10万U(105U)青霉素,预防感染(也可不用),标号后将大鼠放回带有屏障系统笼内饲养,定期观察死亡及伤口愈合情况,作相应处理。
5 影响造模成功的关键因素
通过实验过程,总结以下6条作为造模成功的关键因素。
(1)术前准备:术前准备要充分,尽量无菌操作,手术切口尽量要小,以减少并发症的发生。
(2)气管插管[7]:大鼠呼吸道相对较长而窄,即使使用动物喉镜,直视下气管插管成功率仍然比较低,建议气管切开为主,气管插管深度要合理,根据气管长度确定插管的深度。
(3)麻醉[8]:争取一次麻醉成功,如麻醉失败,及时更换大鼠。避免反复加量麻醉,增加麻醉剂量容易引起大鼠耐受性低、麻醉过量致死。
(4)呼吸[9]:呼吸是影响造模成功的最关键因素,开胸后发生气胸,结扎冠状动脉及闭胸缝合短时间内不可能完成,为提高存活率,必须用动物专用呼吸机。根据大鼠的个体因素,调整呼吸机参数,呼吸以能够看到胸廓正常起伏为准,起伏幅度太低或开胸后看不到肺说明通气不足,正常情况下,能看到粉色肺覆盖在心脏周边,说明通气正常,如发现肺萎缩,心脏颜色紫黯、快速室颤,呼吸深快,即是缺氧表现,要及时查找原因,改善通气质量。
(5)手术过程:尽量短时间(20 min左右)熟练完成操作,减少术后并发症。切口要定位准确,避开胸骨左缘大血管,以免失血过多;尽量不剪断肋骨,减少损伤,保护组织完整性,预防感染,提高成活率。
(6)结扎部位选择:根据梗死面积的需要,结扎左心室回旋支末梢动脉和心肌组织,避免结扎其主干,以免梗死面积过大心肌不能代偿而死亡,导致造模失败。
6 小结
以上是冠心病心肌缺血模型制作过程中的一些比较、改进及分析,用改进后的方法结扎左心室回旋支末梢动脉多次造模,4周后大鼠的成活率均在82%以上,与结扎左冠状动脉前降支相比(存活率71.4%)[8],此方法显著提高了此动物疾病模型的成功率和存活率,且该方法可控性好,操作简便,符合临床冠心病心肌缺血梗死的疾病特征,既节约成本,又提高实验效率,值得推广和借鉴。
[1] 顾为望, 刘恩岐, 尹海林. 医学实验动物学 [M]. 北京: 科学出版社, 2015: 171.
[2] 李玉林. 病理学 [M]. 第7版. 北京: 人民卫生出版社, 2011: 119.
[3] 刘宇, 杨娟, 韦婷, 等. 改良冠脉结扎法大鼠心肌缺血模型的制备 [J]. 中药药理与临床, 2015, 31(6): 202-205.
[4] 周文武, 林玲, 陈军, 等. 冠脉结扎法制做大鼠心肌缺血模型 [J]. 中国实验动物学报, 2004, 12(4): 36-40.
[5] 卢志强, 张艳军, 崔广智, 等. 心肌缺血模型的制作方法研究进展 [J]. 中国药理学通报, 2012, 28(8): 1053-1057.
[6] 吕沛然, 庄艺, 周洁, 等. 一种大鼠心肌缺血模型的制作方法 [J]. 医学美学美容(中旬刊), 2015, (2): 693-694.
[7] 汪梦霞, 廖锦华, 马达, 等. 大鼠在体心肌缺血再灌注模型的建立 [J]. 临床医学工程, 2013, 20(5): 533-535.
[8] 滕小梅, 贺继刚, 沈振亚. 直视下冠状动脉结扎法制作大鼠心肌缺血模型初步探讨 [J]. 浙江临床医学, 2013, 15(2): 184-186.
[9] 张新宁, 吕琪, 张永亮, 等. 大鼠心肌缺血再灌注模型建立方法的改进 [J]. 武警医学院学报, 2008, 17(11): 941-943.
Comparison and improvement of the methods for establishment ofrat models of myocardial ischemia
ZHANG Shi-tian1, PANG Lu-lu2, TANG Han-qing1*, HUANG Cen-han1
(1.Youjiang Medical University for Nationalities, Baise Guangxi 533000, China; 2.Guangxi University of ChineseMedicine, Nanning 530000)
The method for preparation of models of myocardial ischemia in rats have been well described in the literature, are of practical value and have been chosen by many researchers for pharmacological studies of drugs for human diseases. However, there is still lack in some details of their operability and practicability. We re-selected the coronary artery ligation site, simplified the procedures and improved the experimental method for preparation of the models, and made satisfactory result. In this paper we will review the selection of method for preparing myocardial ischemia model in rats, describe some details of the surgical operation, explored the influencing factors and so on, and provide a reference for selecting most appropriate animal model in research.
Coronary heart disease; Myocardial ischemia; Animal model; Establishment methods; Heart; Surgery
国家自然科学基金项目(项目批准号81460658)。
张世田(1980-),男,硕士研究生在读,研究方向:冠心病中西医结合治疗的基础与临床研究。E-mail: 93625430@qq.com
唐汉庆(1976-),男,副教授,硕士研究生导师,研究方向:民族医药与中西医结合基础研究。E-mail: phdtanghanqing@163.com
研究进展
R-33
A
1671-7856(2017) 07-0098-04
10.3969.j.issn.1671-7856. 2017.07.018
2017-01-06

