真菌性鼻窦炎大鼠鼻窦黏膜组织Maspin、IKKα表达水平及意义
李 琴,谢 琼
(华中科技大学同济医学院附属荆州医院耳鼻喉科,湖北 荆州 434020)
真菌性鼻窦炎大鼠鼻窦黏膜组织Maspin、IKKα表达水平及意义
李 琴,谢 琼*
(华中科技大学同济医学院附属荆州医院耳鼻喉科,湖北 荆州 434020)
目的 探讨真菌性鼻窦炎(FRS)大鼠鼻窦黏膜组织Maspin、IKKα表达水平及意义。方法 40只SD级大鼠建立真菌性鼻窦炎模型,按照随机数字表法分为鼻塞组、FRS组、免疫抑制剂组、侵袭性FRS组,每组各10只,另选择10只健康大鼠作为空白对照组;对照组正常喂养;鼻塞组仅鼻腔塞入止血棉,腹腔与鼻腔内给予等体积0.9% NaCl注射液;FRS组腹腔注射等量0.9% NaCl注射液,鼻腔注射烟曲霉菌孢子悬液;免疫抑制剂组腹腔注射环磷酰胺,鼻腔内注射等量0.9% NaCl注射液;侵袭性FRS组腹腔注射环磷酰胺、鼻腔注射烟曲霉菌孢子悬液建立侵袭性FRS大鼠模型。采用酶联免疫吸附试验检测血清白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)表达水平;免疫组织化学染色法检测各组大鼠鼻腔组织Maspin、IKKα蛋白表达水平,荧光定量PCR法检测各组大鼠鼻腔组织Maspin mRNA、IKKα mRNA表达水平。结果 各组大鼠血清IL-6、TNF-α表达水平比较差异有显著性(P< 0.05),其中FRS组血清IL-6、TNF-α显著高于对照组、鼻塞组、免疫抑制剂组和侵袭性FRS组【(69.3±10.9)ng/L vs(45.2±7.1) ng/L,(46.4±6.7) ng/L,(21.3±4.5) ng/L,(20.9±4.3) ng/L;(30.4±4.8) ng/L vs(14.8±2.7) ng/L,(13.9±1.4) ng/L,(7.9±0.6) ng/L,(7.8±0.4) ng/L】(P< 0.05),对照组血清IL-6、TNF-α又显著高于免疫抑制剂组和侵袭性FRS组(P<0.05),免疫抑制剂组、侵袭性FRS组间血清IL-6、TNF-α表达水平比较差异无显著性(P> 0.05)。免疫组织化学染色结果显示FRS组、侵袭性FRS组Maspin蛋白表达水平显著低于对照组、鼻塞组、免疫抑制剂组,IKKα蛋白表达水平显著高于对照组、鼻塞组、免疫抑制剂组(P< 0.05);其中侵袭性FRS组Maspin蛋白表达显著低于FRS组,IKKα蛋白表达则显著高于FRS组(P< 0.05)。FRS组、侵袭性FRS组Maspin mRNA表达水平显著低于对照组、鼻塞组、免疫抑制剂组,IKKα mRNA表达水平显著高于对照组、鼻塞组、免疫抑制剂组(P< 0.05);其中侵袭性FRS组Maspin mRNA表达显著低于FRS组,IKKα mRNA表达显著高于FRS组(P< 0.05)。结论 IKKα活化后下调Maspin表达是导致FRS发病的主要原因,这一过程可能也是侵袭性FRS分子作用机制之一。
真菌性鼻窦炎;侵袭性真菌性鼻窦炎;乳腺丝氨酸蛋白酶抑制剂;IκB激酶α;侵袭;细胞因子
近年来随着广谱抗菌药物、免疫抑制剂、激素等广泛使用,导致真菌性感染疾病发生率呈上升趋势[1,2],其中真菌性鼻窦炎(fungal rhinosinusitis,FRS)是常见的真菌感染性疾病。按照组织侵犯程度不同,FRS分为侵袭性FRS和非侵袭性FRS两种类型[3],侵袭性FRS病情较重,一旦急性发病可以在短时间内向周围毗邻器官侵袭而导致患者死亡,因此掌握侵袭性FRS的发病机制,对制订预防措施、改善患者预后具有重要意义。导致FRS的诱因较多,其中免疫功能与FRS的发病、疾病分型密切相关。当患者免疫功能低下时,极易诱发FRS,因此器官移植、老年人群、长期使用糖皮质激素者均是FRS感染的高发人群[4]。国外研究[5]证实乳腺丝氨酸蛋白酶抑制剂(mammary serine proteinase inhibitor,Maspin)是导致真菌侵袭的主要病毒素;而最近研究发现IκB激酶α(IκB kinase α,IKKα)在晚期恶性肿瘤中能够被炎性因子激活[6],进而下调Maspin蛋白的表达,最终介导肿瘤的浸润转移。然而在FRS中是否存在炎性介质介导IKKα活化,并下调Maspin蛋白这一过程目前尚不得而知。鉴于此,本研究对FRS大鼠呼吸道上皮细胞炎性因子、IKKα、Maspin表达情况进行研究,旨在探讨侵袭性FRS的发病机制,现将研究成果总结如下。
1 材料和方法
1.1 材料
50只雄SD级性Wistar大鼠【SCXK(鄂)2015-009】均购自华中科技大学同济医学院动物实验中心【SYXK(鄂)2014-0049】,周龄10 ~ 14周,平均(12.5±3.1)周,体质量240 ~ 260 g,平均(252±5)g;于20 ~ 22℃、相对湿度55%的条件下笼中饲养,12 h昼夜交替,所有大鼠饮用水均经过高温灭菌处理,所有大鼠自由进食进水。本实验经医院动物伦理委员会批准。
1.2 试剂与仪器
烟曲霉菌AF293由本实验室按照美国临床实验室标准化研究所标准自制,培养基购自青岛科瑞培养基有限公司,IKKα、Maspin单克隆抗体购自圣克鲁斯生物技术公司(美国),RT逆转录试剂盒购自罗氏公司,羊抗兔IgG抗体购自武汉博士德生物工程有限公司, 白细胞介素6(interleukelin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)购自上海基免实业有限公司;荧光定量PCR仪购自美国ABI公司,倒置显微镜购自日本奥林巴斯公司。
1.3 方法
1.3.1 动物分组与模型建立
将50只大鼠按照随机数字表法分为5组:空白对照组、鼻塞组、FRS组、免疫抑制剂组、侵袭性FRS组,各10只。首先将烟曲霉菌AF293在培养基中以37℃条件下培养5 ~ 7 d,再将分生孢子收集后用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗,以离心力800 g离心10 min后再次用PBS洗涤,取得烟曲霉菌孢子悬液,调整细胞悬液浓度1×107个/mL。空白对照组:不做任何处理,正常喂养。侵袭性FRS组:大鼠腹腔注射水合氯醛(浓度10%)3 mL/kg,待大鼠完全麻醉,将面积约为2 mm × 2 mm × 10 mm 大小的Merocel 高分子止血棉(美国施美德公司)塞入大鼠左侧鼻腔,至第7日腹腔注射环磷酰胺100 mg/kg,每3日 1次,连续注射2次;至第11日大鼠吸入乙醚麻醉,将烟曲霉菌孢子悬液50 μL缓慢注射至左侧鼻腔。第13日局部检测鼻腔分泌物,以病原菌培养存在烟曲霉菌作为建模成功的标准。鼻塞组:仅在大鼠左侧鼻腔塞入Merocel 高分子止血棉,腹腔与鼻腔内给予等体积0.9% NaCl注射液代替环磷酰胺和烟曲霉菌孢子悬液,注射方法同侵袭性FRS组。FRS组:鼻腔塞入Merocel 高分子止血棉,腹腔注射等量0.9% NaCl注射液代替环磷酰胺,鼻腔注射烟曲霉菌孢子悬液,注射方法同侵袭性FRS组。免疫抑制剂组:腹腔注射环磷酰胺,鼻腔内注射等量0.9% NaCl注射液代替烟曲霉菌孢子悬液,注射方法同侵袭性FRS组。建模成功后继续饲养7 d,然后处死。本试验大鼠造模均获得成功。
1.3.2 血清细胞因子检测
于模型建立第7日采集各组大鼠尾部静脉血3 mL,离心5 min(离心半径8 cm)分离血清,采用酶联免疫吸附试验检测血清IL-6、TNF-α表达水平,检测操作参考试剂盒说明书。
1.3.3 鼻腔组织Maspin、IKKα蛋白检测
待尾静脉取血结束后,各组大鼠均腹腔注射100 mg/kg氯胺酮,大鼠麻醉后脱臼断头,将大鼠面部皮毛和软组织完全剔除,取鼻吻部至双眼前缘的平面组织,于4%甲醛中固定3 d,常规石蜡包埋制成鼻窦组织切片。从液氮中取出组织样本,手术剪将样本剪成小块,超声粉碎,打成匀浆,加入蛋白提取液4℃振荡过夜,15000 r/min离心50 min,提取上清液,Bradford法检测蛋白浓度。采用聚丙烯酰胺凝胶上样,每个泳道加入30 μg总蛋白,常规方法转移至PVDF膜,再加入5%脱脂牛奶封闭2 h。分别加入IKKα、Maspin单克隆抗体作为一抗,4℃封闭过夜。PBS洗涤3次,再加入1∶5000稀释的二抗37℃孵育2 h。PBS冲洗后加入按照ECL化学发光显影试剂盒显影并测量光密度值,以目的蛋白与β-actin蛋白光密度的比值作为目的蛋白相对表达量。
1.3.4 鼻腔组织Maspin、IKKα mRNA表达检测
取各组大鼠鼻黏膜组织30 ~ 50 mg,加入1 mL Trizol RNA总提取液,制成匀浆后再加入100 μL氯仿,振荡混匀后800 g离心10 min, 70%乙醇洗涤3次,提取总RNA。按照RT反转录试剂盒说明书,取1 μg总RNA逆转录得到互补DNA,以β-actin作为内参,采用实时荧光定量PCR分别扩增Maspin、IKKα基因,设置反应体系:模板7.5 μL,上游引物0.5 μL,下游引物0.5 μL,cDNA1.5 μL,双蒸水 8 μL,总反应体系18 μL。反应条件:95℃预变性5 min,92℃ 30 s,72℃延伸45 s,总计45个循环。Maspin mRNA引物序列:上游:5′-TCGCGAGCTT GCTTGGCGAC-3′,下游:5′-GCTGTCAGGCGCGC TGCGATA-3′,扩增片段长度201 bp;IKKα mRNA引物序列:上游:5′-GTGACATAAGTTCGGACTGCG-3′,下游:5′-TTTCGATTACATCGCGGAGCT-3′,扩增片段长度276 bp;β-actin引物序列:上游:5′-CAGAGC TAGAACACGGCAGCG-3′,下游:5′-TGCGGCGATGG CTAGGCGTGA-3′,扩增片段长度463 bp。按照下列公式计算目的基因相对表达量:基因相对表达量=2-△Ct,△Ct=Ct(目的基因)- Ct(β-actin)。
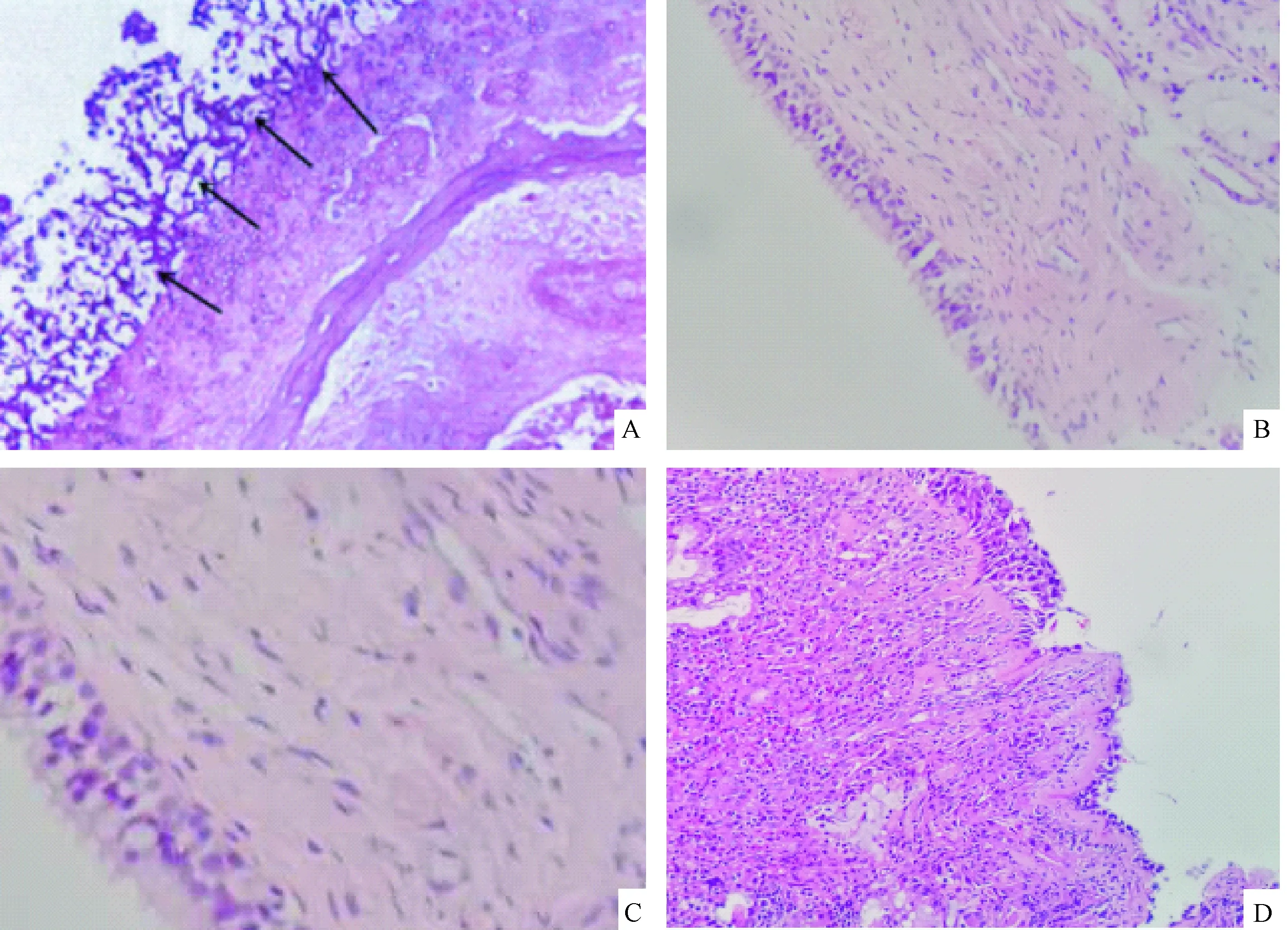
注:A:侵袭性FRS组 鼻窦黏膜组织内可见大量真菌(黑色箭头所指处);B:对照组 上皮完整;C:免疫 抑制剂组 上皮细胞连续完整,少量淋巴细胞浸润;D: FRS组 上皮不完整,伴有大量淋巴细胞浸润。(SP法,×200)图1 各组大鼠鼻窦黏膜组织的形态学改变Note. A. large number of fungi were found in the nasal mucosa of a rat from the invasive FRS group; B. Intact epithelium of a normal control rats; C. a rat from the Immunosuppressive group, showing intact epithelium with sparse lymphocyte infiltration; D. a rat from the FRS group, incomplete epithelium and extensive lymphocyte infiltration in the sinusoidal mucosa of a rat from the FRS group.Fig.1 Histological changes of sinusoidal mucosa in each group of rats
1.4 统计学方法
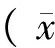
2 结果
2.1 病理检查结果
大体观察:对照组、鼻塞组、免疫抑制剂组大鼠鼻腔黏膜正常;FRS组可见鼻腔内黏膜水肿,鼻腔出现大量分泌物,但是鼻窦组织未见破坏;侵袭性FRS组鼻腔内可见大量血性分泌物,鼻窦结构发生破坏,并伴有干酪样坏死组织。PAS染色及显微镜观察:侵袭性FRS组鼻腔组织存在大量真菌,鼻窦处有真菌侵犯血管,并伴有组织坏死、组织破坏,在坏死组织周围能够发现有嗜酸性细胞、中性粒细胞和淋巴细胞散在分布;对照组鼻腔上皮完整,未见有炎性浸润;鼻塞组、鼻塞+免疫抑制剂鼻窦黏膜上皮连续完整,在上皮周围可见少量淋巴细胞浸润;FRS组上皮不完整,上皮周围存在大量淋巴细胞浸润,但鼻窦周围未见真菌感染,周围组织也未见侵入,见图1。
2.2 各组大鼠血清IL-6、TNF-α表达水平比较
各组大鼠血清IL-6、TNF-α表达水平比较差异有显著性(P< 0.05),FRS组血清IL-6、TNF-α显著高于对照组、鼻塞组、免疫抑制剂组和侵袭性FRS组(P< 0.05),对照组血清IL-6、TNF-α又显著高于免疫抑制剂组和侵袭性FRS组,免疫抑制剂组、侵袭性FRS组间血清IL-6、TNF-α表达水平比较差异无显著性(P> 0.05),见表1。
2.3 各组大鼠组织Maspin、IKKα蛋白表达水平比较
FRS组、侵袭性FRS组Maspin蛋白表达水平显著低于对照组、鼻塞组、免疫抑制剂组,FRS组、侵袭性FRS组IKKα蛋白表达水平显著高于对照组、鼻塞组、免疫抑制剂组(P< 0.05);其中侵袭性FRS组Maspin蛋白表达显著低于FRS组,IKKα蛋白表达显著高于FRS组,见表2。
2.4 各组大鼠组织Maspin、IKKα mRNA表达水平比较
实时荧光定量PCR分析显示FRS组、侵袭性FRS组Maspin mRNA表达水平显著低于对照组、鼻塞组、免疫抑制剂组,IKKα mRNA表达水平显著高于对照组、鼻塞组、免疫抑制剂组(P< 0.05);其中侵袭性FRS组Maspin mRNA表达显著低于FRS组,IKKα mRNA表达显著高于FRS组(P< 0.05),见表3。
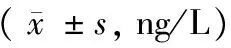
表1 各组大鼠血清IL-6、TNF-α表达水平比较Tab.1 Comparison of the serum expression of IL-6 and TNF-α in the groups of rats
注:与免疫抑制剂组比较,aP< 0.05;与FRS组比较,bP< 0.05;与侵袭性FRS组比较,cP< 0.05。
Note. Compared with the immunosuppressive group,aP< 0.05; Compared with the FRS group,bP< 0.05; Compared with the invasive FRS group,cP< 0.05.
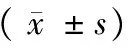
表2 各组大鼠组织Maspin、IKKα蛋白表达水平比较Tab.2 Comparison of the expression of Maspin and IKKα protein in each group
注:与FRS组比较,aP< 0.05;与侵袭性FRS组比较,bP< 0.05。
Note. Compared with the FRS group,aP< 0.05; Compared with the invasive FRS group,bP< 0.05.
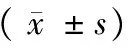
表3 各组大鼠组织Maspin、IKKα mRNA表达水平比较Tab.2 Comparison of the expression of Maspin and IKKα mRNA in each group
注:与FRS组比较,aP< 0.05;与侵袭性FRS组比较,bP< 0.05。
Note. Compared with the FRS group,aP< 0.05; Compared with the invasive FRS group,bP< 0.05.
3 讨论
真菌性鼻窦炎分为侵袭性和非侵袭性两种,其中侵袭性鼻窦炎患者预后较差,当侵犯至颅内时甚至导致患者死亡。关于FRS的发病机制目前仍不完全清楚,有研究显示免疫功能低下是导致FRS的主要诱因[7,8]。王立朋等[9]报道称免疫正常的宿主存在的上皮细胞层和吞噬细胞能够对真菌的侵袭起到良好的防御能力,吞噬细胞在杀灭真菌孢子时会产生大量细胞因子,而细胞因子又会进一步诱导和激活淋巴细胞、中性粒细胞等,从而增强宿主对真菌的抵抗能力。然而对于存在免疫缺陷的患者,吞噬细胞的活性及细胞因子产生能力均有所降低,导致宿主正常的防御屏障不足以抵抗真菌的感染,使得真菌孢子与呼吸道上皮细胞粘连,而这一过程常提示发展结局为侵袭性FRS[10]。本研究显示FRS组血清IL-6、TNF-α表达水平最高,FRS组血清IL-6、TNF-α表达水平最高,说明免疫抑制导致的炎性细胞和抗炎细胞失衡是侵袭性FRS发病的主要原因之一。
侵袭性FRS的免疫应答反应有赖于免疫细胞表面受体对真菌的识别,并通过释放细胞因子、趋化因子等杀灭真菌[11]。正常情况下宿主对真菌的免疫应答反应需要跨膜受体的级联反应,国外研究[12]证实Toll样受体(Toll-like receptor,TLR)介导的核因子κB(nuclear Factor κB,NF-κB)信号通路信号途径异常会导致抗炎和促炎因子表达失衡,从而诱导肿瘤细胞发生侵袭、转移。IKKα是调控NK-κB信号途径的关键蛋白,在另一项研究中发现,细胞因子能够诱导宿主内源性IKKα表达异常升高,从而结合并抑制Maspin启动子,导致Maspin表达下调[13]。Maspin能够促进细胞与细胞外基质发生黏附作用,进而抑制细胞发生迁移。张芳等[14]发现丝氨酸蛋白酶抑制剂能够与抗真菌药起到协同治疗作用,该研究进而发现丝氨酸蛋白酶是促进真菌发生侵袭的关键酶,因而作为乳腺丝氨酸蛋白酶的抑制剂:Maspin蛋白可能在真菌侵袭中发挥着类似的作用。
本研究显示FRS组、侵袭性FRS组Maspin mRNA和蛋白表达水平显著低于对照组、鼻塞组、免疫抑制剂组,IKKα mRNA和蛋白表达水平显著高于对照组、鼻塞组、免疫抑制剂组,提示Maspin在FRS的发病中起到重要作用,这一过程可能与肿瘤细胞的侵袭、转移过程类似。进一步研究发现侵袭性FRS组Maspin mRNA和蛋白表达显著低于FRS组,IKKα mRNA和蛋白表达显著高于FRS组,说明IKKα、Maspin共同参与了真菌的侵袭。两者的参与过程可能是炎性因子激活IKKα表达,从而下调Maspin表达水平,导致真菌从呼吸道上皮细胞中发生脱落,进而向周围组织侵袭[15-17]。Luo等[18]报道称在免疫功能正常的宿主中IKKα活化未下调Maspin表达,推测IKKα虽然能够下调Maspin表达,但是这种调节水平可能并不存在直接线性关系,在接下来的研究中也将就此进行深入研究。
综上所述,IKKα活化后下调Maspin表达是导致FRS发病的主要原因,这一过程可能也是侵袭性FRS分子作用机制之一。
[1] Ragab A, Samaka RM, Salem M. Impact of fungal load on diagnosis and outcome of allergic fungal rhinosinusitis [J]. Eur Arch Otorhinolaryngol, 2014, 271(1): 93-101.
[2] Thurtell MJ, Chiu AL, Goold LA, et al. Neuro-ophthalmology of invasive fungal sinusitis: 14 Consecutive patients and a review of the literature [J].Clin Experiment Ophthalmol, 2013, 41(6): 567-576.
[3] Hatten KM, Loevner LA, Palmer JN, et al. Isolated sinonasal posttransplantation lymphoproliferative disorder: A clinical and radiographic invasive fungal sinusitis look-a-like [J]. ORL J Otorhinolaryngol Relat Spec, 2012, 74(6): 339-342.
[4] 吴峰, 吴立连, 朱立新, 等. 真菌性鼻-鼻窦炎发病相关的危险因子和临床表现探讨 [J].临床与病理杂志, 2015, 35(10): 1794-1798.
[5] Sharma G, Mirza S, Parshad R, et al. Clinical significance of Maspin promoter methylation and loss of its protein expression in invasive ductal breast carcinoma: correlation with VEGF-A and MTA1 expression [J]. Tumour Biol, 2011, 32(1): 23-32.
[6] Maier HJ, Schips TG, Wietelmann A, et al. Cardiomyocyte-specific IκB kinase (IKK)/NF-κB activation induces reversible inflammatory cardiomyopathy and heart Failure [J]. Proc Natl Acad Sci U S A, 2012, 109(29): 11794-11799.
[7] 梁晓, 张允岭, 王新祥, 等. 清热活血组分对急性脑梗死火毒证大鼠NF-κB炎症信号通路调控作用研究?[ J].北京中医药大学学报, 2015, 38(6): 377-382.
[8] Petrova RD, Mahajna J, Wasser SP, et al. Marasmius oreades substances block NF-κB activity through interference with IKK activation pathway [J]. Mol Biol Rep, 2009, 36(4): 737-744.
[9] 王立朋, 秦榛, 夏云, 等. 侵袭性曲霉菌感染的诊断方法及临床应用 [J]. 中国老年学杂志, 2015, 35(2): 523-525.
[10] LeBlanc RE, Meriden Z, Sutton DA, et al. Cunninghamella echinulata causing fatally invasive fungal sinusitis [J]. Diagn Microbiol Infect Dis, 2013, 76(4): 506-509.
[11] Maschio M, Mengarelli A, Girmenia C, et al. Trigeminal neuralgia as unusual isolated symptom of fungal paranasal sinusitis in patients with haematological malignancies [J]. Neurol Sci, 2012, 33(3): 647-652.
[12] Kerekes J, Kaspari M, Stevenson B, et al. Nutrient enrichment increased species richness of leaf litter fungal assemblages in a tropical forest [J]. Mol Ecol, 2013, 22(10): 2827-2838.
[13] 庞俊, 湛海伦, 刘伟鹏, 等. 肿瘤RNA转染DCs与同源CIKs共培养调控Akt/NF-κB细胞生存信号通道的实验研究 [J]. 中国现代医学杂志, 2010, 20(18): 2729-2732.
[14] 张芳, 安云芳, 赵长青, 等. 烟曲霉菌诱导大鼠呼吸道上皮细胞IKKα调控maspin蛋白表达的初步研究 [J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(1): 48-53.
[15] Ordonez ME, Farraye FA, Di Palma JA. Endemic fungal infections in inflammatory bowel disease associated with anti-TNF antibody therapy [J]. Inflamm Bowel Dis, 2013, 19(11): 2490-2500.
[16] Fei M, Bhatia S, Oriss TB, et al. TNF-α from inflammatory dendritic cells (DCs) regulates lung IL-17A/IL-5 levels and neutrophilia versus eosinophilia during persistent fungal infection [J]. Proc Natl Acad Sci U S A, 2011, 108(13): 5360-5355.
[17] Boveland SD, Moore PA, Mysore J, et al. Immunohistochemical study of matrix metalloproteinases-2 and -9,macrophage inflammatory protein-2 and tissue inhibitors of matrix metalloproteinases-1 and -2 in normal, purulonecrotic and fungal infected equine corneas [J].Vet Ophthalmol, 2010, 13(2): 81-90.
[18] Luo JL, Tan W, Ricono JM, et al. Nuclear cytokine-activated IKKα controls prostate cancer metastasis by repressing Maspin [J]. Nature, 2007, 446(7136): 690-694.
Expression and significance of Maspin and IKKα in sinusoidal mucosa ofrats with fungal rhinosinusitis
LI Qin, XIE Qiong*
(Department of Otorhinolaryngology, Jingzhou Central Hospital, Tongji Medical College, Huazhong University ofScience & Technology, Hubei Jingzhou 434020, China)
Objective To investigate the expression and significance of Maspin and IKKα in nasosinusoidal mucosa of rats with fungal rhinosinusitis (FRS). Methods A total of 40 SD rats were used to establish the FRS model, and randomly divided into nasal obstruction group, FRS group, immunosuppressive group and invasive FRS group, 10 rats in each group. Another 10 normal rats were used as control group. Mice in the control group were fed with normal diet. In the nasal obstruction group, the mice had only hemostatic cotton stuffed in the nasal cavity and injection of 0.9% NaCl in the abdominal and nasal cavities. In the FRS group, the mice were injectedAspergillusfumigatusspore suspension into the nasal cavity and 0.9% NaCl i.p. The mice of the immunosuppressive group were given cyclophosphamide i.p. and 0.9% NaCl injection into the nasal cavity. The invasive FRS group was injected with cyclophosphamide i.p. andAspergillusfumigatusspore suspension into the nasal cavity. The serum levels of interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) were measured by enzyme-linked immunosorbent assay (ELISA). The expression of Maspin and IKKα in nasosinusoidal mucosa was detected by immunohistochemical staining. The expression of Maspin mRNA and IKKα mRNA in the nasosinusoidal mucosa was detected by fluorescence quantitative PCR. Results The serum levels of IL-6 and TNF-α in different groups were significantly different (P< 0.05). The level of IL-6 in the FRS group was (69.3 ± 10.9) ng/L, significantly higher than those in the control group, nasal obstruction group, immunosuppressive group and invasive FRS group [ (45.2 ± 7.1)ng/L, (46.4 ± 6.7) ng/L, (21.3 ± 4.5) ng/L, and (20.9 ± 4.3 ng/L)] (P< 0.05). The level of TNF-α in the FRS group was (30.4 ± 4.8) ng/L, significantly higher than those in the control group, nasal obstruction group, immunosuppressive group and invasive FRS group [(14.8 ± 2.7) ng/L, (13.9 ± 1.4) ng/L, (7.9 ± 0.6) ng/L, and (7.8 ± 0.4 ng/L)] (P< 0.05). The levels of IL-6 and TNF-α in the control group were significantly higher than those in the immunosuppressive group and invasive FRS group (P< 0.05). There was no significant difference between the immunosuppressive group and the invasive group (P> 0.05). Theresult of immunohistochemical staining showed that the protein expression of Maspin in the FRS group and invasive FRS group was significantly lower than that in the control group, nasal obstruction group and immunosuppressive group, while the expression of IKKα protein was significantly higher than that of control group, nasal obstruction group and immunosuppressive group (P< 0.05). The protein expression of Maspin in the invasive FRS group was significantly lower than that in the FRS group, by contrast, the expression of IKKα protein was significantly higher (P< 0.05). The PCRresult revealed that the expression levels of Maspin and IKKα mRNA were (0.217 ± 0.013) and (0.193 ± 0.012), significantly lower than that in the control, obstruction and immunosuppressive groups [(0.309 ± 0.021), (0.302 ± 0.017), and (0.293 ± 0.02)] (P< 0.05), while the expressions level of IKKα mRNA were significantly higher [(0.319 ± 0.043), (0.384 ± 0.048) vs (0.169 ± 0.015), (0.171 ± 0.018), and (0.175 ± 0.019)] (P< 0.05). Conclusions Down-regulation of Maspin expression after IKKα activation is the main cause of the onset of FRS, which may also be one of the mechanisms of invasive FRS.
Fungal rhinosinusitis, FRS; Invasive fungal rhinosinusitis; Mammary serine proteinase inhibitor, Maspin; IκB kinase α, IKKα; Invasion; Cytokines
李琴(1982-),女,主治医师。Email: liqinyixue@163.com
谢琼(1969-),女,主任医师。Email: 1279566754@qq.com
研究报告
R-33
A
1671-7856(2017) 07-0075-06
10.3969.j.issn.1671-7856. 2017.07.014
2016-11-21
——曲霉菌

