富氢液通过PI3K通路减轻大鼠脑缺血再灌注损伤
陈克研,董婉维
(中国医科大学实验动物部,沈阳 110001)
富氢液通过PI3K通路减轻大鼠脑缺血再灌注损伤
陈克研,董婉维
(中国医科大学实验动物部,沈阳 110001)
目的 探讨富氢液对大鼠脑缺血再灌注致海马神经元凋亡及PI3K/Akt/FoxO1信号通路表达的影响。方法 采用线栓法阻塞大鼠大脑中动脉,建立大鼠局灶性脑缺血/再灌注(I/R)模型,SD 大鼠随机分为假手术组(Sham 组)、缺血/再灌注组(I/R组)和富氢液处理组(HRS组),每组 10只;各组于再灌注后24 h,ELISA检测血清中炎症因子IL-6、TNF-α及IL-1β的变化;HE染色观察海马变化,TUNEL 法观察脑组织细胞凋亡情况;Western blot法检测海马p-PI3K、Akt、caspase-3和FoxO1蛋白表达变化。结果 与Sham组相比,I/R组锥体细胞排列疏松,大量锥体细胞死亡,海马凋亡细胞增多,血清炎症因子IL-1β、IL-6、TNF-α、表达显著增加(P< 0.05),脑组织中p-PI3K、Akt、caspase-3表达显著升高,FoxO1蛋白降低,两组间比较均具有统计学差异(P< 0.05);与I/R组相比,HRS组炎症因子显著降低;p-PI3K、Akt、caspase-3表达水平均显著降低,,FoxO1蛋白升高(P< 0.05)。结论 富氢液可以减轻缺血再灌注导致的脑损伤,其机制可能与PI3K/Akt/FoxO1信号通路相关。
富氢液;缺血再灌注;PI3K;FoxO1;细胞凋亡
对缺血脑组织进行及时再灌注是治疗脑卒中的有效措施之一,在脑缺血再灌注时,缺血局部组织会释放大量炎症因子,这些激活的炎症细胞会浸润到局部组织,并激活相关的炎症信号通路,进而导致脑组织发生更严重的炎症性损伤[1-3]。此外,有研究发现,缺血再灌注损伤会伴随着细胞凋亡的发生,且细胞凋亡会随着缺血时间的延长而加重,凋亡在缺血/再灌注损伤的病理过程中的作用不容忽视[4]。目前认为,缺血再灌注损伤导致的炎症反应和凋亡与磷酸肌醇3-激酶(phosphatidylinositide 3-kinase,PI3K)及其下游蛋白AKT信号通路的激活息息相关[5]。氢气通过特殊加压方式溶到生理盐水而获得的富氢液(hydrogen rich saline,HRS)是很好的抗氧化物,集高氢量、弱碱性、负电位、小分子水为一体,平衡身体酸碱度,可有效防止多种疾病[6,7]。已有报道显示HRS在肝脏、肠缺血再灌注中对相应脏器有保护作用,而有关HRS在脑缺血再灌注损伤(ischemia reperfusion injury,IRI)中是否具有器官保护作用、其机制是否与抗炎性反应有关尚缺少相关研究。本研究通过建立大鼠缺血再灌注损伤模型,采用富氢液进行预处理,探讨富氢液对缺血再灌注大鼠脑损伤和PI3K通路蛋白表达的影响,阐明富氢液对脑组织损伤的保护作用及分子机制,旨在为富氢液治疗大脑缺血/再灌注损伤提供依据。
1 材料和方法
1.1 实验动物及分组
清洁级SD大鼠40只,250 ~ 300 g,源于中国医科大学实验动物部【SCXK(辽)2013-0001,SYXK(辽)2013-0007)】。实验随机分为假手术组(sham组),缺血/再灌注组(I/R组),富氢液处理组(HRS组)。H组大鼠于再灌注开始静脉泵注富氢水5 mL/(kg·h)至灌注结束;模型组动物注射等量的生理盐水;假手术组组动物在麻醉后仅动脉分离手术。
1.2 富氢水的制备
参照文献[8]制备富氢水溶液,将医用注射液软包装袋,用低压舱0.8个大气压减压处理24 h,常压下置12 h,将饱和部分的气体析出;将包装袋置于4℃冰箱冷却;取预冷的生理盐水,取总体积的15%,注入同体积的纯氢气;将注入氢气后的盐水放入加压舱,4℃下持续加压24 h,使氢气充分溶入注射液,取出后置4℃保存。
1.3 脑缺血/再灌注动物模型的制备
脑缺血/再灌注动物模型的制备参照文献进行[9]。大鼠经腹腔注射 2% 戊巴比妥钠进行麻醉,结扎右侧翼腭动脉和颈外动脉。在大鼠颈外动脉距结扎处约0.5 cm处用注射器针头刺一小口,将尼龙线栓经右侧颈外动脉主干切口缓慢向颈内动脉入颅方向推进,以颈总动脉分叉处为标记,推进 18 ~ 20 mm 感到轻微阻力时,即已阻断大脑中动脉。阻断 2 h 后,拔出尼龙线并扎紧动脉残端,缝合皮下组织和皮肤,完成脑缺血/再灌注损伤模型。
1.4 标本采集
各组于缺血再灌注术后24 h处死实验动物,经颈内静脉采血3 mL离心法分离血浆,采用ELISA试剂盒(美国 USCN)检测血浆中炎症因子IL-6、TNF-α、IL-1β;另取右侧海马组织,置于福尔马林液中,常规石蜡包埋,HE染色观察组织学变化,TUNEL染色观察神经细胞凋亡情况;另一部分置液氮中,Western blot技术检测p-PI3K、Akt、caspase-3和FoxO1蛋白表达变化。
1.5 统计学分析
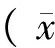
2 结果
2.1 富氢液对缺血再灌注大鼠海马形态学改变的影响
Sham组大鼠海马区域神经细胞形态正常,排列规则、胞质均染,细胞核呈圆形或卵圆形,未见明显病变;I/R组大鼠海马区域细胞排列紊乱,核固缩、溶解,神经元细胞及锥体细胞死亡,细胞数量明显减少;HRS组大鼠可见海马区域细胞紊乱程度减轻,变性/坏死的神经细胞明显减少(图1)。
2.2 富氢液对血浆中炎症因子表达的影响
与sham组相比,I/R组大鼠脑组织IL-1β、IL-6、和TNF-α的表达显著升高,差异有显著性(P< 0.05);与I/R组相比,HRS组大鼠IL-1β、IL-6和TNF-α的表达显著降低,差异有显著性(P< 0.05)(表1)。
2.3 富氢液对大鼠海马神经元凋亡的影响
TUNEL阳性细胞呈棕黄色,细胞核着色。与sham组比较,I/R组TUNEL阳性细胞数量显著增加,差异有显著性(P< 0.05);与I/R组相比,HRS组脑组织海马区域TUNEL阳性细胞数量显著降低(P< 0.05)(图2)。
2.4 富氢液对大鼠凋亡蛋白p-PI3K、Akt、caspase-3和FoxO1蛋白表达的影响
与Sham组相比,I/R组大鼠脑组织中p-PI3K、Akt、caspase-3表达显著升高,FoxO1蛋白降低,两组间比较均具有统计学差异(P< 0.05);与I/R组相比,HRS组大鼠脑组织p-PI3K、Akt、caspase-3表达显著降低,FoxO1蛋白升高,差异有显著性(P< 0.05)(图3)。
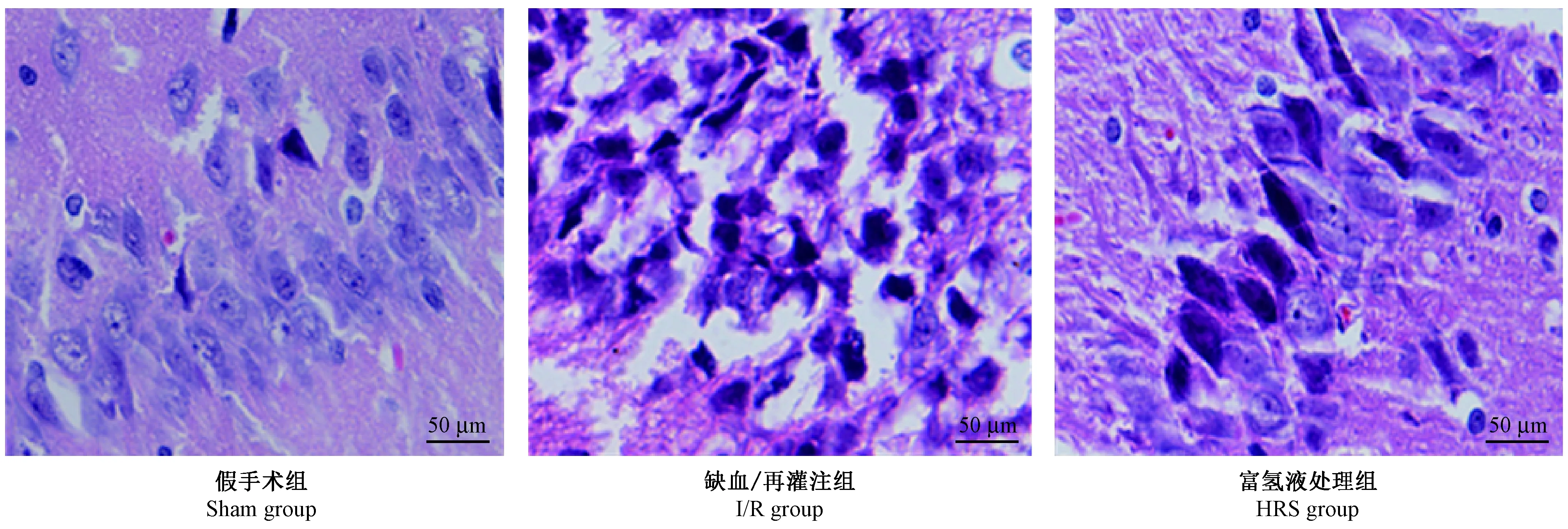
图1 大鼠海马的组织学改变(HE染色)Fig.1 Histological changes of hypocampal neurons in the rats (HE staining)
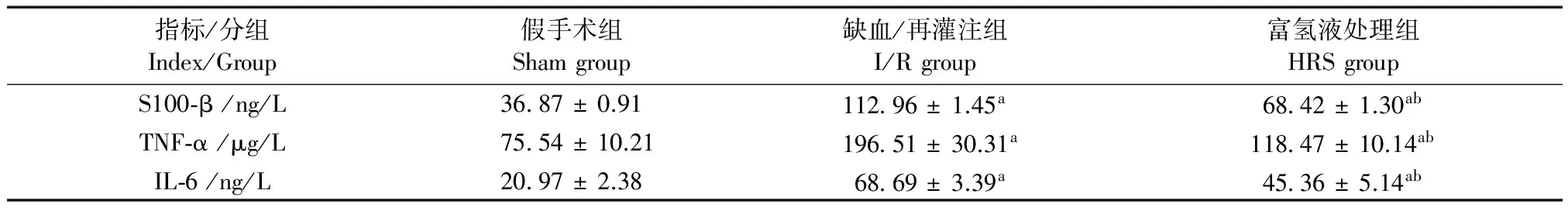
指标/分组Index/Group假手术组Shamgroup缺血/再灌注组I/Rgroup富氢液处理组HRSgroupS100⁃β/ng/L3687±0.9111296±1.45a6842±1.30abTNF⁃α/μg/L7554±10.2119651±30.31a11847±10.14abIL⁃6/ng/L2097±2.386869±3.39a4536±5.14ab
注:与Sham组相比,aP< 0.05;与HRS组相比,bP< 0.05。
Note. Compared with the sham group,aP<0.05; Compared with the HRS group,bP<0.05.
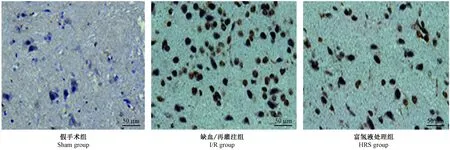
图2 海马神经元的凋亡状况(TUNEL染色)Fig.2 Apoptosis in the hypocampal neurons in the rats (TUNEL staining)

图3 Western blot检测大鼠海马组织中 多种基因蛋白表达的比较Fig.3 Changes of expressions of p-PI3K, Akt, caspase-3, FoxO1, and GAPDH in the rats detected by Western blot assay
3 讨论
本研究通过建立大鼠局灶性缺血再灌注脑损伤模型,采用HE染色、TUNEL、ELISA和Western blot等技术,观察富氢液对大鼠海马区神经元形态学改变、细胞凋亡及相关蛋白Bcl-2、Bax和caspase-3、炎症因子和PI3K/Akt/FoxO1通路蛋白表达的影响。结果发现,富氢液可以减少缺血再灌注导致的大脑海马区形态学改变,降低炎症因子表达、减少细胞凋亡产生。此外,研究发现,富氢液可以降低缺血再灌注导致的PI3K、Akt和FoxO1通路蛋白表达,结果提示富氢液可以减轻缺血再灌注导致的大鼠脑损伤,其机制可能是通过调控PI3K/Akt/FoxO1通路来实现。
氢气本身就是一种最佳天然抗氧化剂,所以加入氢气的水具有很强的还原功能,可以中和身体血液和细胞里的自由基。将氢气溶于生理盐水制备富氢液很容易进入细胞通道,参与新陈代谢,从而促进细胞排毒,增加了细胞的水合作用,提升人体的免疫力[10,11]。通过动物实验或临床实验均证实,人或动物引用HRS后,对心、肝脏、肺脏和肠等缺血再灌注引发的相应器官损伤有明显的抑制作用,可以减轻机体炎症反应和过度氧化,对脏器有保护作用[12,13]。研究发现,富氢液对脂多糖(LPS)诱导的大鼠急性肺损伤进行干预,它可以有效减少肺和支气管肺泡灌洗液的蛋白浓度、降低肺湿/干重比,显著抑制炎性细胞因子TNF-α、IL-6、IL-1α、VCAM-1 mRNA表达,结果表明,富氢液在临床上可用于有效治疗急性肺损伤的抗炎剂[14]。Huang等[15]研究发现富氢液可以降低溃疡性结肠炎大鼠血清LDH、ALP、IL-1β、TNF-α和MPO 水平,而增加前列腺素E2和IL-10水平,结果提示富氢液可用于治疗溃疡性结肠炎,为富氢液的临床抗炎应用提供了直接证据。本研究发现,富氢液显著降低缺血再灌注大鼠脑组织促炎因子IL-1β、IL-6、和TNF-α的表达。此外,富氢液还可以显著降低缺血再灌注导致促凋亡蛋白caspase-3表达,提示富氢液对缺血再灌注大鼠脑损伤有保护作用,这种作用是通过抗炎和抗凋亡实现的。
既往的研究证实PI3K/AKT信号通路参与了脑缺血神经细胞凋亡,内在通路和外部的炎症激活时均可驱动AKT介导的细胞存活通路,激活磷脂酰肌醇3激酶连接AMPA受体的胞内C末端,可激活其下游激酶Akt ser473残基磷酸化,诱导下游蛋白FoxO1向细胞膜转位,磷酸化Ser9导致FoxO1失活,磷酸化β连环蛋白促进细胞生存。同时抑制下游蛋白caspase-3激活,从而抑制促炎因子释放,发挥抗炎、抗凋亡、减少脑损伤作用[16-18]。本研究发现,与对照组相比,缺血再灌注大鼠海马组织p-PI3K、p-Akt 和p-FoxO1蛋白表达均显著增加,而经过富氢液预处理后大鼠脑组织p-PI3K、p-Akt 和p-FoxO1表达显著降低,结果提示,富氢液可能通过激活PI3K/Akt/FoxO1通路,对缺血再灌注大鼠脑损伤发挥保护作用。
综上,富氢液可以减少缺血再灌注导致的大脑海马区形态学改变,降低炎症因子表达、减少细胞凋亡产生,其机制可能是通过调控PI3K/Akt/FoxO1通路来实现。
[1] 王斌, 曹慧, 沈甜, 等. 麝香、冰片对大鼠脑缺血-再灌注急性期和恢复早期炎性损伤的保护作用及机制研究[J]. 中药材, 2015, 38(10): 2139-2143.
[2] Yang SI, Yuan Y, Jiao S, et al. Calcitonin gene-related peptide protects rats from cerebral ischemia/reperfusion injury via a mechanism of action in the MAPK pathway[J]. Biomed Rep, 2016, 4(6): 699-703.
[3] 曾兆禄, 韩继超, 薛云, 等. 针刺结合丹红注射液对大鼠脑缺血再灌注损伤的保护作用[J]. 中国比较医学杂志, 2016, 26(2): 62-66.
[4] Diaz-Ruiz A, Roldan-Valadez E, Ortiz-Plata A, et al. Dapsone improves functional deficit and diminishes brain damage evaluated by 3-Tesla magnetic resonance image after transient cerebral ischemia and reperfusion in rats[J]. Brain Res, 2016,1646: 384-392.
[5] Tang Y, Liu X, Zhao J, et al. Hypothermia-induced ischemic tolerance is associated with Drp1 inhibition in cerebral ischemia-reperfusion injury of mice[J]. Brain Res, 2016,1646: 73-83.
[6] 潘震华 赵悦 于宏颖,等. 饱和氢盐水对心肌缺血再灌注老年大鼠心肌细胞自噬的影响 [J]. 中华医学杂志, 2015, 95(25): 2022-2026.
[7] Tao B, Liu L, Wang N, et al. Effects of hydrogen-rich saline on aquaporin 1, 5 in septic rat lungs [J]. J Surg Res, 2016, 202(2): 291-298.
[8] Sun Q, Cai J, Zhou J, et al. Hydrogen-rich saline reduces delayed neurologic sequelae in experimental carbon monoxide toxicity [J]. Crit Care Med, 2011,39(4): 765-769.
[9] Li YH, Qiao LJ, Lin XY. Mechanism of low molecular weight GTP binding protein RAC1 in injury of neural function of rats with cerebral ischemia reperfusion [J]. Asian Pac J Trop Med, 2016, 9(5): 474-477.
[10] Tian Y, Guo S, Zhang Y, et al. Effects of hydrogen-rich saline on hepatectomy-induced postoperative cognitive dysfunction in old mice [J]. Mol Neurobiol, 2017, 54(4): 2579-2584.
[11] Qin L, Tao Y, Wang L, et al. Hydrogen-rich saline as an innovative therapy for cataract: a hypothesis [J]. Med Sci Monit, 2016, 22: 3191-3195.
[12] Shi Q, Chen C, Deng WH, et al. Hydrogen-rich saline attenuates acute hepatic injury in acute necrotizing pancreatitis by inhibiting inflammation and apoptosis, involving jnk and p38 mitogen-activated protein kinase-dependent reactive oxygen species[J]. Pancreas, 2016, 45(10): 1424-1431.
[13] Du H, Sheng M, Wu L, et al. Hydrogen-rich saline attenuates acute kidney injury after liver transplantation via activating p53-mediated autophagy[J]. Transplantation, 2016, 100(3): 563-570.
[14] Meng X, Chen H, Wang G, et al. Hydrogen-rich saline attenuates chemotherapy-induced ovarian injury via regulation of oxidative stress[J]. Exp Ther Med, 2015,10(6): 2277-2282.
[15] Huang SL, Jiao J, Yan HW. Hydrogen-rich saline attenuates steroid-associated femoral head necrosis through inhibition of oxidative stress in a rabbit model[J]. Exp Ther Med, 2016, 11(1): 177-182.
[16] 薛金龙, 孙芳玲, 刘婷婷, 等. 莫诺苷对局灶性脑缺血再灌注大鼠Wnt7a和APC表达的影响[J]. 中国比较医学杂志, 2014, 24(9): 9-13.
[17] 刘志辉. 立普妥对高糖诱导的HUVEC凋亡及PI3K/AKT/eNOS信号通路的影响 [J]. 中国比较医学杂志, 2016, 26(3): 58-63.
[18] Tsai WH, Wu CH, Yu HJ, et al. l-Theanine inhibits proinflammatory PKC/ERK/ICAM-1/IL-33 signaling, apoptosis, and autophagy formation in substance P-induced hyperactive bladder in rats [J]. Neurourol Urodyn, 2017, 36(2): 297-307.
Hydrogen-rich saline reduces cerebral ischemia-reperfusion injury in ratsvia PI3K pathway
CHEN Ke-yan, DONG Wan-wei
(Department of Laboratory Animal Science, China Medical University, Shenyang 110001, China)
Objective To investigate the effect of hydrogen-rich saline on apoptosis in hippocampal neurons induced by cerebral ischemia-reperfusion in rats and PI3K/Akt/FoxO1 signaling pathway. Methods The rat model of focal cerebral ischemia-reperfusion was established by thread-occlusion of the middle cerebral artery in rats. SD rats were randomly divided into sham operation group (Sham group), ischemia-reperfusion group (I/R group) and hydrogen-rich saline treatment group (HRS group), 10 rats in each group. At 24 h after reperfusion, the serum levels of IL-6, TNF-a and IL-1β were detected by ELISA. Histological changes of the hippocampus were observed by pathology using HE staining. Apoptosis in brain tissues was observed by TUNEL staining. The expression changes of p-PI3K, Akt, caspase-3 and FoxO1 proteins were detected by Western blot assay. Results Compared with the sham group, pyramidal cells were arranged loosely in the I/R group and a large number of pyramidal cells were necrotized, and the amount of apoptotic hippocampal cells was increased. The levels of IL-1β, IL-6 and TNF-α were significantly increased (P< 0.05), as well as the expression of p-PI3K, Akt and caspase-3 in the brain tissue. However, the expression of FoxO1 protein was decreased. There were significant differences between the two groups (P< 0.05). Compared with the I/R group, the inflammatory factors were significantly decreased in the HRS group. The expressions of p-PI3K, Akt and caspase-3 were also significantly decreased, while the expression of FoxO1 protein was increased (P< 0.05). Conclusions Hydrogen-rich saline can reduce brain injury caused by ischemia-reperfusion, and its mechanism may be related to PI3K/Akt/FoxO1 signaling pathway.
Hydrogen rich saline; Ischemia reperfusion; PI3k; FoxO1; Apoptosis
国家自然青年科学基金项目(31201758);中国医科大学新教师基金项目(XZR20160036)。
陈克研(1983-),男,博士,讲师,从事基础医学和实验动物研究。 E-mail: chenkeyan888@163.com
研究报告
R-33
A
1671-7856(2017) 07-0013-04
10.3969.j.issn.1671-7856. 2017.07.003
2017-01-05

