Fkbp51基因敲除小鼠心脏与肝脏RNA表达谱系的分析比较
武光东,邱 彬,王婷婷,刘云波,雍伟东
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
Fkbp51基因敲除小鼠心脏与肝脏RNA表达谱系的分析比较
武光东,邱 彬,王婷婷,刘云波*,雍伟东*
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
目的 通过分析野生型小鼠(WT)和Fkbp51基因敲除(KO)小鼠心脏与肝RNA表达谱系之间的差异,研究Fkbp51基因在心脏和肝组织代谢通路中的作用。方法 利用第二代高通量基因测序技术,对Fkbp51 KO和WT小鼠的心脏和肝进行mRNA表达谱测序,将心脏测序的数据结果用DEGseq进行差异分析,肝脏组织测序结果用BRB-Array Tools进行分析,分别筛选出小鼠心脏和肝的差异基因,利用在线工具DAVID对差异基因进行GO本体分析和KEGG通路分析,利用BioinfoGP数据库的Venn工具分析两种组织的共差异基因,利用STRING数据库对蛋白质的互作网络进行分析。结果 (1)Fkbp51的缺失导致心脏中血管平滑肌收缩、趋化因子信号、视黄醇信号和MAPK信号等相关通路的mRNA表达发生改变;(2)Fkbp51的缺失导致肝组织中胆固醇合成及代谢、脂类代谢以及氧化还原等相关基因和通路的变化;(3)在心脏和肝组织中,Fkbp51缺失造成了4个共差异基因,其中Rnaset2b、Hmga1和Fkbp51下调,而Cyp2b10在心脏组织中下调,在肝组织中上调。这些蛋白均可与HSP90蛋白相互作用,参与心脏和肝组织中的代谢。结论Fkbp51在心脏和肝中参与不同的代谢及基因表达调控通路,其作用既是相互独立又是相互联系的。
Fkbp51基因敲除小鼠;心脏;肝脏;代谢;基因表达;信号通路
FK506结合蛋白(FK506 binding proteins,FKBPs)是一类具有肽基脯氨酰顺反异构酶活性的蛋白分子,参与细胞内蛋白折叠的修饰过程[1]。这类蛋白能够通过其TPR结构域直接与热休克蛋白HSP90结合,参与甾体类激素受体复合物的形成和功能调节[2]。
1993年人们首次发现了Fkbp51(FK506 binding proteins 51)[3],后续的研究发现Fkbp51能够与所有的甾体类激素受体相互作用[4],并且发现除雄性激素受体(AR)外,Fkbp51对其它甾体激素受体的转录活性起负调控作用,如糖皮质激素受体(GR)和雌激素受体(ER)等[5,6]。
糖皮质激素是一种肾上腺释放的生命所必须的类固醇激素,通过与糖皮质激素受体结合,作用于所有的组织和器官[7]。GC激活GR后可直接促进Fkbp51的表达,进而负反馈作用于GR,使其对GC的敏感性降低[8],因此Fkbp51可以通过负反馈GR活性,维持机体的稳态。除在糖代谢方面的调节作用,Fkbp51也在脂代谢过程中发挥重要作用。我们前期对Fkbp51基因敲除小鼠的肝脏和大脑海马区RNA-seq测序分析,发现Fkbp51在代谢和神经中均发挥作用,且在代谢通路和神经通路调节过程中的作用既是相互独立又是相互联系的[8]。针对心脏的研究中发现小鼠GR基因第9外显子的多态性(A3669G)可使其糖皮质激素合成不足,导致其心脏发育异常;具有此种多态性的人患冠状动脉疾病的风险增加,并可能出现心脏肿大、收缩功能障碍和心力衰竭[9]。
由于糖皮质激素及其受体在心脏中的重要功能,并且Fkbp51对糖皮质激素的重要调节功能,因此有理由推测Fkbp51可能在心脏的发育和功能调控中发挥作用。本研究通过分析Fkbp51基因敲除小鼠与野生型心脏和肝脏mRNA表达谱之间的差异,不仅有助于揭示Fkbp51在心脏和肝脏发育中的作用,还将有助于加深我们对Fkbp51在不同组织中功能差异的了解,为进一步研究Fkbp51的生物学功能提供理论基础。
1 材料和方法
1.1 实验动物
清洁级Fkbp51 KO与同窝野生型雄鼠(遗传背景为C57,由中国医学科学院医学实验动物研究所提供)【SYXK(京)2011-0022】,【SCXK(京)2014-0004】。选用8周龄Fkbp51 KO与同窝野生型雄鼠各3只,体重20 ~ 24 g。动物实验方案经过中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)批准。在使用实验动物的过程中充分考虑到动物福利原则,尊重动物生命,善待动物,减少动物的应激、痛苦和伤害。
1.2 实验方法
1.2.1 RNA提取及测序
8周龄Fkbp51 KO与同窝WT雄鼠各3只,脱颈处死后取心脏和肝组织,利用Trizol法提取RNA,肝脏样品交由华大基因测序,心脏样品交由诺禾致源测序。
1.2.2 差异表达基因的筛选
心脏组织和肝组织分别使用DEGseq软件和BRB-Array Tools软件进行差异基因分析,限定P值后获得差异基因列表。将得到的差异基因进行统一分析,集中关注显著上调或下调的基因,以此来阐述基因敲除后对心脏和肝脏组织产生的影响或揭示其中的生物学意义。
1.2.3 差异基因的GO本体分析及KEGG通路分析
注:1:RNA代谢监控;2:氧化还原;3:转录调控;4:脂质生物合成;5:稳态过程;6:细胞增殖调控;7:化 学平衡;8:大分子代谢过程中的正调控;9:微粒;10:小泡碎片;11:内质网;12:细胞外膜;13:细胞组 分;14:膜组分;15:细胞质;16:线粒体;17:过渡金属离子结合;18:铁离子结合;19:转录调节活性;20: 血红素结合;21:电子载体活动;22:四吡咯结合;23:肽酶抑制剂活性。图1 Fkbp51 KO和WT小鼠心脏与肝差异基因的相同GO本体分析Note. 1: RNA metabolic regulation; 2: oxidation reduction reaction; 3: transcriptional regulation; 4: lipid biosynthetic process; 5: homeostatic process; 6: cell proliferation control; 7: chemical homeostasis; 8: positive regulation of macromolecule metabolic process; 9: microsome; 10: vesicular fraction; 11: endoplasmic reticulum; 12: extrinsic to membrane; 13: cell fraction; 14: membrane fraction; 15: cytosol; 16: mitochondrion; 17: transition metal ion binding; 18: iron ion binding; 19: transcription regulator activity; 20: heme binding; 21: electron carrier activity; 22: tetrapyrrole binding; 23: peptidase inhibitor activity.Fig.1 The same GO ontology analysis of differential genes in the heart and liver of Fkbp51 KO and WT mice
通过在线工具DAVID(https://david.ncifcrf.gov/)对得到的差异基因进行分析。基因本体数据库(GO)能够将功能相同的基因聚类到一个单元,在生物学网络水平从生物过程、细胞成分和分子功能三个方面对差异基因进行注释;全基因组及代谢途径数据库(KEGG)是一个整合了基因组化学和系统功能信息的数据库,从系统信息、基因信息和化学信息三个方面对同一通路的差异基因进行聚类分析。1.2.4 差异基因的韦恩(Venn)分析
BioinfoGE(http://bioinfogp.cnb.csic.es/)数据库是一个有关基因组学和蛋白质组学分析研究的数据库。本文主要利用此数据库分析Fkbp51基因敲除后肝脏和心脏两种组织的共差异基因。
1.2.5 差异基因的相互作用网络分析
STRING(http://string-db.org/)数据库是一个有关已知或预测蛋白质间相互作用的数据库。本文主要利用此数据库对肝脏和心脏共差异基因的蛋白互作网络进行分析,进一步研究蛋白质之间的直接与间接作用。
2 结果
2.1Fkbp51 KO与WT小鼠心脏和肝脏差异基因的检测
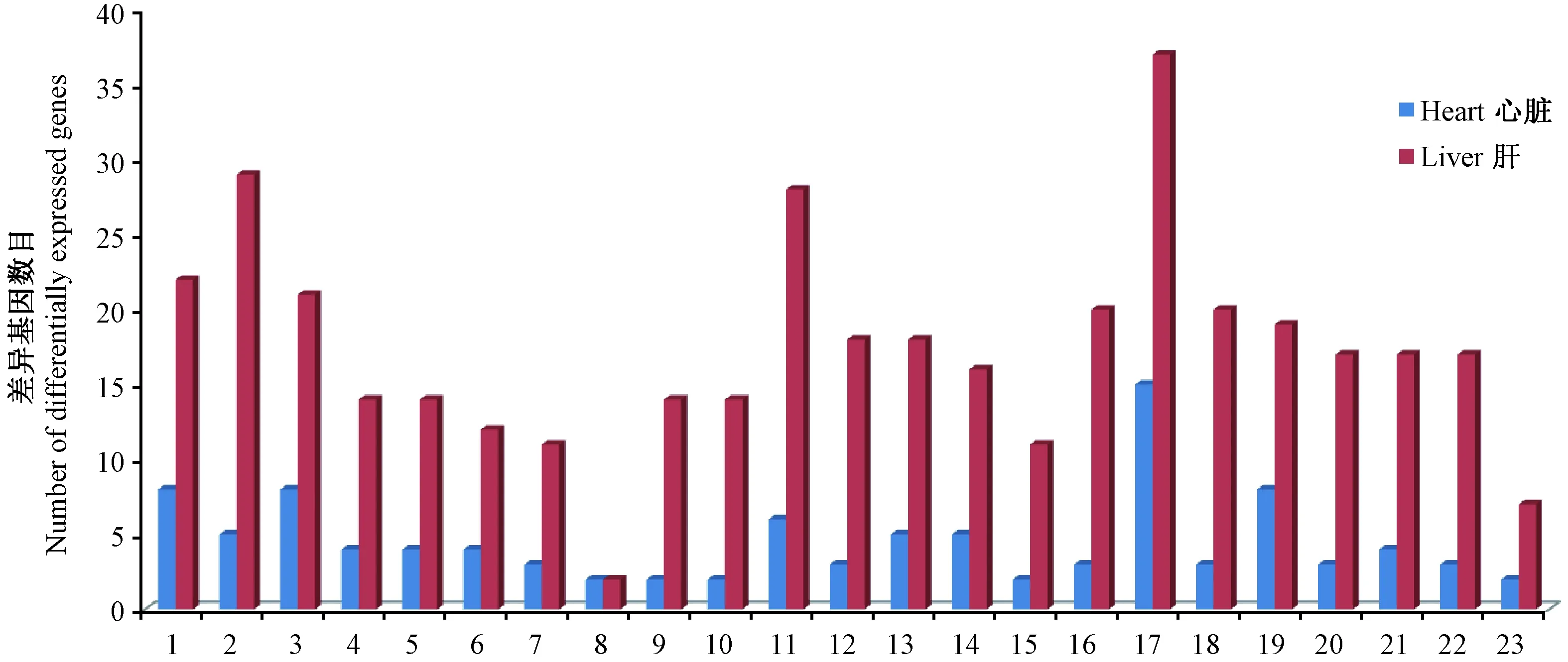
利用第二代高通量基因测序技术,对Fkbp51 KO和WT小鼠的心脏和肝脏mRNA进行表达谱测序,差异基因的P值限定为0.01后得到差异基因列表。心脏共得出153个差异基因,肝脏共得出206个差异基因(表1)。

表1 Fkbp51 KO和WT小鼠肝脏和心脏差异基因数目Tab.1 Differential gene numbers in the heart and liver of Fkbp51 KO and WT mice
2.2Fkbp51 KO与WT小鼠心脏与肝脏差异基因的GO本体分析和KEGG通路分析
利用DAVID对Fkbp51 KO小鼠心脏和肝脏的差异基因进行GO本体分析,从(图1)可以看出,差异基因的GO本体分析主要涉及与代谢和转录调控相关的生物学过程,在细胞组成中涉及到细胞器及细胞膜组成,在分子功能中主要涉及离子结合、转录、载体和肽酶抑制剂的活性。从系统信息、基因信息和化学信息三个方面对同一通路的差异基因进行聚类分析,分析发现心脏和肝脏中都受到影响的KEEG通路是花生四烯酸代谢通路(表2)。

表2 Fkbp51 KO和WT小鼠肝和心脏差异基因的相同KEGG通路Tab.2 The same KEGG pathway of differential genes in the heart and liver of Fkbp51 KO and WT mice
注:Fisher检验,P< 0.1;Benjamini-Hochberg校正P< 1。
Note. Fisher’s exact test,P< 0.1; Benjamini-Hochberg correctedP< 1.
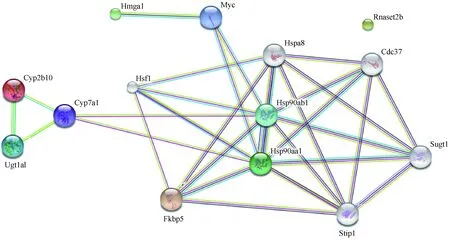
图3 Fkbp51 KO小鼠心脏和肝共差异基因的蛋白互作网络图Fig.3 Protein interaction network of the co-differential genes in the heart and liver of Fkbp51 KO mice
2.3Fkbp51 KO与WT小鼠心脏和肝共差异基因的韦恩分析
通过BioinfoGE在线工具对心脏和肝特异性基因进行韦恩(Venn)分析,共找到4个共差异基因(图2),其中Rnaset2b和Hmga1在心脏和肝中均为下调,Cyp2b10在心脏组织中下调而在肝组织中上调。
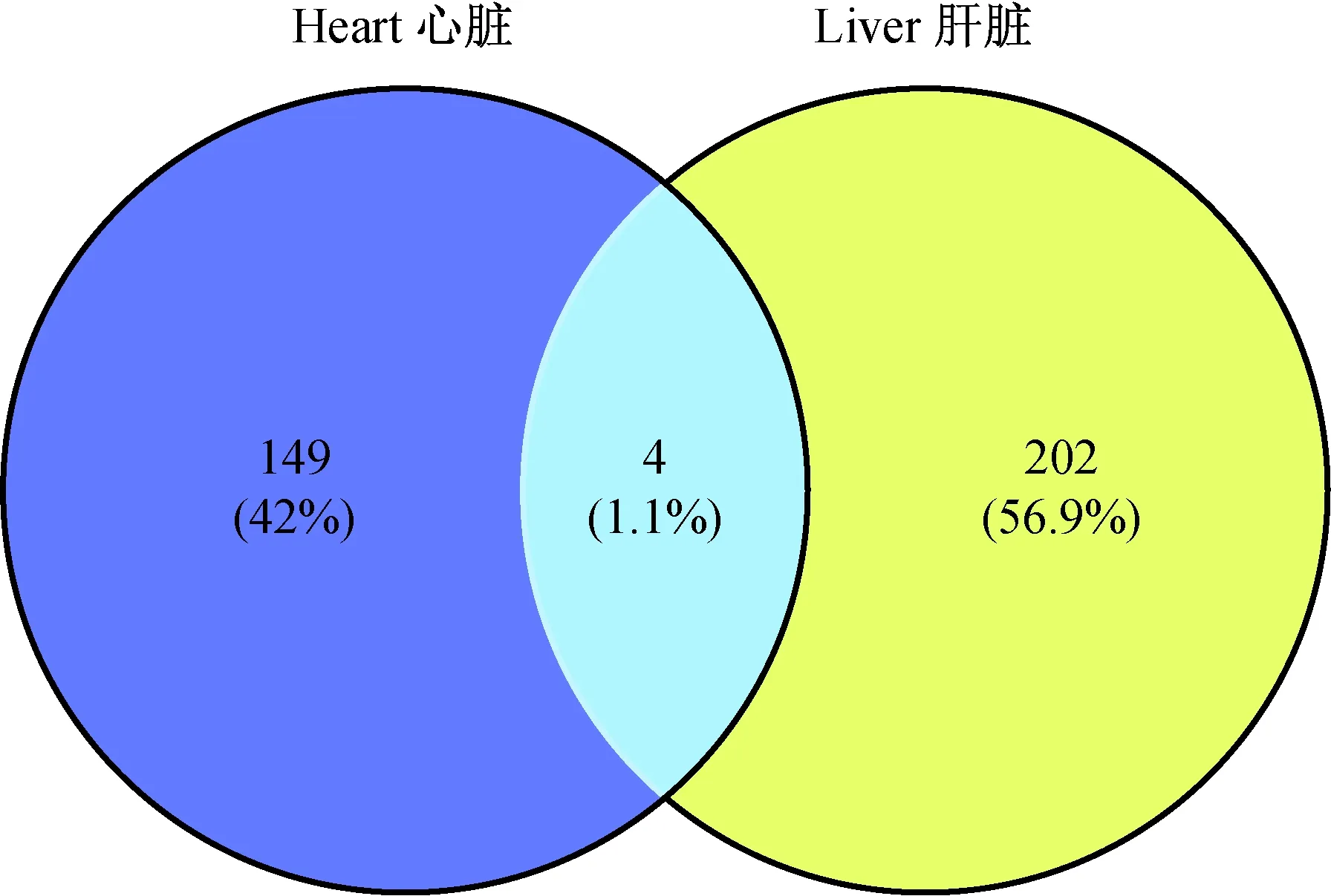
图2 Fkbp51 KO和WT小鼠心脏 与肝共差异基因的韦恩分析Fig.2 Venn analysis of the co-differential genes in the heart and liver of Fkbp51 KO and WT mice
2.4Fkbp51 KO小鼠心脏和肝共差异基因蛋白网络互作分析
通过STRING对Fkbp51基因敲除后心脏和肝组织的四个共差异基因编码的蛋白进行蛋白-蛋白互作网络分析,发现FKBP51与HSF1、HSP90AA1、HSP90AB1、HSPA8、STIP1、CDC37、SUGT1、MYC、HMGA1、CYP7A1、CYP2B10、UGT1A1形成互作网络(图3)。这些蛋白虽未出现在我们的测序数据里,但是为我们研究FKBP51在心脏发育和代谢方面的作用提供了一个明确的思路,具有重要的意义。
3 讨论
Fkbp51在心脏发育与代谢过程中的具体作用机制目前仍不清楚,其作用机制可能涉及多个方面,是一个多基因、多途径、多信号通路相互作用和相互影响的过程。研究Fkbp51 KO和WT小鼠的心脏和肝RNA-seq结果,对于从分子水平揭示Fkbp51在生物体内的作用是一个重要的突破口。
首先,对Fkbp51 KO小鼠心脏测序数据进行分析,共筛选出153个差异表达基因,对肝测序数据进行分析,共筛选出206个差异表达的基因。进一步,对心脏的差异基因进行GO本体分析和KEGG通路分析,发现心脏差异基因主要参与平滑肌收缩调节通路、趋化因子通路、花生四烯酸代谢通路、MAPK信号通路和钙信号通路等分子过程和信号通路。Pla2g2d和Cyp2b10几乎参与上述所有过程,Pla2g2d是磷脂酶A2的编码基因,具有钙离子结合活性和磷脂酶A2活性,可能参加炎症和免疫反应;Cyp2b10是细胞色素P450家族成员,能催化药物和胆固醇代谢,类固醇和其他脂类的合成[10]。Fkbp51与代谢及钙离子通道相关,Pla2g2d和Cyp2b10可能通过脂类代谢和钙离子通道与Fkbp51共同发挥作用。因此,进一步研究Pla2g2d、Cyp2b10与Fkbp51对脂代谢和钙离子通道的影响,对于探索Fkbp51在心脏中的脂代谢和肌细胞活性具有重要意义。
肝差异基因进行GO本体和KEGG通路分析,发现这些差异基因主要参与类固醇生物合成和代谢、脂类代谢、细胞色素P450外源性代谢通路等分子生物过程及信号通路[8]。在这些过程中,Cyp基因家族几乎参与上述所有过程。Cyp参与编码细胞色素P450超家族成员,且Cyp40和Fkbp51都是具有TPR结构域,都可以直接与HSP90结合参与甾体类激素受体复合物的形成,可能具有相似或相关的功能。通过对比研究Cyp基因家族和Fkbp51发挥作用的机制,对于探讨肝组织中Fkbp51参与的多种代谢通路及信号通路,具有重要意义。
进而对心脏和肝差异基因进行韦恩分析,发现小鼠心脏和肝的共差异基因共有四个,分别是Cyp2b10、Fkbp5、Hmga1和Rnaset2b,其中Rnaset2b、Hmga1、Fkbp5在心脏和肝中均下调,而Cyp2b10在心脏中下调而在肝组织中上调。Cyp2b10是细胞色素P450家族成员,细胞色素P450蛋白能催化药物代谢和胆固醇代谢,类固醇和其他脂类的合成。CYP2b10蛋白定位于内质网,代谢通路主要涉及细胞色素P450异生素的亚麻酸代谢和对代谢影响,并影响铁离子结合和氧化还原酶活性。Cyp2b10在肝中上调,在心脏中下调,说明基因敲除后肝组织中脂类代谢的影响高于心脏组织。
最后我们对心脏和肝的共差异基因进行蛋白-蛋白互作网络分析,发现,FKBP51与HSF1、HSP90AA1、HSP90AB1、HSPA8、STIP1、CDC37、SUGT1、MYC、HMGA1、CYP7A1、CYP2B10、UGT1A1共同形成蛋白互作网络。其中HSP90作为中间环节,与FKBP51、HSF1、CDC37、SUGT1、STIP1形成互作网络。HSP90即热休克蛋白,是一种具有ATP酶活性可诱导的分子伴侣,可以调节特定靶蛋白的正确折叠。HSF1是热休克转录因子1,可以特异性结合热休克启动元件并激活转录蛋白;CDC37即细胞分离周期蛋白37,在HSP90与其靶激酶结合发挥作用的过程中起重要作用;SUGT1有着丝粒功能,作用于热休克蛋白90的多个转录变异体剪接交互;STIP1是应激诱导磷蛋白1,影响HSP70和HSP90的相互关系及其ATP酶活性。这些蛋白的作用都围绕于HSP90蛋白,而HSP90蛋白可以与FKBP51形成复合物,参与糖皮质激素信号传导和PI3K-AKT信号。充分证明HSP90与FKBP51共同在心脏组织中的发挥重要作用,也从侧面证实了代谢调控与心脏发育是紧密联系的。
本研究通过对Fkbp51 KO与WT小鼠的心脏和肝RNA-Seq数据分析后,发现Fkbp51在心脏发育和代谢通路中的作用既是相互独立又是相互联系的,也为下一步深入研究Fkbp51基因在心脏发育和代谢通路中作用的分子机制提供了理论基础,进一步为Fkbp51在心脏疾病和肝疾病中可能起到的作用做出理论铺垫。未来我们将继续展开工作,对这些数据分析进行后续的分子生物学实验,以期进一步验证这些分析的可靠性。
[1] Toneatto J, Charo NL, Galigniana NM, et al. Adipogenesis is under surveillance of Hsp90 and the high molecular weight Immunophilin FKBP5[J]. Adipocyte, 2015,4(4): 239-247.
[2] Lagadari M, Zgajnar NR, Gallo LI, et al. Hsp90-binding immunophilin FKBP51 forms complexes with hTERT enhancing telomerase activity[J]. Mol Oncol, 2016, 10(7): 1086-1098.[3] Smith DF, Baggenstoss BA, Marion TN, et al. Two FKBP-related proteins are associated with progesterone receptor complexes[J]. J Biol Chem, 1993, 268(24): 18365-18371.
[4] Gallo LI, Ghini AA, Piwien PG, et al. Differential recruitment of tetratricorpeptide repeat domain immunophilins to the mineralocorticoid receptor influences both heat-shock protein 90-dependent retrotransport and hormone-dependent transcriptional activity[J]. Biochemistry, 2007, 46(49): 14044-14057.
[5] Guy NC, Garcia YA, Sivils JC, et al. Functions of the Hsp90-binding FKBP immunophilins[J]. Subcell Biochem, 2015, 78: 35-68.[6] Ni L, Yang CS, Gioeli D, et al. FKBP51 promotes assembly of the Hsp90 chaperone complex and regulates androgen receptor signaling in prostate cancer cells[J]. Mol Cell Biol, 2010, 30(5): 1243-1253.
[7] Evans RM. The steroid and thyroid hormone receptor superfamily [J]. Science, 1988, 240(4854): 889-895.
[8] 徐玉雪, 邱彬, 魏强, 等.Fkbp51基因敲除小鼠肝脏与大脑海马区RNA表达谱系的分析比较[J]. 中国比较医学杂志, 2016, 26(05): 40-48.
[9] Geelhoed JJ, van Duijn C, van Osch-Gevers L, et al. Glucocorticoid receptor-9beta polymorphism is associated with systolic blood pressure and heart growth during early childhood. The Generation R Study[J]. Early Hum Dev, 2011, 87(2): 97-102.[10] Faucette SR, Wang H, Hamilton GA, et al. Regulation of CYP2B6 in primary human hepatocytes by prototypical inducers[J]. Drug Metab Dispos, 2004, 32(3): 348-358.
Analysis and comparison of RNA expression profiles in the heart and liverofFkbp51 knockout mice
WU Guang-dong, QIU Bin, WANG Ting-ting, LIU Yun-bo*, YONG Wei-dong*
(1.Key Laboratory of Human Disease Comparative Medicine, Ministry of Health; 2.Key Laboratory of Human DiseaseAnimal Models, State Administration of Traditional Chinese Medicine; 3.Comparative Medicine Center,Institution of Laboratory Animal Science, CAMS & PUMC, Beijing 100021, China)
Objective To study the function ofFkbp51 in the heart and liver by analyzing the differential RNA expression profiles in the wild-type mice (WT) andFkbp51 knockout (KO) mice, and to elucidate the role ofFkbp51 gene in metabolic pathways in the heart and liver. Methods Using the second generation of high-throughput gene sequencing technology, the mRNA expression profiles of heart and liver were sequenced in WT andFkbp51 KO mice. The data of sequencing of heart tissues were analyzed by DEGseq, and the results of sequencing of liver tissues were analyzed by BRB-Array Tools. The differential genes of the heart and liver in the mice were screened respectively. Gene ontology (GO) analysis and KEGG pathway analysis were performed to analyze the differentially expressed genes using the online tool DAVID. In addition, the differential genes of the two organ tissues were analyzed by Venn diagram. The interaction network of proteins was analyzed using the STRING database. Results (1) The absence ofFkbp51 led to changes in mRNA expressions of heart-related signal pathways such as vascular smooth muscle contraction, chemokine, retinol, and MAPK signaling pathways. (2) The lack ofFkbp51 mostly induced changes in cholesterol synthesis and metabolism, lipid metabolism, redox and other related genes and pathways in the liver. (3) In the heart and liver,Fkbp51 deletionresult ed in four co-differential genes, among them, down-regulation ofRnaset2b,Hmga1 andFkbp51, whileCyp2b10 was down-regulated in the heart but up-regulated in the liver. All these proteins may interact with HSP90 protein and participat in the metabolism of heart and liver tissues. ConclusionsFkbp51 is involved in different metabolic and gene expression regulation pathways of heart and liver, and the roles are both independent and interrelated.
Fkbp51 KO mouse; Liver; Heart; Metabolism; Gene expression; Signaling pathways
北京市自然科学基金资助项目(NO. 7164278);国家科技重大专项(NO. 2014ZX10004002-003-001);国家自然科学基金(NO. 81272273);中央级公益性科研院所基本科研业务费(NO. DWS201508,DWS201607)。
武光东(1990-),男,硕士研究生,专业:动物学。Email: wu_guangdong@126.com
雍伟东,男,研究员,研究方向:生殖与发育生物学。Email: yongwd@hotmail.com; 刘云波,男,研究员,研究方向:实验动物质量控制。Email: yunboliu@126.com.*共同通讯
研究报告
R-33
A
1671-7856(2017) 07-0001-05
10.3969.j.issn.1671-7856. 2017.07.001
2017-02-08

