低氧增强骨髓间充质干细胞增殖维持分化潜能
康少平,刘淑艳,李永升,李 萍*
(1.河北北方学院医学检验学院,河北 张家口 075000; 2.张家口市第二医院骨外科,河北 张家口 075000)
低氧增强骨髓间充质干细胞增殖维持分化潜能
康少平1,刘淑艳1,李永升2,李 萍1*
(1.河北北方学院医学检验学院,河北 张家口 075000; 2.张家口市第二医院骨外科,河北 张家口 075000)
目的 观察低氧增强人骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)体外增殖并维持其多向分化潜能的作用。方法 分离10例骨髓血标本BMMSCs,分别进行低氧(低氧组)及常氧(常氧组)培养,观察BMMSCs的形态、增殖能力及成骨、成脂分化能力。结果 低氧组BMMSCs保持其长梭形,鱼群样分布,增长状态良好,常氧组BMMSCs形态呈多角形或扁平状,低氧组BMMSCs数量及生长速率较常氧组增加(P< 0.05),且低氧组BMMSCs具有成骨、成脂分化能力。结论 低氧能促进BMMSCs的体外增殖且维持其多向分化潜能。
低氧;骨髓间充质干细胞;增殖;多向分化
骨髓间充质干细胞(bonemarrowmesenchymalstemcells,BMMSCs)是一种具有自我更新及向成骨细胞、软骨细胞、脂肪细胞以及神经细胞等多种类型的组织细胞分化能力的非造血干细胞[1]。近年来,BMMSCs已被广泛应用于多个领域,包括骨病的病理生理学研究、细胞和基因治疗及骨再生组织工程等[2,3]。由于BMMSCs在骨髓单个核细胞中的比例非常小,仅占0.1%左右;尽管其在体外表现出一种独特的增殖能力, 但仍然难以满足组织工程和细胞治疗的需要[4]。因此,探索理想的BMMSCs体外扩增条件具有重要的理论与临床应用价值。本研究通过对BMMSCs进行体外低氧培养,观察其增殖及多向分化能力,从而建立理想的BMMSCs体外扩增方法,为BMMSCs的临床应用提供参考依据。
1 材料和方法
1.1 材料
骨髓血标本取自张家口市第二医院骨科收治的10例新鲜股骨颈骨折患者,患者在行全髋关节置换术中抽取骨髓血,分离获得BMMSCs。患者均无血液系统疾病和家族遗传病史。该项研究经医院伦理委员会批准并征得患者知情同意。
1.2 主要仪器和试剂
倒置相差显微镜,德国Leica公司;三气细胞培养箱,美国Thermo公司;胎牛血清(FBS)、DMEM/F-12培养基、青霉素-链霉素(双抗)、0.25% 胰蛋白酶-EDTA,均购自美国Gibco公司;CCK-8细胞增殖检测试剂盒,上海贝博生物有限公司;人外周血淋巴细胞分离液(Percoll),天津市灏洋生物制品科技有限责任公司;成骨诱导分化试剂盒、成脂诱导分化试剂盒、茜素红染液、油红O染液,均购自苏州赛业生物科技有限公司。
1.3 方法
1.3.1BMMSCs的分离与培养
手术过程中取5mL骨髓血标本置于肝素抗凝管,轻轻混匀,与等量DMEM/F-12混合,1000r/min离心10min;弃上清及脂肪层,并用DMEM/F-12重悬细胞,以等体积比缓慢沿管壁叠加在Percoll液面上,2000r/min离心25min;吸取乳白色环状细胞层即单个核细胞层,PBS洗涤2次,1000r/min离心10min;用细胞培养基(DMEM/F-12,10%FBS,1% 双抗)重悬细胞,混匀后以1×106/mL接种至六孔板中,镜下观察细胞分布均匀;分别置于低氧(5%O2,低氧组)及常氧(21%O2,常氧组)下进行培养。细胞低氧培养是在三气细胞培养箱中进行,即在充满5%O2、5%CO2和90%N2的混合气体,最终O2浓度为5%。48h更换新鲜培养液,去除未贴壁细胞;以后每隔3d换液一次,细胞在培养箱外换液的时间不超过5min,以免低氧、复氧效应发生。
1.3.2BMMSCs形态观察
在进行高校学生党建工作的过程中,重视理论教育非常重要,组织实践活动也必不可少。但是,在目前高校学生党建工作中,普遍存在着重视理论教育,忽视实践活动的现象,同时高校对学生的考核过程中,仅仅进行基础理论知识的考核,但是却没有对学生的实践活动进行考核,从而导致学生只重视理论课程的学习,忽视实践活动的重要性。
倒置相差显微镜下观察低氧组及常氧组细胞生长状况及形态特征。
1.3.3BMMSCs增殖测定
应用CCK-8(CellCountingKit-8)法对BMMSCs进行增殖分析。收集第3代低氧或常氧组细胞分别以6.25×103、1.25×104、2.5×104、5×104、1×105/mL密度接种于96孔板,绘制一条以细胞数量为横坐标,OD值为纵坐标的标准曲线。将第3代低氧及常氧组细胞以3,000个/孔(100μL细胞悬液)接种于96孔板,分别置于低氧及常氧环境中培养1、2、3、4、5、6、7d,培养终末时间每孔加入10μLCCK-8溶液孵育3h,使用酶标仪测定450nm各孔的OD值。
1.3.4BMMSCs成骨诱导与钙结节染色
将第3代低氧、常氧组细胞按3×104/cm2接种于6孔板中,基础培养基(DMEM/F-12、10%FBS、1%双抗)进行培养,24h后使用成骨细胞诱导分化培养基(DMEM/F-12、10%FBS、1%双抗、0.1μmol/L地塞米松、10mmol/Lβ-甘油磷酸、60μmol/L抗坏血酸),分别置于低氧、常氧下进行成骨诱导,每隔2d换液1次,成骨诱导培养第14d使用茜素红染液做钙结节染色。PBS洗涤细胞2次,4% 冷甲醛固定15min,双蒸水洗涤3次,茜素红染液染色10min,双蒸水洗涤2次。在低倍镜下观察每个视野中阳性钙结节的个数,每孔随机选取5个视野, 取其均数做统计学分析。
1.3.5BMMSCs成脂诱导与脂滴染色
将第3代低氧、常氧组细胞按2×104/cm2接种于六孔板中,基础培养基进行培养,每隔2d换液一次,待细胞达到100% 融合后,使用成脂细胞诱导分化培养基(DMEM/F-12、10%FBS、1%双抗、1μmol/L地塞米松、10μg/mL胰岛素、0.5mmol/L3-异丁基-1-甲基黄嘌呤),分别置于低氧、常氧下进行成脂诱导分化。每隔2d换液1次,成脂诱导培养第14d,使用油红O染液进行脂滴染色。PBS洗涤细胞2次,4%中性甲醛固定60min,双蒸水洗涤3次,待干,加入预配并过滤后的油红O染液,染色15min,吸去多余染液,PBS洗涤2次。倒置相差显微镜下观察形成的脂滴。

2 结果
2.1BMMSCs形态观察
新分离的细胞在低氧条件下培养粘附性差,第3 ~ 5天,大部分细胞不贴壁,悬浮在细胞培养液中(图1A);但在常氧条件下培养24h内即有贴壁细胞生长,3 ~ 5d后细胞呈圆形、细长梭型(图1B)。因此,常氧培养所有新分离的细胞直到细胞生长达到第一次融合,将融合的BMMSCs消化传代,传代的细胞随机分成两组:低氧组与常氧组。当细胞进行传代培养至第3代,低氧组细胞形态均一,胞体小,核质比大,细胞大多呈细长梭形,鱼群样分布,增长状态良好(图1C)。而常氧组细胞形态大小不一,细胞体积较大,胞浆量增多,形态呈多角形或扁平状(图1D)。

注:(A)低氧条件下体外新分离的细胞,(B)常氧条件下体外新分离的细胞; (C)低氧组第3代BMMSCs,(D)常氧组第3代BMMSCs。(200 ×)图1 低氧组与常氧组BMMSCs形态观察Note. BMMSCs Newly isolated in vitro under hypoxic (A) and normoxic (B) conditions; the 3rd passage of BMMSCs cultured in vitro under hypoxia (C) and normoxia (D).Fig.1 Morphological observation of BMMSCs in the hypoxia and normoxia groups
2.2 低氧对BMMSCs体外增殖的影响
采用CCK-8法对第3代常氧及低氧组BMMSCs进行增殖比较分析。结果发现,细胞培养第1 ~ 2天两组BMMSCs数量差异无显著性;但从第3 ~ 7天,低氧组BMMSCs数量及生长速率较常氧组明显增加,差异有显著性(P< 0.05)(图2)。因此推断低氧具有促进BMMSCs增殖的作用。
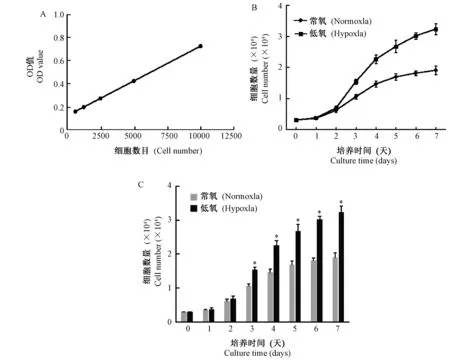
注:(A)一条以细胞数量为横坐标,OD值为纵坐标的标准曲线;(B)低氧及常氧组BMMSCs细胞生长曲线(横坐标为培养时间, 纵坐标为细胞数量);(C)低氧组BMMSCs在培养第3 ~ 7 d,生长速率较常氧组增加,差异有显著性(*P< 0.05)。图2 低氧组与常氧组BMMSCs体外增殖能力Note. A. Standard curve of cell number (horizontal axis) related to OD value (vertical axis). B. Cell growth curve of BMMSCs in the normoxia and hypoxia groups. The horizontal axis indicates culture time, and the vertical axis indicates cell number. C. Cell growth rate of BMMSCs in the hypoxia group was increased faster than the normoxia group after culture for 3~7 d, with a significant difference (*P< 0.05).Fig.2 Proliferation abilities of BMMSCs in the hypoxia and normoxia groups cultured in vitro
2.3 BMMSCs成骨、成脂分化能力测定
低氧组与常氧组BMMSCs成骨诱导培养14 d后进行茜素红染色,倒置显微镜下观察均可见红色钙结节(图3A,B)。低倍镜下观察,低氧组每个视野可见(18.1 ± 3.3)个钙结节,常氧组每个视野可见钙结节数目为(16.5 ± 2.6)个, 两组每个视野钙结节数无明显差异(P> 0.05);两组BMMSCs成脂诱导培养14 d后进行油红O染色,均可见红色脂滴出现(图3C,D)。结果表明低氧环境对BMMSCs具有成骨、成脂诱导分化的作用。
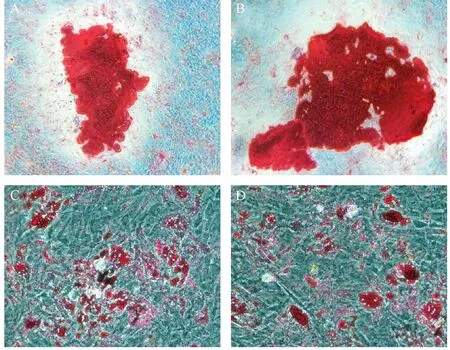
注:(A,B)低氧组与常氧组BMMSCs体外成骨诱导培养 14 d茜素红染色;(C,D)低氧组与常氧组BMMSCs体外 成脂诱导培养14 d油红O染色。(200 ×)图3 低氧组与常氧组BMMSCs体外成骨、成脂 细胞诱导Note. (A, B) Induction of osteoblast differentiation of BMMSCs after culture in vitro under hypoxia (A) and normoxia (B) for 14 d, Alizarin red staining. (C, D) Induction of adipocyte differentiation of BMMSCs after culture in vitro under hypoxia (C) and normoxia (D) for 14 d. Oil-red O staining.Fig.3 Induction of osteoblast and adipocyte differentiation of BMMSCs after culture under hypoxia and normoxia
3 讨论
BMMSCs由于具有向多种类型的组织细胞分化的能力,因此被广泛应用于细胞和基因治疗及骨再生组织工程等领域,而如何获得大量纯化并维持其干细胞特性(自我更新和分化潜能)的BMMSCs则成为临床干细胞应用成功的前提条件。目前国内外学者致力于开发一种有效的BMMSCs扩增方法,包括通过改变体外细胞培养基的营养成分、生长因子和缓冲液的pH值等[5,6],但很少注意到氧气浓度对细胞增殖的影响。BMMSCs在体外原代培养中的氧浓度(21%)往往不符合体内生理状态,正常人骨髓是一典型的低氧环境,氧浓度为1% ~ 7%[7],即正常状态下BMMSCs生存在相对缺氧的微环境中。本文通过比较低氧与常氧两种不同体外培养条件对BMMSCs增殖的影响,从而建立理想的BMMSCs体外扩增方法。
本研究中,新分离的BMMSCs在低氧条件下贴壁黏附性差,但在常氧条件下细胞黏附性好,24 h内即有贴壁细胞生长,推断原代细胞的粘附性可能受到低氧张力的抑制,这种“不贴壁性”可能与其在低氧条件下保持相对“未分化状态”从而维持自我更新的能力相关。D’Ippolito G等[8]证明,低氧环境下细胞转录因子Oct-4、SSEA-4(胚胎阶段特异性抗原-4)mRNA的表达比常氧下高,端粒逆转录酶的活性增加,推断低氧是保持干细胞“未分化状态”的重要因素。常氧培养所有新分离的细胞直到细胞生长达到第1次融合,将细胞传代分组,我们发现细胞培养至第3代,低氧组细胞保持均一形态,大多呈细长梭形,鱼群样分布,增长状态良好,而常氧组细胞显示多角形或扁平状形态。Colter等[9]证实 BMMSCs至少有两种不同形态细胞,分别为 RS 细胞(spindle-shaped cells)及扁平状细胞,这两种细胞亚群在细胞传代的过程中数量不同,随着传代次数增加,细胞可出现明显的衰老标志,形态由梭形变为伸展扁平状。因此,本结果提示低氧培养可起到防止细胞衰老的作用,可以用于长期的体外扩增并维持其干细胞潜能。与我们的研究相似,Tsai等也证实1%氧浓度培养BMMSCs可以减缓衰老[10]。之后,我们采用CCK-8法对第3代BMMSCs在常氧及低氧环境下进行增殖比较分析,结果发现低氧组BMMSCs在培养第3 ~ 7天细胞数量及生长速率较常氧组增加,提示低氧具有促进BMMSCs增殖的作用。同时对两组BMMSCs进行成骨、成脂诱导分化培养,均可见红色钙结节及红色脂滴形成,推断低氧并未改变BMMSCs向成骨、成脂细胞诱导分化的能力。
关于低氧如何调节BMMSCs的增殖及分化,其机制尚不清楚,大多数研究认为与低氧诱导细胞产生的低氧诱导因子通过调控转录因子Oct-4,Sox2和Nanog的表达有关[11]。然而,由于间充质干细胞的来源不同、细胞接种密度不同、低氧浓度的不同及低氧培养时间不同,低氧对间充质干细胞的增殖效率的报道结果也不尽相同。一些研究发现低氧有明显的抑制细胞增殖作用[12,13],也有发现低氧增加增殖能力或延长寿命[14,15]。本研究选择5%氧浓度、持续长时间的培养及合适的细胞接种密度证实低氧对BMMSCs增殖起促进作用。
总之,我们的研究结果证实低氧在促进BMMSCs的增殖及维持其多向分化潜能中起着至关重要的作用。另一方面,低氧反映干细胞增殖与分化的真实微环境,通过体外模拟BMMSCs体内的低氧环境,可以更好地了解细胞生物学特性及其再生潜能,这将为BMMSCs的大量获取及其作为种子细胞应用于细胞、基因治疗及组织工程提供参考依据。
[1] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893): 41-49.
[2] Scotti C, Piccinini E, Takizawa H, et al. Engineering of a functional bone organ through endochondral ossification[J]. Proc Natl Acad Sci U S A, 2013, 110(10): 3997-4002.
[3] Arvidson K, Abdallah BM, Applegate LA, et al. Bone regeneration and stem cells[J]. J Cell Mol Med, 2011, 15(4): 718-746.
[4] Sotiropoulou PA, Perez SA, Salagianni M, et al. Characterization of the optimal culture conditions for clinical scale production of human mesenchymal stem cells[J]. Stem Cells, 2006, 24(2): 462-471.
[5] Chen HH, Decot V, Ouyang JP, et al.Invitroinitial expansion of mesenchymal stem cells is influenced by the culture parameters used in the isolation process[J]. Biomed Mater Eng, 2009, 19(4-5): 301-309.
[6] Yuan Y, Kallos MS, Hunter C, et al. Improved expansion of human bone marrow-derived mesenchymal stem cells in microcarrier-based suspension culture[J]. J Tissue Eng Regen Med, 2014, 8(3): 210-225.
[7] Chow DC, Wenning LA, Miller WM, et al. Modeling pO2distributions in the bone marrow hematopoietic compartment. II. Modified Kroghian models[J]. Biophys J, 2001, 81(2): 685-696.
[8] D’Ippolito G, Diabira S, Howard GA, et al. Low oxygen tension inhibits osteogenic differentiation and enhances stemness of human MIAMI cells[J]. Bone, 2006, 39(3): 513-522.
[9] Colter DC, Sekiya I, Prockop DJ. Identification of a subpopulation of rapidly self-renewing and multipotential adult stem cells in colonies of human marrow stromal cells[J]. Proc Natl Acad Sci U S A, 2001, 98(14): 7841-7845.
[10] Tsai CC, Chen YJ, Yew TL, et al. Hypoxia inhibits senescence and maintains mesenchymal stem cell properties through down-regulation of E2A-p21 by HIF-TWIST[J]. Blood, 2011, 117(2): 459-469.
[11] Forristal CE, Wright KL, Hanley NA, et al. Hypoxia inducible factors regulate pluripotency and proliferation in human embryonic stem cells cultured at reduced oxygen tensions[J]. Reproduction, 2010, 139(1): 85-97.
[12] Holzwarth C, Vaegler M, Gieseke F, et al. Low physiologic oxygen tensions reduce proliferation and differentiation of human multipotent mesenchymal stromal cells[J]. BMC Cell Biol, 2010, 11:11.
[13] Ren H, Cao Y, Zhao Q, et al. Proliferation and differentiation of bone marrow stromal cells under hypoxic conditions[J]. Biochem Biophys Res Commun, 2006, 347(1): 12-21.
[14] Fehrer C, Brunauer R, Laschober G, et al. Reduced oxygen tension attenuates differentiation capacity of human mesenchymal stem cells and prolongs their lifespan[J]. Aging Cell, 2007, 6(6): 745-757.
[15] Nekanti U, Dastidar S, Venugopal P, et al. Increased proliferation and analysis of differential gene expression in human Wharton’s jelly-derived mesenchymal stromal cells under hypoxia[J]. Int J Biol Sci, 2010, 6(5): 499-512.
Hypoxia promotes proliferation of bone marrow mesenchymal stemcells and maintains their potential of differentiation
KANG Shao-ping1, LIU Shu-yan1, LI Yong-sheng2, LI Ping1*
(1.College of Laboratory Medicine, Hebei North University, Zhangjiakou 075000, China; 2.Department ofOrthopedics, The Second Hospital of Zhangjiakou, Zhangjiakou 075000)
Objective To observe the promoting effect of hypoxia on proliferation of human bone marrow mesenchymal stem cells (BMMSCs) and maintaining their potential of multi-directional differentiationinvitro.MethodsBMMSCswereisolatedfrombonemarrowbloodsamplesofpatientswithbonefracture,andculturedunderhypoxic(groupA)ornormoxic(groupB)conditions.Themorphology,proliferationandosteogenicandadipogenicpotentialoftheBMMSCswereobserved.ResultsBMMSCsinthegroupAshowedalongspindleshapeandafishshoal-likedistribution,andwerewell-grown,whilethemorphologyofcellsinthegroupBappearedpolygonalorflat.ThequantityandgrowthrateofBMMSCsinthegroupAwereincreasedcomparedwiththegroupB(P< 0.05),withanosteogenicandadipogenicpotential.ConclusionsHypoxiacanpromotetheproliferationofBMMSCsin vitroandmaintaintheirmulti-directionaldifferentiationpotential.
Hypoxia;Humanbonemarrowmesenchymalstemcells;Proliferation;Multidirectionaldifferentiation
张家口市科学技术研究与发展计划项目(1321052D)。
康少平(1981-),女,讲师,研究方向:干细胞。Email: kang_shao_ping@163.com
李萍(1969-),女,教授,研究方向:干细胞。 Email: zjkliping@163.com
研究报告
R-33
A
1671-7856(2017) 07-0070-05
10.3969.j.issn.1671-7856. 2017.07.013
2016-12-14

