孕期尼古丁暴露致成年雄性仔鼠心肌纤维化
董伟家,李希宁,夏志恒,张于娟
(1.湖州师范学院医学院护理学院人体解剖与组织胚胎系,浙江湖州313000;2.苏州大学基础医学与生物科学院和医学部人体解剖与组织胚胎系,江苏苏州215123)
孕期尼古丁暴露致成年雄性仔鼠心肌纤维化
董伟家1,李希宁1,夏志恒1,张于娟2
(1.湖州师范学院医学院护理学院人体解剖与组织胚胎系,浙江湖州313000;2.苏州大学基础医学与生物科学院和医学部人体解剖与组织胚胎系,江苏苏州215123)
目的 研究孕期尼古丁暴露对子代大鼠心射血功能和心肌纤维化的影响。方法尼古丁暴露组孕鼠从妊娠第4~20天每天sc尼古丁6.0 mg·kg-1,连续17 d,正常对照组sc生理盐水。检测孕21 d胎鼠、出生后15和90 d雄性仔鼠的体质量和心脏质量。心电图记录90 d雄性仔鼠的心率;多普勒超声仪检测仔鼠心射血功能,包括每搏输出量(SV)、心输出量(CO)、左室长轴缩短分数(FS)、射血分数(EF)、左室后壁舒张期厚度(LVPWd)和室间隔舒张期厚度(IVSd);电镜检测心肌超微结构,Masson染色定性检测心肌胶原蛋白的沉积,放射免疫法定量检测心肌组织Ⅰ型胶原蛋白水平。结果 与正常对照组仔鼠比较,孕期尼古丁暴露组21 d胎鼠和15 d雄性仔鼠心脏质量和体质量下降(P<0.05,P<0.01),但90 d雄性仔鼠的心脏质量和体质量无明显差异。尼古丁暴露组90 d雄性仔鼠心率升高〔366±10 vs(418±10)min-1〕(P<0.05);超声心动图检测显示,CO,FS和EF明显降低(P<0.01),IVSd和LVPWd明显增加(P<0.05,P<0.01);电镜观察显示,心肌纤维紊乱,细胞外基质增加;Masson染色显示,心肌胶原蛋白沉积;放射免疫法检测结果 显示,心肌组织Ⅰ型胶原蛋白水平升高〔0.59±0.09 vs(0.40±0.05)μg·g-1组织〕(P<0.01)。结论孕期尼古丁暴露可导致成年雄性仔鼠心肌组织Ⅰ型胶原蛋白水平升高,心肌纤维化,心射血功能下降。这些病理变化可能导致其心血管疾病易感性增加。
尼古丁;怀孕;心射血功能;心肌纤维化;Ⅰ型胶原蛋白
DOl:10.3867/j.issn.1000-3002.2017.06.018
主动或被动吸烟是孕妇最易接触到的不良刺激之一。尼古丁是烟气的主要成分,可以直接通过胎盘进入胎儿体内浓缩聚集,其浓度可比母体内高15%。因此,孕期的尼古丁暴露更易导致对胎儿的损伤[1]。基础研究和流行病学调查显示,孕期尼古丁暴露可导致子代心血管疾病易感性增加,如高血压、冠心病、肥胖和胰岛素抵抗等[2-6]。进一步的研究显示,孕期的尼古丁暴露会导致子代大鼠心肌组织重构,包括心肌细胞肥大、肌球蛋白重链增加以及胶原蛋白沉积等[7],而这些变化是心肌纤维化的病理基础。心肌组织纤维化是指胶原蛋白在心肌组织细胞外基质中沉积,从而导致心脏收缩和舒张功能的障碍,影响心射血功能[8]。Ⅰ型胶原蛋白由成纤维细胞分泌,是胶原纤维的主要成分,决定了组织的韧性。在心肌组织中Ⅰ型胶原蛋白主要分布在心肌细胞间质中,其组成纤维的弹性和伸展性较小,有较强的抗牵拉作用[9],但当心肌组织发生纤维化病变时,其显著特点即为Ⅰ型胶原蛋白水平增加,导致心收缩和舒张功能障碍,进而导致心脏的射血功能下降[10]。因此,Ⅰ型胶原蛋白的正常表达对心脏的射血功能至关重要。
前期的研究显示,孕期的尼古丁暴露会导致成年雄性子代大鼠心率增加[11],但是机制不明。本研究主要探讨孕期尼古丁暴露对雄性子代大鼠心脏射血功能和心肌组织纤维化的影响,期望从病理生理学角度对子代大鼠心率增加的可能机制加以探讨。
1 材料与方法
1.1 实验动物
雌、雄SD大鼠,清洁级,体质量250~300 g,购自上海杰思捷实验动物有限公司〔生产许可证号:SCXK(沪)2013-0006;使用许可证号:SYXK(沪)2012-0006;动物合格证号:2010002608320〕。大鼠分笼单独饲养,控制光照(12/12 h昼/夜循环),自由饮食饮水。
1.2 主要试剂和仪器
尼古丁注射液(6 g·L-1,Sigma公司,美国),临用时用生理盐水新鲜配制;Masson染液(上海远慕生物科技有限公司);Ⅰ型胶原蛋白放免检测试剂盒(上海捷瑞生物有限公司)。心脏超声仪(Philips iE33,美国);电镜(场发射扫描电镜,SIRION-100,荷兰FEI公司);光学显微镜(Olympus CHK2-F-GS,日本);γ-计数器(GC-1500,北京科普顺科技有限公司);心电图机(科曼CM300,中国)。
1.3 大鼠分组和染毒
于18∶00将雌、雄大鼠随机合笼,次日8∶00观察鼠笼底盘,有白色阴道栓雌鼠即为交配成功,当日记为孕第1天。将怀孕4 d的28只孕鼠随机分为2组,每组14只。实验组孕鼠每天8∶00~9∶00 sc给予尼古丁6.0 mg·kg-1,该尼古丁剂量近似于中、重度吸烟者的尼古丁摄入量[1],连续注射17 d。正常组孕鼠sc给予生理盐水0.3 mL。妊娠第21天9∶00,2组孕鼠各随机选取7只处死,取胎鼠(实验当日不注射尼古丁)测量体质量和心脏质量。其他孕鼠21~22 d正常分娩。仔鼠于出生15和90 d时检测体质量。30 d时仔鼠雌雄分笼,为避免雌激素和孕激素的影响,仅选取雄性仔鼠用于实验指标的检测。
1.4 仔鼠心率和射血功能检测
将90 d仔鼠置于塑料桶内,心电图机的3个电极分别连接到仔鼠的左前肢、右前肢和左后肢。仔鼠处于清醒状态下检测心电图,选择记录平稳状态下的心电图,计算心率。之后ip给予10%水合氯醛0.8 mL·kg-1麻醉进行心脏超声检测。胸部剃毛,将探头用耦合剂置于胸腔部位。超声心动图以胸骨旁长轴切面和心尖四腔平面进行检查,分别记录每搏输出量(stroke volume,SV)、心输出量(cardiac output,CO)、左室长轴缩短分数(left ventricular long axis shortening fraction,FS)、射血分数(ejection fraction,EF)、左室后壁舒张期厚度(left ventricular posterior wall diastolic diameter,LVPWd)和室间隔舒张期厚度(interventricular septum diastolic diameter,IVSd)。
1.5 电镜观察仔鼠心肌超微结构
功能检查完成后,将仔鼠以胸骨旁切口开胸,从主动脉根部取出心脏,生理盐水快速冲洗,选取左心室部分,以刀片切取约3 mm×3 mm×3 mm的心肌组织,置于2.5%戊二醛液中固定。扫描电镜检查由浙江大学紫金港校区电镜室完成。
1.6 Masson染色检测仔鼠心肌胶原蛋白沉积和放射免疫法检测Ⅰ型胶原蛋白水平
刀片切取约5 mm×5 mm×5 mm左心室心肌组织,固定,切片,脱蜡至水;Masson复合染色液染色5 min;0.2%醋酸水溶液浸洗;5%磷钨酸水溶液分化8 min;0.2%醋酸水溶液浸洗2次;苯胺蓝染色液染色5 min,0.2%醋酸水溶液洗2次;无水乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察有无胶原蛋白沉积。正常心肌组织呈红色,蓝色提示纤维蛋白沉积。
放射免疫法检测Ⅰ型胶原蛋白水平,由上海捷瑞生物有限公司完成。具体操作如下:心肌组织块称重,剪碎,加入9倍体积的PBS液,冰浴中用匀浆器研磨制备匀浆,894×g离心8 min,取上清液0.1 mL加入0.4 mL PBS液,稀释成2%匀浆上清进行检测。样品在室温平衡30 min,标准品、质控血清和样品各50 μL加入已包被[I125]抗Ⅰ型胶原蛋白抗体的试管,各管再加入200 μL温育液,室温摇床2 h,用洗涤液1000 μL清洗,吸干;再重复清洗2次,吸干1次。γ-计数器测定每管1 min的放射性强度计数,依据标准曲线和质控血清计算样品中Ⅰ型胶原蛋白浓度。
1.7 统计学分析
2 结果
2.1 孕期尼古丁暴露对仔鼠心脏和体质量的影响
孕鼠尼古丁暴露导致21 d胎鼠和15 d雄性仔鼠的体质量和心脏质量较正常对照组降低(P<0.01),90 d时无明显差异(表1)。
2.2 孕期尼古丁暴露对成年雄性仔鼠心率和射血功能的影响
出生后90 d,正常对照组和尼古丁暴露组雄性仔鼠的心率分别为366±10和(418±10)min-1,孕鼠尼古丁暴露显著增加了成年雄性仔鼠的心率(P<0.01)。心脏超声心动图显示,与正常对照组比较,尼古丁暴露组仔鼠的CO,FS和EF明显降低(P<0.01),IVSd(P<0.05)和LVPWd(P<0.01)明显升高;SV降低约35%,但无统计学意义,其原因可能是个体差异较大且观察例数较少所致(表2)。提示尼古丁暴露组雄性仔鼠心脏的舒缩功能下降。
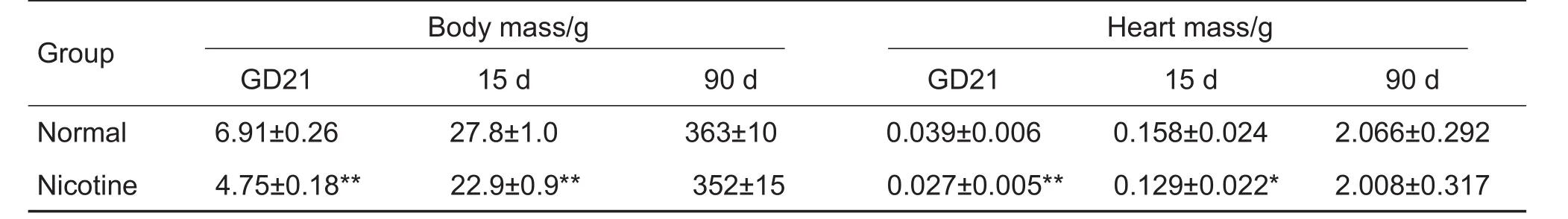
Tab.1 Effect of prenatal nicotine exposure on body mass and heart mass of 21 d fetal rats and offsprings

Tab.2 Effect of prenatal nicotine exposure on heart ejection function of offspring
2.3 孕期尼古丁暴露对成年雄性仔鼠心肌超微结构的影响
电镜观察显示,正常对照组仔鼠心肌纤维排列整齐规则,M线和Z线清晰;尼古丁暴露组仔鼠心肌纤维排列紊乱,部分纤维断裂,心肌纤维间隙增大,间充质增多,但M线和Z线仍可见(图1)。

Fig.1 Effect of prenatal nicotine exposure on cardiac ultrasturcture of offspring observed under an electron microxcope.See Tab.1 for the rat treatment.↑shows cardiac myofibril;⇧shows M line;↑shows Z line.
2.4 孕期尼古丁暴露对成年雄性仔鼠心肌组织Ⅰ型胶原蛋白水平的影响
Masson染色(图2)显示,正常对照组雄性仔鼠心肌纤维表面呈暗红色,均匀一致;而尼古丁暴露组心肌纤维表面部分呈深蓝色,提示有胶原蛋白沉积。放射免疫法检测结果 显示,尼古丁暴露组雄性仔鼠心肌组织Ⅰ型胶原蛋白为(0.59±0.09)μg·g-1组织(n=5),较正常对照组(0.40±0.05)μg·g-1组织(n=6)明显升高(P<0.01)。
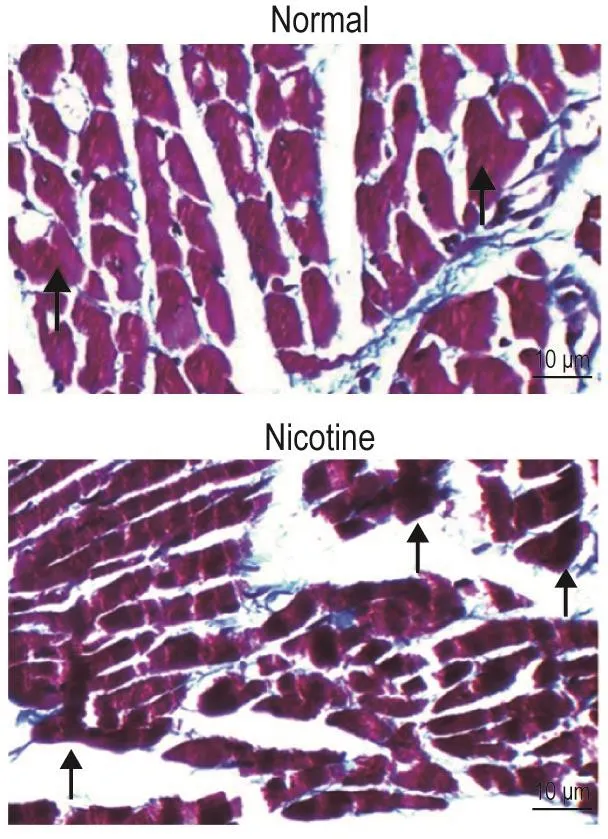
Fig.2 Effect of prenatal nicotine exposure on myocardial tissue of offspring observed by Masson staining.See Tab.1 for the rat treatment.The arrows show collagen protein.
3 讨论
本研究结果 显示,孕鼠尼古丁暴露导致孕21d胎鼠和出生15 d仔鼠的心脏质量和体质量低于正常对照组,可能有2个原因:①尼古丁的直接毒性作用。尼古丁可以通过胎盘并在胎儿体内浓缩并聚集,浓度可高于母体的15%,高浓度尼古丁可直接影响胎儿的发育,导致其体质量和重要脏器质量下降[1]。②尼古丁可以降低子宫和胎盘的血流量,导致胎儿缺血低氧[12],进一步导致胎鼠宫内生长发育受限[13]。但本研究中,90 d雄性仔鼠的心脏质量和体质量与正常对照组比较无显著差异,说明尼古丁暴露组雄性仔鼠出生后出现了“追赶性生长(catchup growth)”。追赶性生长主要是由于胎儿在宫内受到不良因素的刺激,导致宫内生长受限,胎儿出生时体质量较低,出生后主要通过细胞增大或者间充质增生等,于成年后达到正常子代体质量[14]。追赶性生长虽然实现了体质量的正常,但器官的功能与正常子代可能存在差异,其代偿功能可能下降[15-16]。本研究结果 显示,尼古丁暴露组雄性仔鼠心脏舒缩功能下降,射血功能降低,心率代偿性增高。可见90 d的雄性仔鼠心脏质量虽然与正常对照组仔鼠无明显差异,但心脏射血功能受损。
至于心脏功能受损的潜在机制,有报道提示,孕期尼古丁暴露会导致子代心肌组织重构,包括心肌细胞肥大、肌球蛋白比重增加和胶原蛋白沉积等[7]。本研究用电镜检测了仔鼠心肌的超微结构,可见尼古丁暴露组仔鼠心肌肌原纤维排列紊乱,部分肌原纤维断裂,肌原纤维间隙增大,间充质增多。
心肌组织纤维化的主要本质是细胞基质的重塑,胶原蛋白沉积,部分伴有心肌肥大[17]。本研究Masson染色结果 显示,尼古丁暴露组雄性仔鼠心肌纤维表面部分呈深蓝色,说明有胶原蛋白沉积,这与电镜观察的结果 一致。心肌组织Ⅰ型胶原蛋白水平检测结果 也显示,尼古丁暴露组雄性仔鼠心肌组织Ⅰ型胶原蛋白水平明显上升。Ⅰ型胶原蛋白由成纤维细胞分泌,是胶原纤维的主要成分,决定了组织的韧性,其组成的纤维弹性和伸展性较小,有较强的抗牵拉作用[9],但当心肌组织发生纤维化病变时,其显著特点即为Ⅰ型胶原蛋白水平增加,导致心脏的收缩和舒张功能障碍,进而导致心脏的射血功能下降,心率增加[10]。
综上提示,孕期尼古丁暴露可导致雄性仔鼠心肌组织出现Ⅰ型胶原蛋白沉积,从而导致心肌组织纤维化,心脏舒缩功能下降,心输出量减少,心率代偿性增加。这也可以解释孕期尼古丁暴露导致仔鼠心率增加的原因[11]。但是,尼古丁是直接通过表观遗传学机制导致心肌纤维化,还是由于其使心脏功能下降间接导致心肌纤维化并不明确,还需要进一步探讨。本课题组将对孕期尼古丁暴露大鼠子二代相关指标进行检测分析,并对胎源性疾病机制进行深入研究。
[1]Slotkin TA.Fetal nicotine or cocaine exposure:which one is worse?[J].J Pharmacol Exp Ther,1998,285(3):931-945.
[2]Xiao D,Xu Z,Huang X,Longo LD,Yang S,Zhang L.Prenatal gender-related nicotine exposure increases blood pressure response to angiotensinⅡin adult offspring[J].Hypertension,2008,51(4):1239-1247.
[3]Lawrence J,Xiao D,Xue Q,Rejali M,Yang S,Zhang L.Prenatal nicotine exposure increases heart susceptibility to ischemia/reperfusion injury in adult offspring[J].J Pharmacol Exp Ther,2008,324(1):331-341.
[4]Xiao DL.Fetal nicotine exposure increases the risk of cardiovascular disease in late life.A review of the literature[J].Austin J PharmacolTher,2014,2(11):1-6.
[5]Somm E,Schwitzgebel VM,Vauthay DM,Aubert ML,Hüppi PS.Prenatal nicotine exposure and the programming of metabolic and cardiovascular disorders[J].Mol Cell Endocrinol,2009,304(1-2):69-77.
[6]Behl M,Rao D,Aagaard K,Davidson TL,Levin ED,Slotkin TA,et al.Evaluation of the association between maternal smoking,childhood obesity,and metabolic disorders:a National Toxicology Program Workshop review[J].Environ Health Perspect,2013,121(2):170-180.
[7]Chou HC,Chen CM.Maternal nicotine exposure during gestation and lactation induces cardiac remodeling in rat offspring[J].Reprod Toxicol,2014,50:4-10.
[8]Ma J,Ding C.Research progress on cardiac fibroblasts and myocardial fibrosis[J].Chin J Cardiol(中华心血管病杂志)。2014,42(3):269-272.
[9]Rosin NL.Molecular mechanisms of myocardial fibrosis development[D].Halifax,Nova Scotia:Dalhousie University,2014.
[10]Goldsmith EC,Bradshaw AD,Zile MR,Spinale FG. Myocardial fibroblast-matrix interactions and potential therapeutic targets[J].J Mol Cell Cardiol,2014,70:92-99.
[11]Feng Y,Caiping M,Li C,Can R,Feichao X,Li Z,et al.Fetal and offspring arrhythmia following exposure to nicotine during pregnancy[J].J Appl Toxicol,2010,30(1):53-88.
[12]Wong MK,Nicholson CJ,Holloway AC,Hardy DB. Maternal nicotine exposure leads to impaired disulfide bond formation and augmented endoplasmic reticulum stress in the rat placenta[J].PLoS One,2015,10(3):e0122295.
[13]Huang LZ,Hsiao SH,Trzeciakowski J,Frye GD,Winzer-Serhan UH.Chronic nicotine induces growth retardation in neonatal rat pups[J].Life Sci,2006,78(13):1483-1493.
[14]Embleton ND,Korada M,Wood CL,Pearce MS,Swamy R,Cheetham TD.Catch-up growth and metabolic outcomes in adolescents born preterm[J].Arch Dis Child,2016,101(11):1026-1031.
[15]Stawerska R,Szałapska M,Hilczer M,Lewiński A. Ghrelin,insulin-like growth factor I and adipocytokines concentrations in born small for gestational age prepubertal children after the catch-up growth[J].J Pediatr Endocrinol Metab,2016,29(8):939-945.
[16]Alves JG,Vasconcelos SA,de Almeida TS,Lages R,Just E.Influence of catch-up growth on abdominal fat distribution in very low birth weight children-cohort study[J].J Pediatr Endocrinol Metab,2015,28(1-2):153-156.
[17]Díez J.Mechanisms of cardiac fibrosis in hypertension[J].J Clin Hypertens(Greenwich),2007,9(7):546-550.
Prenatal nicotine exposure induces cardiac fibrosis in adult male offspring
DONG Wei-jia1,LI Xi-ning1,XIA Zhi-heng1,ZHANG Yu-juan2
(1.Department of Human Anatomy Histology and Embryology,School of Medicine and Nursing Science, Huzhou University,Huzhou 313000,China;2.Department of Human Anatomy,Histology and Embryology, School of Biology and Basic Medical Sciences,Suzhou University,Suzhou 215123,China)
OBJECTlVETo investigate the effect of prenatal nicotine exposure on cardiac ejection function and myocardial fibrosis of the offspring of rats.METHODSPregnant rats were sc given nicotine 6.0 mg·kg-1,once daily for 17 d.The body mass and heart mass of the offspring were detected at the 21thday of gestation,and 15 and 90 d after birth.Heart rate of 90 d offspring was recorded by ECG,and cardiac functions were detected by Doppler ultrasonography,including cardiac output(CO),stroke volume(SV), ejection fraction(EF),left ventricular long axis shortening fraction(FS),interventricular septum diastolic diameter(IVSd)and left ventricular posterior wall diastolic diameter(LVPWd).The myocardial ultrastructure was detected under an electron microscope.Masson staining was used to detect the myocardial collagen fiber deposition.The level of collagen protein typeⅠin heart tissue was detected by radioimmunoassay.RESULTSCompared with control group,prenatal nicotine exposure resulted in a decrease of heart mass and body mass in groups of 21 d fetal rats and 15 d offspring(P<0.05,P<0.01),but had no effect on the 90 d offspring.Compared with the normal control group,the heart rate of 90 d offspring increased〔366+10 vs(418+10)min-1〕(P<0.05),CO,FS and EF decreased(P<0.01),and IVSd and LVPWd increased(P<0.05,P<0.01).Electron microscopy revealed that in the heart of nicotine 90 d offspring,myocardial fiber arrangement was loosened and confused,while extracellular matrix increased.Masson staining showed collagen deposited in the myocardium.The level of collagen typeⅠin heart tissue increased〔0.59±0.09 vs (0.40±0.05)μg·g-1tissue〕(P<0.01).CONCLUSlONPrenatal nicotine exposure induces the increased level of cardiac collagen typeⅠ,myocardial fibrosis and decrease of cardiac ejection function in adult offspring, which may lead to increased susceptibility to cardiovascular diseases.
nicotine;pregnancy;cardiac ejection function;myocardial fibrosis;collagen typeⅠ
The project supported by National Natural Science Foundation of China(81200482);and Natural Science Research Project of Colleges and Universitys in Jiangsu Province(SZ2170311)
DONG Wei-jia,E-mail:dwj@zjhu.edu.cn,Tel:(0572)2322569
R99
A
1000-3002-(2017)06-0621-05
2016-10-26接受日期:2017-05-27)
(本文编辑:齐春会)
国家自然科学基金(81200482);江苏省高校自然科学研究项目(SZ2170311)
董伟家,男,实验师,主要从事心血管疾病的相关研究。
董伟家,E-mail:dwj@zjhu.edu.cn,Tel:(0572)2322569

