新疆地区维汉民族淋巴细胞亚群和NK细胞与帕金森病的相关性
蒋 森,王鹏飞,高 华,杨新玲
(1新疆医科大学第一附属医院神经内科,乌鲁木齐 830054;2新疆医科大学第五附属医院神经内科;3新疆医科大学第二附属医院;*通讯作者:E-mail:yangxinling2014@163.com)
新疆地区维汉民族淋巴细胞亚群和NK细胞与帕金森病的相关性
蒋 森1,王鹏飞1,高 华2,杨新玲3*
(1新疆医科大学第一附属医院神经内科,乌鲁木齐 830054;2新疆医科大学第五附属医院神经内科;3新疆医科大学第二附属医院;*通讯作者:E-mail:yangxinling2014@163.com)
目的 研究新疆地区帕金森病(PD)患者外周血中淋巴细胞亚群及NK细胞数量的变化,为PD发病机制研究提供新的视角。 方法 应用流式细胞仪荧光染色法测定共33例维吾尔族及汉族PD患者外周血中T淋巴细胞、B淋巴细胞和NK细胞数量,并与20例健康对照组进行比较。同时也比较了不同民族间及不同用药人群之间各细胞亚群的差异,分析了不同病程、疾病严重程度及HY分级与各细胞亚群的相关性。 结果 帕金森病患者外周血中CD3+,CD4+,CD8+T淋巴细胞较对照组明显下降(P<0.05),但B淋巴细胞较对照组无明显变化(P>0.05),NK细胞较对照组上升(P<0.05)。维族患者与汉族患者相比,各淋巴细胞亚群及NK细胞数量无明显变化(P>0.05)。采用美多巴或森福罗治疗患者各细胞亚群无明显改变(P>0.05),年龄与CD3+T淋巴细胞亚群、病程与B细胞亚群数量相关(P<0.05)。 结论 PD患者外周血的淋巴细胞及NK细胞比例失调。外周血淋巴细胞亚群的变化可能有助于评估PD的病情进展。
帕金森病; T淋巴细胞; B淋巴细胞; NK细胞; 流式细胞仪
帕金森病(Parkinson’s disease,PD)是较为常见的神经系统退行性疾病之一,其发病率仅次于阿尔茨海默病。主要病理改变为黑质纹状体及多巴胺能神经通路多巴胺神经元的逐渐变性缺失。遗传、环境、年龄等是其发病的部分原因。而近年来,又有研究显示炎症反应也在其发病过程中占有重要地位[1]。有研究者观察到动物模型中,CD4+、CD8+T淋巴细胞亚群在PD病程22个月时上升[2]。也有研究显示,在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制备的PD模型中T细胞缺乏可以减缓多巴胺能神经元的退变过程[3,4],又有研究提示在PD患者尸检中发现了位于中枢神经系统中的自然杀伤细胞(natural killer cells,NK cells)。以上事实说明淋巴细胞亚群与帕金森病密切相关。而多个病例对照研究显示,PD患者中淋巴细胞亚群及NK细胞虽然处于正常范围内,但较正常人仍有所改变。说明PD患者存在免疫紊乱。但以上研究结果不尽相同,仍需扩大样本容量以进一步研究,以明确淋巴细胞亚群及NK细胞在PD病理过程中的作用,寻找可能的PD标记物。本研究抽取PD患者及正常对照组外周血,测定淋巴细胞亚群及NK细胞并进行比较,同时分析在不同民族间、不同的病程中是否有变化,探讨其规律性。
1 资料和方法
1.1 研究对象
1.1.1 病例组选择 入选标准:病例组患者为2016-09~2017-01于新疆医科大学第一附属医院神经内科门诊及住院治疗的PD患者33例,其中男性16例,女性17例,平均年龄(61.3±10.9)岁,全部病例经详细询问病史,体格检查,结合头颅MRI检查结果,可认定符合英国帕金森病学会脑库制定的临床诊断标准[5],疾病分期使用Hoehn-Yahr进行评价分级[6]。
排除标准:3个月内服用过免疫抑制剂或免疫增强剂;在3个月内接受过疫苗注射者;患有神经系统进行性或其他变性疾病/恶性病变或其他免疫性疾病者;帕金森综合征患者;不能完成外周血相关指标检测者。
病例分组:分别根据民族、是否服用相关药物进行如下分组。按照民族分为两组,维族患者8例,汉族患者25例。按是否应用美多巴分为两组:服用过美多巴治疗两周以上15例,未服用美多巴18例。按是否应用森福罗分为两组:服用过森福罗两周以上6例,未服用过森福罗27例。
1.1.2 对照组选择 对照组为2016-09~2017-01新疆医科大学第一附属医院体检人群,均无明显心脑血管疾病、糖尿病、结缔组织病、肝肾疾病及血栓性疾病等。其中男性8例,女性12例。平均年龄(57.5±9.5)岁。
1.1.3受试者一般资料 所有受试者采用详细的问卷调查、体格检查、实验室检测的方法收集相关资料。病例组及对照组均记录受试者年龄、性别、体格检查、Hoehn-Yahr(HY)分级、用药史及既往史等。所有患者资料的采集和分型均由神经内科专科医生负责。过程中患者及医生均不知患者分组情况。
1.2 淋巴细胞及NK细胞检测方法
外周血淋巴细胞及NK细胞检测使用直接免疫荧光染色法。全部受检者均于清晨空腹抽取静脉血2 ml置于EDTA紫色抗凝管中。抽血过程中护士及患者均不知检测目的。各取血70 μl置于4个试管中,分别加入荧光素标记抗人CD3PE/CD4APC/CD8FITC,CD3PE/CD19FITC,CD56FITC单克隆抗体(美国BD公司)各5 μl,留一个空白对照试管。混匀后置于阴暗处18-20 ℃孵育20 min。各加红细胞裂解液(美国BD公司)2ml充分震荡混匀,置于阴暗处18-20 ℃孵育10 min。待红细胞充分溶解后加1 ml PBS洗液(美国BD公司),2 000 r/min离心5 min,弃上清液,加300 μl PBS洗液重悬。使用Epics-XL型流式细胞仪(美国Coulter公司生产)检测,以阳性率的百分率计算结果。
1.3 统计学处理
采用SPSS15.0软件,所有计量资料均采用均数±标准差表示。应用Kolmogorov-Smirnov非参数检验进行正态性分析,若符合正态,多组比较使用单因素方差分析,两组比较使用t检验。若不符合正态分布,或方差不齐,或例数较少,使用秩和检验。计量资料两组相关性采用Pearson直线相关性分析。P<0.05为差异有统计学意义。
2 实验结果
2.1 临床资料比较
两组在年龄、性别及民族构成方面无显著差异(P>0.05,见表1)。病例组患者病程(2.87±2.09)年,HY分级1.85±0.60;服用美多巴15例,未服用18例;服用森福罗6例,未服用27例。
表1 病例组及对照组基本资料比较
Table 1 Characteristics of the included population
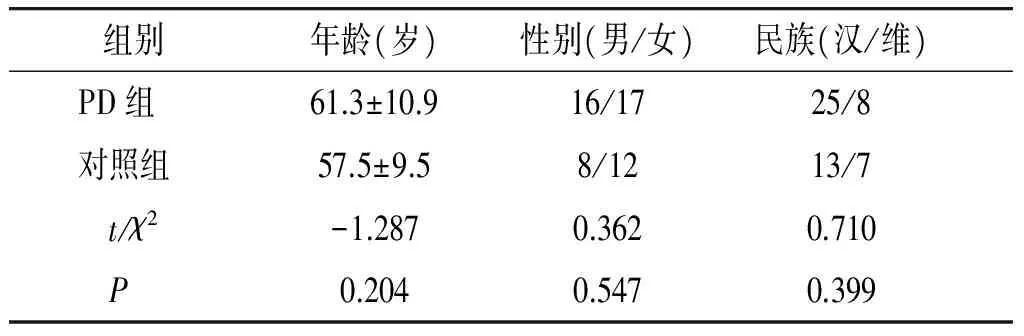
组别年龄(岁)性别(男/女)民族(汉/维) PD组61.3±10.916/1725/8 对照组57.5±9.58/1213/7 t/χ2-1.2870.3620.710 P0.2040.5470.399
2.2 淋巴细胞亚群及NK细胞结果分析
2.2.1 PD组与对照组比较 PD患者外周血CD3+,CD4+,CD8+T细胞亚群较对照组显著降低(P<0.05),CD19+B细胞亚群较对照降低,但差异无统计学意义(P=0.345),CD56+NK细胞较对照组显著上升(P=0.012),差异有统计学意义(见表2)。
表2 病例组及对照组各细胞亚群结果 (%)
Table 2 Comparison of lymphocytes and NK cells between PD patients and controls (%)
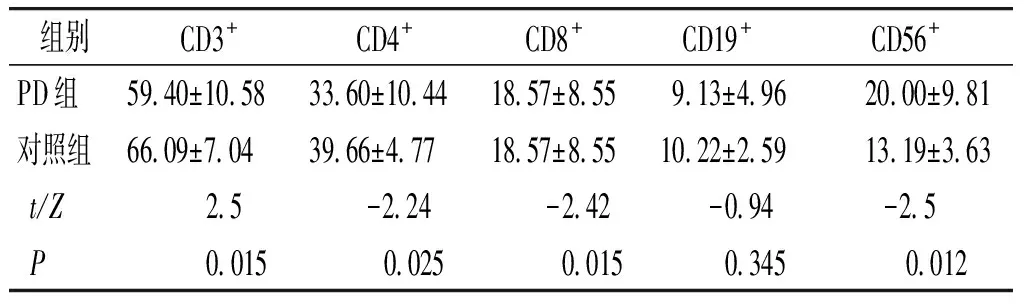
组别CD3+CD4+CD8+CD19+CD56+PD组5940±10583360±10441857±855913±4962000±981对照组6609±7043966±4771857±8551022±2591319±363t/Z25-224-242-094-25P0015002500150345 0012
2.2.2 维汉族之间进行比较 汉族和维族的PD患者或对照组之间,CD3+,CD4+,CD8+T细胞,CD19+B细胞,CD56+NK细胞亚群水平无明显差异(P>0.05,见表3)。
2.2.3 服用及未服用患者之间比较 服用美多巴组较未服用患者各细胞亚群有所下降,但其差异无统计学意义(P>0.05)。服用森福罗PD与未服用组比较,除CD8细胞亚群外,其余各亚群有所下降,但差异无统计学意义(P>0.05,见表4)。
表3 维汉族患者各细胞亚群结果 (%)
Table 3 Comparison of lymphocytes and NK cells between Han and Uygur ppopulations (%)
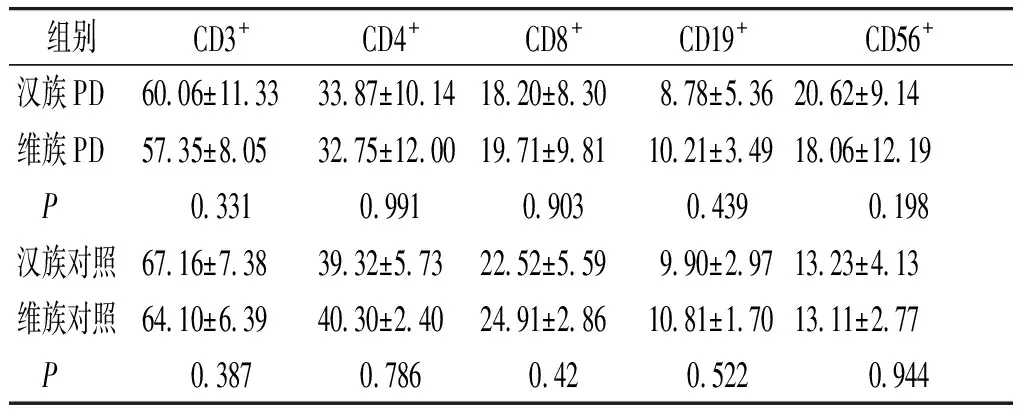
组别CD3+CD4+CD8+CD19+ CD56+汉族PD6006±11333387±10141820±830878±5362062±914维族PD5735±8053275±12001971±9811021±3491806±1219 P0331099109030439 0198汉族对照6716±7383932±5732252±559990±2971323±413维族对照6410±6394030±2402491±2861081±1701311±277 P038707860420522 0944
表4 服用不同药物PD患者各细胞亚群结果 (%)
Table 4 Comparison of levels of lymphocytes and NK cells between PD patients with different treatment (%)
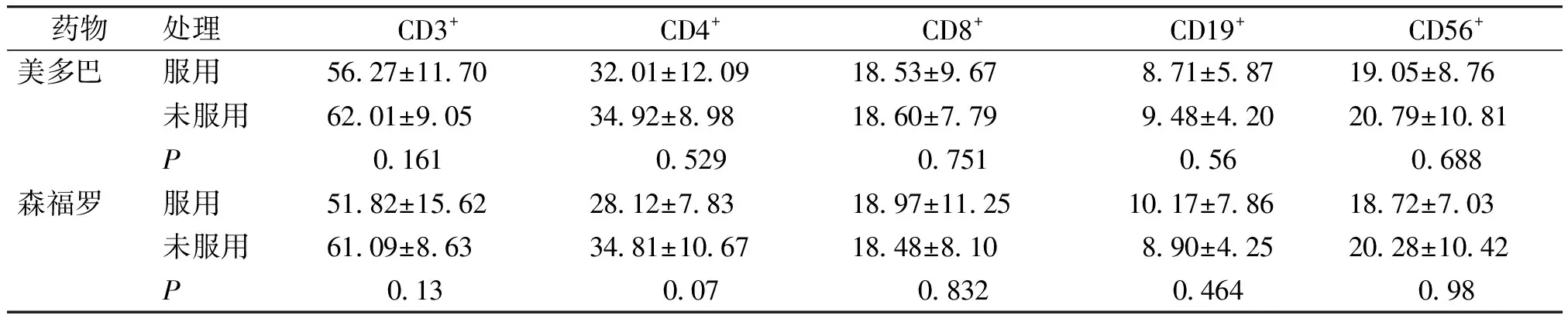
药物处理CD3+CD4+CD8+CD19+CD56+美多巴服用5627±11703201±12091853±967871±5871905±876未服用6201±9053492±8981860±779948±4202079±1081P 0161 052907510560688森福罗服用5182±15622812±7831897±11251017±7861872±703未服用6109±8633481±10671848±810890±4252028±1042P 013 00708320464098
2.2.4 相关性分析 对所有PD患者的各细胞亚群数量与年龄、病程以及HY分级进行相关性分析,可见CD3与年龄呈线性相关,相关系数为0.446,CD19与病程呈线性相关,相关系数为-0.406(见表5)。
表5 年龄,病程及HY评分与各细胞亚群相关性
Table 5 Correlation of age or duration or HY with lymphocytes or NK cells
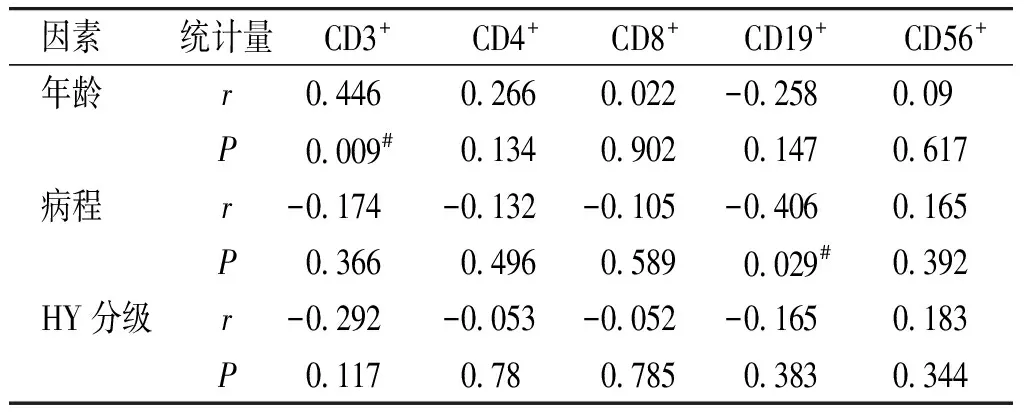
因素统计量CD3+CD4+CD8+CD19+ CD56+年龄r044602660022-0258009P0009#0134090201470617病程r-0174-0132-0105-04060165P0366049605890029#0392HY分级r-0292-0053-0052-01650183P0117078078503830344
#P<0.05
3 讨论
帕金森病(PD)是一类中枢神经系统退行性疾病,由遗传与环境相关作用所致的复杂性疾病。近年来,关于帕金森病与免疫相关研究逐渐增多。Abramsky最早提出免疫学异常可能是PD发病的重要影响因素之一。研究表明,中枢神经系统炎症是全身炎症反应的一部分。全身系统性炎症反应导致促炎分子、外周T细胞亚群进入脑组织中激活小胶质细胞[7-12],一旦小胶质细胞被激活,就可产生大量细胞毒性分子,包括NO[13],ROS[14]等,促进了帕金森病的病理过程。CD4+T淋巴细胞亚群被称为辅助性T淋巴细胞(Th),MTPT动物模型提示,其可介导Fas/Fasl导致多巴胺神经元的死亡[15],但也有人发现其对多巴胺神经元有保护作用。辅助性T淋巴细胞在免疫系统中所起作用较为广泛,所以其在帕金森病人外周血变化规律并不十分肯定,但大多数对PD病例-对照的研究,倾向于其降低[16-33]。一些研究还提到,根据患者疾病严重程度或患者年龄的增加,CD4+T淋巴细胞亚群降低的趋势进一步增加[17,19,24,26-28,31,32]。CD8+T 淋巴细胞亚群在杀伤病毒感染细胞及肿瘤细胞中有重要作用。关于其与帕金森病之间关系,在多个研究中并未得到证实[16-20,24,29,33]。只有少数研究显示PD患者CD8+T淋巴细胞数量较对照组下降[23,26,28,31]或是上升[22,25,30]。李凤舞等[32]及赵旭[26]的研究显示,随着PD患者病情加重,CD8+T细胞数量逐渐减低,但只有病情发展至最严重阶段,PD较对照组CD8+T细胞下降才差异有统计学意义。B细胞可分泌抗体,也是一类重要的抗原提呈细胞,同时可分泌多种细胞因子和某些趋化因子等来参与免疫应答的调控,CD19或CD20为B细胞的表面标志,通过不同染色的抗体与其结合,可通过流式细胞仪将其区分出来。其与帕金森的相关研究较少,关系并不明确,大部分研究[16,18,19]显示PD组患者较正常对照组下降。仅有张思韵等[29]未观察到两者之间的关系。NK细胞(natural kill cell)不依赖抗体,因此称为自然杀伤细胞,是固有免疫细胞,作用于靶细胞杀伤作用出现较早。而且其可分泌多种细胞因子,是机体抗感染及抗肿瘤的重要因素,也参与Ⅱ型超敏反应。其表面特异性标志为CD16,CD56,仍可通过流式细胞仪测定。有研究显示其在PD患者中上升[18,19,28,31],Stevens等[16]也观察到NK细胞的上升,但在其研究中,与对照组相比无统计学意义。
本研究结果显示,患者外周血中,CD3+,CD4+,CD8+T细胞亚群较对照组显著降低,B细胞亚群较对照降低,但差异无统计学意义,NK细胞较对照组显著上升。这与之前的研究结果[29,31]大体接近。可能与神经元变性与大量丢失、自由基生成、氧化反应增强,使大脑皮质至纹状体、丘脑底核至苍白球与黑质网状部复合体的兴奋性神经递质作用过强,从而引起大脑皮层中枢神经体液免疫调节力减弱,T细胞活性降低等相关[34]。NK细胞升高可能是发生了K细胞对多巴胺能细胞的抗体依赖的细胞介导的细胞毒性作用反应。有人认为K细胞活性低对病情进展不利,因为它们不能有效抑制那些有害因素。
目前国内比较两民族间差异性的研究尚属少见。既往研究显示,维汉民族之间PD患者危险因素、临床表现有所差异[35,36]。因此,本研究还进行了不同民族间各细胞亚群的比较,但其结果差异无统计学意义。考虑种族间差异较小,也可能为样本量较小,未能突出差异。
有人检测到PD外周血的淋巴细胞多巴胺受体表达增加,经美多巴或溴隐亭治疗后可减少。受体密度的增高可能代表了由多巴胺能系统弥漫性损害所产生的上调机制,是中枢多巴胺能缺陷的一种代偿机制。本文研究不同药物对PD患者T淋巴细胞亚群、B细胞、NK细胞的影响,发现服用与未服用药物的PD患者比较,各细胞亚群并无显著差异。但本研究未作长期不同时间间隔的观察,考虑药物的治疗效果,故此结论尚需进一步论证。
PD作为一种神经退行性疾病,既往研究显示其与年龄、病程、严重程度有一定相关性。本研究中,我们对各细胞亚群与年龄、病程及严重程度进行了一定分析,只发现CD3与年龄,CD19与病程有一定相关性。
总之,细胞免疫功能及固有免疫异常与PD密切相关,但其为PD的始动因素或继发因素仍需进一步观察。其确切机制仍有待深入研究。
[1] Olanow CW,Tatton WG. Etiology and pathogenesis of Parkinson’s disease[J]. Annu Rev Neurosci,1999,22: 123-144.
[2] Pradhan S,Andreasson K. Commentary:progressive inflammation as a contributing factor to early development of Parkinson’s disease[J]. Exp Neurol,2013,241: 148-155.
[3] Benner EJ,Banerjee R,Reynolds AD,etal. Nitrated alpha-synuclein immunity accelerates degeneration of nigral dopaminergic neurons[J]. PLoS One,2008,3(1): e1376.
[4] Brochard V,Combadiere B,Prigent A,etal. Infiltration of CD4+lymphocytes into the brain contributes to neurodegeneration in a mouse model of Parkinson disease[J]. J Clin Invest,2009,119(1): 182-192.
[5] Bialecka M,Klodowskaduda G,Kurzawski M,etal. Interleukin-10 gene polymorphism in Parkinson's disease patients[J]. Arch Med Res,2007,38(8): 858-863.
[6] Hoehn MM,Yahr MD. Parkinsonism: onset,progression and mortality[J]. Neurology,1967,17(5): 427-442.
[7] Roy A,Mondal S,Kordower JH,etal. Attenuation of microglial RANTES by NEMO-binding domain peptide inhibits the infiltration of CD8(+) T cells in the nigra of hemiparkinsonian monkey[J]. Neuroscience,2015,302: 36-46.
[8] Dasgupta S,Jana M,Liu X,etal. Role of very-late antigen-4 (VLA-4) in myelin basic protein-primed T cell contact-induced expression of proinflammatory cytokines in microglial cells[J]. J Biol Chem,2003,278(25): 22424-22431.
[9] Field R,Campion S,Warren C,etal. Systemic challenge with the TLR3 agonist poly I:C induces amplified IFNα/β and IL-1β responses in the diseased brain and exacerbates chronic neurodegeneration[J]. Brain Behav Immunity,2010,24(6): 996-1007.
[10] Lee JK,Chung J,McAlpine FE,etal. Regulator of G-protein signaling-10 negatively regulates NF-kappaB in microglia and neuroprotects dopaminergic neurons in hemiparkinsonian rats[J]. J Neurosci,2011,31(33): 11879-11888.
[11] Khasnavis S,Roy A,Ghosh S,etal. Protection of dopaminergic neurons in a mouse model of Parkinson’s disease by a physically-modified saline containing charge-stabilized nanobubbles[J]. J Neuroimmune Pharmacol,2014,9(2): 218-232.
[12] Zhang W,Phillips K,Wielgus AR,etal. Neuromelanin activates microglia and induces degeneration of dopaminergic neurons: implications for progression of Parkinson’s disease[J]. Neurotox Res,2011,19(1): 63-72.
[13] Roy A,Fung YK,Liu X,etal. Up-regulation of microglial CD11b expression by nitric oxide[J]. J Biol Chem,2006,281(21): 14971-14980.
[14] Roy A,Jana A,Yatish K,etal. Reactive o0ygen species up-regulate CD11b in microglia via nitric oxide: Implications for neurodegenerative diseases[J]. Free Radic Biol Med,2008,45(5): 686-699.
[15] Foulds PG,Mitchell JD,Parker A,etal. Phosphorylated alpha-synuclein can be detected in blood plasma and is potentially a useful biomarker for Parkinson's disease[J]. FASEB J,2011,25(12): 4127-4137.
[16] Stevens CH,Rowe D,Morel-Kopp MC,etal. Reduced T helper and B lymphocytes in Parkinson's disease[J]. J Neuroimmunol,2012,252(1-2): 95-99.
[17] Hisanaga K,Asagi M,Itoyama Y,etal. Increase in peripheral CD4 bright+CD8 dull+T cells in Parkinson disease[J]. Arch Neurol,2001,58(10): 1580-1583.
[18] Gruden MA,Sewell RD,Yanamandra K,etal. Immunoprotection against toxic biomarkers is retained during Parkinson's disease progression[J]. J Neuroimmunol,2011,233(1-2): 221-227.
[19] Niwa F,Kuriyama N,Nakagawa M,etal. Effects of peripheral lymphocyte subpopulations and the clinical correlation with Parkinson's disease[J]. Geriatr Gerontol Int,2012,12(1): 102-107.
[20] Chiba S,Matsumoto H,Saitoh M,etal. A correlation study between serum adenosine deaminase activities and peripheral lymphocyte subsets in Parkinson's disease[J]. J Neurol Sci,1995,132(2): 170-173.
[21] Saunders JA,Estes KA,Kosloski LM,etal. CD4+regulatory and effector/memory T cell subsets profile motor dysfunction in Parkinson's disease[J]. J Neuroimmune Pharmacol,2012,7(4): 927-938.
[22] Baba Y,Kuroiwa A,Uitti RJ,etal. Alterations of T-lymphocyte populations in Parkinson disease[J]. Parkinsonism Relat Disord,2005,11(8): 493-498.
[23] 雷革胜,苗建亭. 帕金森病患者外周血T淋巴细胞亚群及红细胞免疫研究[J]. 中国神经免疫学和神经病学杂志,2001,8(2): 95-97.
[24] 陈女燕,蒋雨平,朱萍. 帕金森病外周血T细胞亚群的研究[J]. 中国临床神经科学,2004,12(4): 377-380.
[25] 齐进兴,邓建中,屈宝华. 帕金森病患者T淋巴细胞亚群、TNF、IL-2水平研究[J]. 中国神经免疫学和神经病学杂志,2004,11(4): 243-243.
[26] 赵旭. 帕金森病患者T淋巴细胞亚群与疾病相关性的分析. 辽宁: 中国医科大学,2013:1-24.
[27] 李理. 外周血CD4+T细胞平衡与帕金森病的相关性研究[D].蚌埠:蚌埠医学院,2015:1-32.
[28] 高苹,钱传忠,刘向远,等. 帕金森病患者T淋巴细胞亚群及NK细胞的临床研究[J]. 实用临床医药杂志,2005,9(5):52-54.
[29] 张思韵,孙丛丛,张丽敏,等. 帕金森病患者外周血淋巴细胞亚群的变化规律[J]. 中华医学杂志,2014,(47): 3726-3730.
[30] 余能伟,刘洁,李晓佳,等. 帕金森病患者外周血T淋巴细胞亚群检测及临床意义[J]. 四川医学,2012,33(8): 1465-1468.
[31] 谭峰,顾卫,黄涛,等. 帕金森病患者NK细胞亚群及T淋巴细胞亚群变化的临床意义[J]. 中国免疫学杂志,2003,19(2): 138-140.
[32] 李凤舞,张佩兰,曹传海,等. 帕金森病患者T淋巴细胞亚群的检测及意义[J]. 天津医科大学学报,2012,18(2): 208-211.
[33] 郝娟,于顺,陈彪,等. 帕金森病患者外周血纯真、记忆和调节T细胞亚群分析[J]. 中国神经免疫学和神经病学杂志,2014,21(3): 196-198.
[34] Barbanti P,Fabbrini G,Ricci A,etal. Increased expression of dopamine receptors on lymphocytes in Parkinson’s disease[J]. Movement Disord,1999,14(5): 764-771.
[35] 刘宇庆,关淑风. 新疆地区维、汉族帕金森病患者运动症状和非运动症状的特点[J]. 临床神经病学杂志,2014,27(2):88-90.
[36] 张晓莺,刘燕,王洵,等.新疆地区汉族、维族帕金森病危险因素分析[J].中风与神经疾病,2012,29(12):1117-1120.
Correlation between lymphocyte subsets or natural killer cells and Parkinson’s disease in Uygur and Han population
JIANG Sen1,WANG Pengfei1,GAO Hua2,YANG Xinling3*
(1DepartmentofNeurology,FirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China;2DepartmentofNeurology,FifthAffiliatedHospitalofXinjiangMedicalUniversity;3SecondAffiliatedHospital,XijiangMedicalUniversity;*Correspondingauthor,E-mail:yangxinling2014@163.com)
ObjectiveTo investigate the variation and clinical significance of lymphocyte subsets and natural killer(NK) cells in Parkinson’s disease(PD).MethodsFlow cytometry was used to measure the numbers of T lymphocytes,B lymphocytes and NK cells in the peripheral blood of 33 Han and Uygur PD patients. And 20 healthy controls were chosen. The difference of lymphocyte subsets was compared between three groups. The correlation of disease duration,severity and HY grades with lymphocyte subsets was analyzed.ResultsCompared with healthy controls,the numbers of CD3+,CD4+,CD8+significantly decreased in PD patients(P<0.05),while the level of CD19+had no statistical change(P>0.05),and the level of CD56+increased significantly(P<0.05). There was no significant difference in the numbers of lymphocyte subsets and NK cells between Uygur patients and Han patients(P>0.05). No signifiant differences of lymphocyte subsets and NK cells were observed between the patients who accepted madopar or sifrol or not (P>0.05). There was a significant linear correlation between age and CD3+subsets,between disease duration and CD19+subsets(P<0.05).ConclusionLymphocyte subsets and NK cells change in the peripheral blood of PD patients,which demonstrates the immune disorders in the pathogenesis of PD. The changes of lymphocytes and NK cells may help assess the severity of PD.
Parkinson’s disease; T lymphocytes; B lymphocytes; NK cells; flow cytometry
国家自然科学基金资助项目(U1503222)
蒋森,男,1986-11生,硕士,住院医师,E-mail:abruzzibruce@163.com
2017-01-23
R745
A
1007-6611(2017)06-0550-05
10.13753/j.issn.1007-6611.2017.06.009

