培养条件对黑曲霉脂肪酶选择性合成1,3甘油二酯的影响
张富豪,李兰香,何腊平,2*,高冰,李翠芹,陈翠翠
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;3.湖北工业大学生物工程与食品学院,湖北武汉430068;4.贵州大学化学与化工学院,贵州贵阳550025)
培养条件对黑曲霉脂肪酶选择性合成1,3甘油二酯的影响
张富豪1,李兰香1,何腊平1,2*,高冰3,李翠芹4,陈翠翠1
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;3.湖北工业大学生物工程与食品学院,湖北武汉430068;4.贵州大学化学与化工学院,贵州贵阳550025)
从前期筛菌工作中得到的一株能高选择性合成1,3-甘油二酯(1,3-DAG)的产胞内脂肪酶的黑曲霉GZUF36菌株出发,分别研究了培养时间、温度、接种量、装液量和转速对该菌摇瓶发酵的影响,得出合适的培养条件为培养时间72 h,接种量3%,装液量40 mL/250 mL,培养温度28℃,转速180 r/min,在此条件下1,3-DAG的得率和选择性分别为23.87%和82.96%。同时也比较了摇瓶发酵和5 L发酵罐发酵的异同,相比于摇瓶发酵,5 L发酵罐发酵的1,3-DAG的得率有所提高,但是发酵罐发酵的时间有所延长。
1,3-甘油二酯;脂肪酶;发酵条件;摇瓶;发酵罐
肥胖已经成为全球性的、严重的社会公共卫生问题,全球有3亿人患有严重肥胖症。肥胖可以引发多种疾病,如高血压、冠心病、脑血管疾病等。引起肥胖的一个主要原因是摄入油脂过多,但是油脂也是不可或缺的重要营养素之一。甘油三酯(triglyceride,TAG)和甘油二酯(diacylglycerol,DAG)是食用油脂中的天然成分,其中甘油二酯存在三种同分异构体:1,2-DAG、2,3-DAG和1,3-DAG[1]。TAG、1,2-DAG、2,3-DAG在人体中不能彻底转换为能量并在体内重新合成油脂而积累,从而引起肥胖。而1,3-DAG能在体内分解成不能重新合成脂肪的1-单酰基甘油酯,通过β氧化以能量的形式释放,不会在体内积累[2],并且1,3-DAG和传统的油脂在口感、色泽、风味都没有差异,同时动物和人体实验都发现,富含1,3-DAG食用油能减少肥胖的发生[3-4],所以1,3-DAG被公认为新一代的健康油脂。
天然油脂中1,3-DAG的含量很低,目前主要采用化学法和生物酶法来合成。由于化学法对环境破坏较大,所以生物酶法备受关注。脂肪酶是1,3-DAG酶法制备中常用的一种催化剂,1,3-DAG的脂肪酶法制备包括酯合成、甘油解、转酯化法、甘油三酯水解四种[5],其中甘油解法相比于其他方法,具有反应中无净水产生、成本低、反应条件易控制的优点,但是需要有1,3-选择性的脂肪酶催化[6]。脂肪酶对于三酰甘油特定位置的脂肪酸优先水解,主要是1位和3位,因此被称为Sn-1,3位专一性脂肪酶,而具有1,3-选择性的脂肪酶不多,产该脂肪酶的菌株更为稀少。本课题组在前期筛菌过程中得到了一株通过甘油解反应高选择性合成1,3-DAG的产胞内脂肪酶的菌株黑曲霉GZUF36[7],其产的胞内脂肪酶被用作全细胞脂肪酶,可以节省纯化工艺降低成本。由于培养环境条件会对产酶具有重要影响[8-10],因此本实验对该菌株生长的培养环境条件进行了探索,以确定合适的条件来提高该菌株全细胞脂肪酶高选择性合成1,3-DAG的能力,同时将摇瓶发酵扩大到5 L发酵罐发酵培养,以此来获得大量脂肪酶供后续研究做铺垫。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
本课题组在富含油脂的土壤中筛选得到的一株黑曲霉(Aspergillus niger)GZUF36菌株,该菌株能通过甘油解反应高选择性合成1,3-DAG,由中国典型培养物保藏中心鉴定并保藏,保藏编号为CCTCC No.M2012538。
1.1.2 培养基
种子培养基:葡萄糖0.5%,蛋白胨0.5%,牛肉膏0.3%,NaCl 0.5%,水100 mL,pH 7.0,121℃灭菌20 min。
发酵培养基:葡萄糖0.96%,豆饼粉1.93%,氯化钾0.048%,硫酸锌0.044%,氯化钙0.044%,磷酸氢二钠0.044%,磷酸氢二钾0.044%,水100 mL,pH 7.0,121℃灭菌20 min。
1.1.3 试剂
橄榄油(生物试剂):国药集团化学试剂有限公司;三油酸甘油酯(分析纯):美国Sigma-Aldrich公司;叔丁醇、异丙醇、乙腈(色谱纯):北京百灵威科技有限公司;其他试剂均为国产分析纯或化学纯。
1.2 仪器与设备
FD-1A-50冷冻干燥机:北京博医康实验仪器有限公司;SW-CJ-2D超净工作台:上海苏净实业有限公司;Agilent1260高效液相色谱仪:安捷伦科技(中国)有限公司;GBJS-5LS发酵罐:上海百伦生物科技有限公司。
1.3 方法
1.3.1 全细胞脂肪酶制备
挑取保藏于试管斜面中的黑曲霉两环接种到种子培养基中,在30℃、180 r/min的摇床中振荡培养24 h,吸取3%种子培养基液体接种到发酵培养基中,在30℃,180 r/min的摇床中振荡培养72 h。用干净的纱布过滤得到菌体,用无菌水冲洗菌体3遍以除去菌体表面上的发酵液,之后在冷冻干燥机中冻干并在液氮的保护下碾磨成酶粉,即为全细胞脂肪酶酶粉,并于4℃保藏备用。
1.3.2 反应体系条件
甘油解反应体系为有机溶剂体系,有机溶剂由正己烷和叔丁醇组成,两者的体积比为49∶1;反应底物为甘油和甘油三酯,两者的摩尔比为1∶2,其中,甘油三酯的浓度为0.01mol/L;酶粉添加量为0.2g;于50mL锥形瓶中反应,反应条件为30℃,180 r/min条件下反应12 h,反应完成后取1 mL反应液经过膜过滤进入高效液相色谱检测1,3-DAG的含量。
1.3.3 高效液相色谱检测条件
采用Agilent 1206高效液相色谱仪,流动相为乙腈和异丙醇,WatersC18反相色谱柱(4μm,3.9mm×150mm)。检测条件为:0min时,乙腈:异丙醇=80∶20(V/V);27min时,乙腈∶异丙醇=40∶60(V/V);进样量为10 μL;流速为0.6 mL/min;柱温为30℃[7]。
1.3.4 培养环境条件对黑曲霉GZUF36产胞内脂肪酶的影响
(1)培养时间
固定发酵培养基的接种量3%、装液量50 mL/250 mL,培养温度30℃、培养转速180 r/min,研究不同的培养时间(24 h、48 h、72 h、96 h和120 h)对黑曲霉发酵所产的脂肪酶参与甘油反应中1,3-DAG的得率和选择性的影响。
(2)接种量
在上述合适的培养时间条件下,固定装液量50 mL/ 250 mL,培养温度30℃、培养转速180 r/min,研究不同的接种量(1%、2%、3%、4%、5%和6%)对黑曲霉发酵所产的脂肪酶参与甘油反应中1,3-DAG的得率和选择性的影响。
(3)装液量
在上述合适的培养时间和接种量条件下,固定培养温度30℃、培养转速180r/min,研究不同的装液量(30mL/250mL、40mL/250mL、50mL/250mL、60mL/250mL、70mL/250mL、80 mL/250 mL和90 mL/250 mL)对黑曲霉发酵所产的脂肪酶参与甘油反应中1,3-DAG的得率和选择性的影响。
(4)培养温度
在上述合适的培养时间、接种量和装液量条件下,固定摇床转速180 r/min,考察不同的培养温度(26℃、28℃、30℃、32℃和34℃)对黑曲霉发酵所产的脂肪酶参与甘油反应中1,3-DAG的得率和选择性的影响。
(5)摇瓶转速
在上述合适的培养时间、接种量、装液量、培养温度条件下,变化培养转速,其他条件一致,研究不同的培养转速(140 r/min、160 r/min、180 r/min、200 r/min和220 r/min)对黑曲霉发酵所产的脂肪酶参与甘油反应中1,3-DAG的得率和选择性的影响。
1.3.5 5L发酵罐扩大实验
根据摇瓶发酵培养条件的探索,黑曲霉GZUF36在发酵罐中的培养条件为接种量为3%,装液量为3.5 L/5.0 L,溶氧量为1.7%,搅拌转速为180 r/min,培养温度为28℃,用氨水和醋酸来调节发酵罐中的pH。每12h取一次样,取样量为50 mL,取样后注入相同体积的灭菌的新鲜培养基。样品经过纱布过滤得到菌体,冷冻干燥、液氮碾磨制成酶粉,加入甘油解反应体系中参与反应,用高效液相色谱检测1,3-DAG的含量。
1.3.6 数据计算
1,3-DAG选择性为甘油二酯产物中1,3-DAG所占的比例,也是脂肪酶1,3-位选择性强弱的直观表现。1,3-DAG的得率和选择性计算公式如下。

式中:1,2-DAG和1,3-DAG分别为1,2-甘油二酯、1,3-甘油二酯;TAG为三油酸甘油酯。
1.3.7 数据分析
所有实验均设置3个平行,所有实验组的数据均由3个平行数据的平均值求得,用SPSS 19.0版分析数据差异显著性,P<0.05时差异显著,用Origin 8.6对实验数据绘图。
2 结果与分析
2.1 培养时间对1,3-DAG的得率和选择性的影响
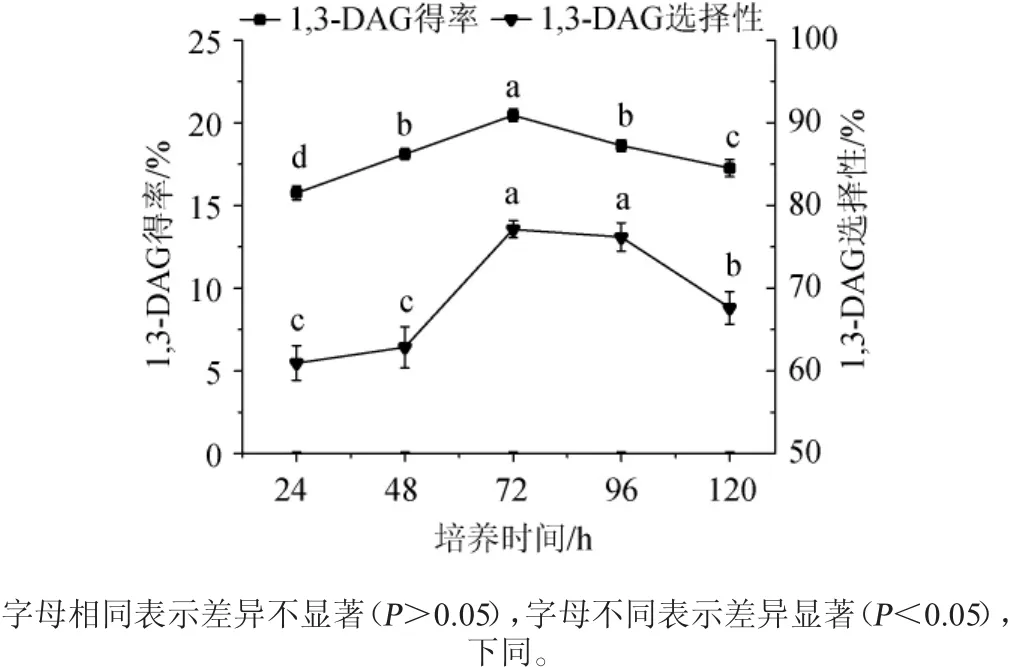
图1 培养时间对1,3-DAG得率和选择性的影响Fig.1 Effects of culture time on the yield and selectivity of 1,3-DAG
由图1可知,随着培养时间的增加,1,3-DAG的得率和选择性都呈现先上升后下降的趋势。当培养时间低于72 h时,1,3-DAG的得率和选择性都没达到峰值,这是由于此时微生物还处于大量繁殖阶段,该阶段微生物主要以分泌初级代谢产物为主;当培养时间为72 h时,微生物已经进入了稳定期,细胞代谢产物如脂肪酶大量生产[11],从而甘油解反应得到更多的1,3-DAG;但超过72 h后,1,3-DAG的得率和选择性都呈下降趋势,这是由于培养基中的营养物质大量消耗,微生物进入衰亡期从而产酶能力下降。当培养时间为72和96 h时,两者的1,3-DAG的选择性没有显著差异(P>0.05),但是1,3-DAG的得率却差异显著(P<0.05),且培养72 h的更高。所以较为合适的培养时间为72 h,在此条件下1,3-DAG的得率和选择性分别为20.45%和77.13%。
2.2 接种量对1,3-DAG的得率和选择性的影响
由图2可知,1,3-DAG的得率和选择性均随着接种量的增大呈现先增加后下降的趋势,在接种量为3%时达到最大值(P<0.05),此时1,3-DAG的得率和选择性分别为20.88%和76.63%。当接种量为1%~3%时,两个指标呈现增加的趋势,这是由于当接种量过低时,微生物的对数期过长,生物量增长缓慢,达到稳定产酶期的时间过长从而产酶量较低[11]。当接种量为3%时,此时菌体生物量和培养基中的营养物的配比较合理,能更快达到稳定产酶期,产酶效率增加[12]。当接种量>3%时,由于过大的接种量会极大的缩短微生物的发酵周期,菌体更容易衰亡,同时过多的接种量会带入过多的种子培养基中的有害物质从而导致微生物衰亡更快,产酶效率也越低[13],所以选择接种量为3%较为合适。

图2 接种量对1,3-DAG得率和选择性的影响Fig.2 Effects of inoculum on the yield and selectivity of 1,3-DAG
2.3 装液量对1,3-DAG的得率和选择性的影响
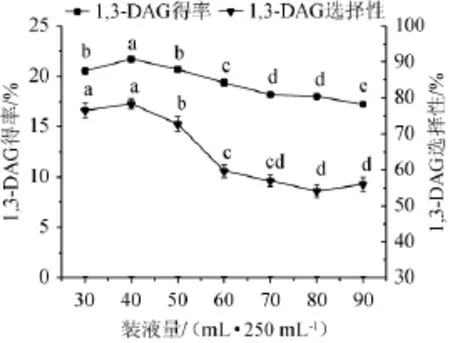
图3 装液量对1,3-DAG得率和选择性的影响Fig.3 Effects of liquid volume on the yield and selectivity of 1,3-DAG
由图3可知,随着装液量的增加1,3-DAG的得率和选择性先增加后下降。当装液量低于40 mL/250 mL时,由于装液量过低,会导致一次发酵生产的脂肪酶的量过低,即总酶活力会低,所以甘油解反应产物1,3-DAG的含量也偏低。当装液量高于40 mL/250 mL时,由于培养基量增大会导致溶氧量的下降,微生物生长和发酵得不到足够的氧,进而影响代谢途径,降低了产酶能力[8]。当装液量为30 mL/250 mL和40 mL/250 mL时,两者的1,3-DAG的选择性没有显著差异(P>0.05),但是1,3-DAG的得率却差异显著(P<0.05),且后者效果更好。所以选择装液量为40 mL/250 mL作为后续实验的条件,此条件下1,3-DAG的得率和选择性分别为21.72%和78.37%。
2.4 培养温度对1,3-DAG的得率和选择性的影响

图4 培养温度对1,3-DAG得率和选择性的影响Fig.4 Effects of culture temperature on the yield and selectivity of 1,3-DAG
由图4可知,随着温度的上升,1,3-DAG的得率和选择性先增加后快速下降。这是由于温度过低时,微生物生长缓慢,迟滞期和对数生长期时间过长,产酶效率低,所以培养温度为26℃条件下1,3-DAG的得率和选择性较低[14]。但是当温度高于28℃时,由于温度过高,微生物生长迅速容易老化,降低了酶产率。并且温度还会对诱导产酶的代谢机制产生影响,过低或者过高的温度都会降低脂肪酶的产量,甚至出现不能诱导产酶的情况发生[15]。所以选择培养温度为28℃作为后续实验条件(P<0.05),在该条件下1,3-DAG的得率和选择性均较优,分别为22.81%和82.83%。2.5培养转速对1,3-DAG的得率和选择性的影响

图5 培养转速对1,3-DAG得率和选择性的影响Fig.5 Effects of rotation speed on the yield and selectivity of 1,3-DAG
由图5可知,1,3-DAG的得率和选择性均呈现同步先增后减。当培养转速低于180r/min时,培养基中传氧受到了限制,微生物生长较慢,同时在发酵液表面也容易形成菌丝体膜阻碍微生物与氧的接触,从而导致脂肪酶产量偏低[16];但培养转速高于180 r/min时,过高的转速又会使微生物因为溶氧增多而大量繁殖较早形成菌丝球或菌丝团,由于菌丝球或菌丝团内部传质和传氧受到了一定的限制,从而阻碍了微生物的生长,进一步影响产酶[17]。因此当培养转速为180 r/min时效果较好(P<0.05),此时的1,3-DAG的得率和选择性分别为23.87%和82.96%。
2.6 5 L发酵罐的扩大试验
发酵罐试验有助于为后续的潜在工业化大规模发酵摸索合适的培养条件,同时也可以探讨摇瓶(小试)和5 L发酵罐(中试)的两种培养方式对GZUF36选择性的影响,为后续研究提供借鉴,结果见图6。
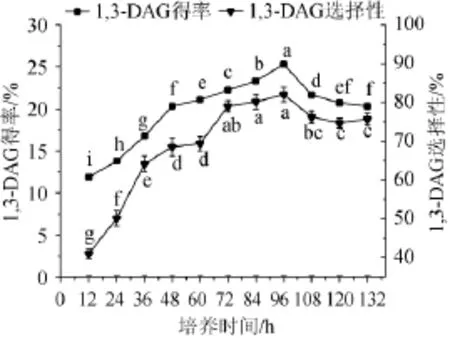
图6 发酵罐的扩大培养Fig.6 Enlarge cultivation of the fermentation tank
如图6所示,黑曲霉GZUF36在5 L发酵罐中培养时,在培养了96h时才呈现最大的脂肪酶活力,1,3-DAG的得率和选择性分别为25.30%,82.02%,而摇瓶发酵的培养时间则为72 h,1,3-DAG的得率和选择性分别为23.87%,82.96%。相比于摇瓶发酵培养,发酵罐发酵培养的最佳1,3-DAG的得率要高。这可能是因为摇瓶培养是一次投料,一次发酵的分批发酵方式,而发酵罐发酵采用补料分批发酵方式,这可以延长发酵周期,添加的新鲜培养基有利于微生物的产酶和生长[18]。同时由于机械搅拌式发酵罐的搅拌会改变丝状真菌发酵液的流动特性,影响菌体的聚集形态[19],因此相比于摇瓶发酵,其产酶能力也有所改变。
3 结论
通过试验研究了培养时间、接种量、装液量、培养温度和转速对黑曲霉GZUF36菌株产的全细胞脂肪酶高选择性合成1,3-DAG能力的影响。得出合适的摇瓶培养条件为培养时间72 h,接种量3%,装液量40 mL/250 mL,培养温度28℃,培养转速180 r/min,在此条件下得到的1,3-DAG的得率和选择性,分别为23.87%和82.96%。
该研究还比较了摇瓶发酵和5 L发酵罐发酵对培养效果的影响,研究发现当黑曲霉GZUF36在5 L发酵罐的培养时间为96 h时,1,3-DAG的得率和选择性达到最大,分别为25.30%、82.02%。相比于摇瓶发酵,5 L发酵罐发酵的结果有所提高,但是发酵罐发酵的时间有所延长,这可能是因为摇瓶培养和发酵罐培养的方式不同导致的,但是发酵罐发酵培养的条件在后续研究中需进一步探索,为后续的潜在工业化应用进一步摸索合适条件。
[1]MORITA O,SONI M G.Safety assessment of diacylglycerol oil as an edible oil:a review of the published literature[J].Food Chem Toxicol, 2009,47(1):9-21.
[2]王卫飞.酶法甘油解合成甘油二酯工艺的研究[D].广州:华南理工大学,2012.
[3]TAEKIL E,KONG CS,HEEGUK B,et al.Lipase catalytic synthesis of diacylglycerol from tuna oil and its anti-obesity effect in C57BL/6J mice. [J].Process Biochem,2010,45(5):738-743.
[4]董攀.脂肪酶水解法制备1,3-甘油二酯及脂肪酶的固定化研究[D].南昌:南昌大学,2013.
[5]何腊平,李兰香,周换景,等.1,3-甘油二酯的制备研究进展[J].食品研究与开发,2013,34(15):113-116.
[6]FREGOLENTE P B L,FREGOLENTE L V,PINTO G M F,et al.Monoglycerides and diglycerides synthesis in a solvent-free system by lipasecatalyzed glycerolysis[J].Appl Biochem Biotechnol,2008,146(1):165-172.
[7]ZHOU H J,HE L P,WANG H,et al.Screening intracellular lipase-producing microbial with selective synthesis of 1,3-diolein[J].J Pure Appl Microbiol,2014,8(3):1853-1856.
[8]LIU WH,BEPPU T,ARIMA K.Cultural conditions and some properties of the lipase of S-38[J].Agr Biol Chem,2014,36(11):1919-1924.
[9]刘金辉,李晓路,姜岩,等.施氏假单胞菌PS59产脂肪酶发酵条件及脂肪酶洗涤性能优化[J].生物技术通报,2016,32(7):186-193.
[10]赵兴秀,赵长青,何义国,等.高产脂肪酶菌株的筛选及产酶条件研究[J].食品与机械,2016,32(3):16-19.
[11]恽丽红.Burkholderia manaSYBC LI-1产脂肪酶发酵条件优化及酶学性质研究[D].无锡:江南大学,2008.
[12]REN X,PAN D,ZENG X,et al.Optimization of culture conditions and fermentation conditions for cell wall proteinase(CEP)production by Lactobacillus acidophilus[J].J Chinese Inst Food Sci Technol,2014, 14(2):146-153.
[13]胡珺,杜新凯,王常高,等.产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2016,35(11):39-43.
[14]王栋.华根霉(Rhizopus chinensis)非水相合成活性脂肪酶及其酶学特性的研究[D].无锡:江南大学,2008.
[15]李燕.根霉ZM-10脂肪酶发酵条件及酶学性质研究[D].泰安:山东农业大学,2007.
[16]颜兴和.提高华根霉(Rhizopus chinensis)脂肪酶酶促催化酯合成能力的研究[D].无锡:江南大学,2004.
[17]HE D,LUO W,WANG Z,et al.Combined use of GAP,and AOX1, promoters and optimization of culture conditions to enhance expression ofRhizomucor miehei,lipase[J].J Ind Microbiol Biot,2015,42(8): 1175-1182.
[18]PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnol Adv,2004,22(3):189-259.
[19]ZNIDARSIC P,KOMEL R,PAVKO A.Studies of a pelleted growth form ofRhizopus nigricans,as a biocatalyst for progesterone 11 α-hydroxylation[J].J Biotechnol,1998,60(3):207-216.
Effect of culture conditions on the synthesis of 1,3-DAG by the lipase fromAspergillus niger
ZHANG Fuhao1,LI Lanxiang1,HE Laping1,2*,GAO Bing3,LI Cuiqin4,CHEN Cuicui1
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Agricultural and Animal Products Store&Processing of Guizhou Province,Guizhou University,Guiyang 550025,China;3.College of Bioengineering and Food Science,Hubei University of Technology,Wuhan 430068,China;4.School of Chemistry and Chemical Engineering,Guizhou University, Guiyang 550025,China)
Aspergillus nigerGZUF36 with extracellular lipase-producing ability which can highly synthesize 1,3-diglyceride was screened from early screening work.The effects of incubation time,temperature,inoculum,liquid volume,and rotation speed on the shake-flask fermentation were studied.The suitable cultivate conditions were found as followed:incubation time 72 h,inoculum 3%,liquid volume 40 ml/250 ml,temperature 28℃, rotation speed 180 r/min.In this condition,the yield and selectivity rate of 1,3-DAG was 23.87%and 82.96%,respectively.The similarities and differences of shake-flask fermentation and 5 L fermentor fermentation were compared,and results showed that the yield of 1,3-DAG was improved by 5 L fermentor fermentation,but the fermentation time extended.
1,3-diglyceride;lipase;fermentation condition;shake-flask;fermentor
Q935
0254-5071(2017)07-0085-05
10.11882/j.issn.0254-5071.2017.07.019
2017-04-10
国家自然科学基金(21062004、31660010);贵州大学研究生创新基金(研理工2016059)
张富豪(1991-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:何腊平(1972-),男,教授,博士,研究方向为发酵工程、生物催化与生物转化。

