海洋生淀粉酶菌株发酵条件响应面优化
周新尚,逄飞,窦少华*,任楠楠,张庆芳
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622)
海洋生淀粉酶菌株发酵条件响应面优化
周新尚1,2,逄飞1,2,窦少华1,2*,任楠楠1,2,张庆芳1,2
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622)
生淀粉酶是催化淀粉直接水解的酶类,其可广泛应用于食品、工业、医学等领域。该研究首先利用单因素试验研究发酵时间、发酵温度,发酵初始pH、装液量、接种量对生淀粉酶活的影响,并在此基础上利用响应面法设计试验,优化了海洋生淀粉酶菌株ZXS-1的发酵条件。结果表明,其最佳发酵条件为发酵时间38 h,发酵温度25℃,初始pH 7。在此最佳发酵条件下,生淀粉酶酶活可达445.2 U/mL,较优化前提高25.6%。
生淀粉酶;发酵条件优化;响应面法
生淀粉酶是指对不经过蒸煮糊化的生淀粉颗粒能够表现出水解活性的酶类[1]。由于生淀粉酶能将未经蒸煮糊化的生淀粉直接转化成葡萄糖等可发酵性糖供微生物生长与代谢,其比传统的高温蒸煮糖化节约25%~30%的能耗。如果将其应用于无蒸煮的酒精发酵[2],可节约总能耗的30%~40%。也可以利用生淀粉酶酶解生淀粉生成多孔淀粉[3],正是由于生淀粉酶具有的潜在的工业应用价值和某些特殊用途,因此一直受到国内外许多研究人员的关注。日本三得利公司酶解未糊化的玉米淀粉发酵生产酒精;姚卫蓉等[4]利用生淀粉酶酶解生淀粉生成多孔淀粉,将其作为微胶囊、芯材、吸附剂等。目前,国内外研究大部分是基于陆地环境生淀粉酶菌株的筛选、酶的分离纯化及酶学性质研究[5-9],从海洋筛选生淀粉酶菌株少见于报道。若能充分研究并分析海洋生淀粉酶的性质,将为社会带来巨大的科研和经济效应。
本研究对大连黄海海泥中分离出一株生淀粉酶高产菌假单胞杆菌(Pseudomonassp.)ZXS-1,通过单因素试验和响应面设计试验优化其发酵条件[10-11],首先基于Plackett-Burman(P-B)试验设计找出重要影响因子,然后经Design-Expert.V8.0.6软件中响应面Box-Behnken试验设计对响应过程变量进行数学建模及分析,进一步优化响应因子,确定最优发酵条件[12-13],目的是提高生淀粉酶的活力,从而为该海洋生淀粉酶更深入研究及中试实验奠定基础。
1 材料与方法
1.1 材料与试剂
菌株ZXS-1:分离自大连黄海海泥;蛋白胨、酵母膏、葡萄糖、磷酸氢二钾、生玉米淀粉、牛肉膏、葡萄糖、氯化钠、硫酸亚铁、硫酸镁、琼脂粉:生物工程上海股份有限公司。所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
HZP-250全温振荡培养箱、DK-S26电热恒温水浴锅:上海精宏实验设备有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;DHG-9070电热恒温鼓风干燥箱:上海一恒科技有限公司;UV-2102C紫外可见分光光度计:龙尼柯仪器有限公司;LDZX-40BI立式压力蒸汽灭菌器:上海审安医疗器械厂;GRX-02A干热灭菌箱:上海森信实验仪器有限公司。
1.3 方法
1.3.1 培养基
种子培养基:蛋白胨12 g/L,酵母膏6 g/L,葡萄糖2 g/L,K2HPO42 g/L,pH 7.0。1×105Pa灭菌30 min。
发酵培养基:玉米淀粉12 g/L(160℃干热灭菌2 h),蛋白胨5 g/L,牛肉膏6 g/L,NaCl 15 g/L,FeSO4·7H2O 0.05 g/L,MgSO4·7H2O 0.1 g/L,pH 7.0;1×105Pa灭菌30 min。
1.3.2 培养方法
将斜面保藏菌种活化,将处于对数期菌种按2%的接种量转接至装液量为150 mL/500 mL的三角瓶中,于25℃、150 r/min条件下恒温振荡培养32 h。
1.3.3 生淀粉酶粗酶液制备
将上述于25℃、150 r/min条件下恒温振荡培养32 h的发酵液于4℃、8 000 r/min离心10 min,上清液即为粗酶液。
1.3.4 生淀粉酶酶活测定方法
生淀粉酶酶活测定参照OKOLO B N等[14]的方法。反应体系如下:2%的生淀粉溶液2.0 mL加入25 mL具塞比色管,添加pH6.4柠檬酸-柠檬酸钠缓冲液2mL,30℃预热10 min,加入1.0 mL酶液,于30℃恒温振荡(180 r/min)反应10 min后,加入3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)试剂2 mL终止反应;摇匀,置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL。以灭活的酶液管作为空白调零点,在波长520 nm处比色测定吸光度值。生淀粉酶酶活单位定义:在分析条件下,1 min释放1 μg的还原糖所需的酶量定义为1个酶活力单位(U/mL)。还原糖以葡萄糖为标准,采用DNS法进行测定[15]。
1.3.5 单因素试验
在发酵培养基一致的条件下,控制发酵时间分别为4h、12 h、18 h、24 h、30 h、36 h、42 h、48 h、54 h、66 h,发酵温度分别为4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃,培养基初始pH分别为3.0、4.0、5.0、5.4、6.0、6.4、7.0、8.0,装液量分别为75 mL/250 mL、100 mL/250 mL、125 mL/250 mL、150 mL/250 mL、175 mL/250 mL、200 mL/ 250mL,接种量分别为1%、2%、3%、4%、5%、6%,测定生淀粉酶活力,研究发酵时间、发酵温度、初始pH、装液量及接种量对菌株产生淀粉酶的影响[16]。
1.3.6 发酵条件响应面优化
在单因素试验的基础上,以生淀粉酶酶活(Y)为响应值,选取对其影响显著的因素以及因素较好的水平区间,根据Box-Behnken中心组合试验设计原理,采用响应面分析法对发酵参数进行优化,获得最优发酵条件组成。每组试验重复3次,结果取其平均值。
2 结果与分析
2.1 单因素试验
2.1.1 发酵时间对产酶的影响

图1 发酵时间对酶活的影响Fig.1 Effect of fermentation time on enzyme activity
由图1可知,发酵时间在0~24 h时,生淀粉酶活快速增加;发酵时间在36 h时,酶活达到最大,为449 U/mL;发酵时间>36h之后,生淀粉酶活有所下降。这可能与底物消耗和有害物质的积累产生的负面影响有关,所以选择36 h为最优发酵时间。
2.1.2 发酵温度对产酶的影响

图2 发酵温度对酶活的影响Fig.2 Effect of fermentation temperature on enzyme activity
由图2可知,发酵温度在5~15℃时,生淀粉酶的酶活随发酵温度的升高迅速增加;发酵温度在25℃时,其生淀粉酶酶活性最高,为442 U/mL;发酵温度>25℃之后,随着温度的增加酶活性开始下降,这主要是由于菌体在温度过高过低时都不利于其生长及产酶。因此选择发酵温度为25℃。
2.1.3 发酵初始pH对产酶的影响
由图3可知,在初始pH值3~5的酸性范围内,酶活性随初始pH值的增加而增加,但酶活性较低,可能是因为菌株本身不耐酸,也可能是在发酵过程中其自身也产生酸加剧的酸性环境导致不利于产酶和酶活性。初始pH值在5~7范围内,酶活性迅速增加;初始pH值为7时,酶活性达到最大,为437 U/mL;初始pH值>7之后,随初始pH的增加酶活降低。因此pH值为7是最优发酵初始pH。

图3 初始pH对酶活的影响Fig.3 Effect of initial pH on enzyme activity
2.1.4 装液量对产酶的影响

图4 装液量对酶活的影响Fig.4 Effect of loaded volume on enzyme activity
由图4可知,装液量为(75~125)mL/500mL时,生淀粉酶酶活随着装液量增加而增高;装液量为125mL/500mL时,发酵酶活最高,为425U/mL;装液量>125mL/500mL之后,通气量逐渐减少,生淀粉酶酶活呈下降趋势。因此选择装液量为125 mL/500 mL。
2.1.5 接种量对产酶的影响

图5 接种量对酶活的影响Fig.5 Effect of inoculum size on enzyme activity
由图5可知,接种量在接1%~2%的种子液时,酶活随接种量增加而较快地增加;当接种2%~4%种子液时,酶活增加速度相对减慢;当接种量达到4%时,酶活性最大,为424 U/mL;接种量>4%之后,随着接种量的增加,酶活缓慢开始下降,可能是因为通气量和底物等因素的限制,发酵液中的菌体数量不宜过多。因此确定4%为最佳发酵接种量。2.2 Plackett-Burman试验设计结果
响应面法优化发酵工艺是目前优化反应条件和加工工艺参数最常用的方法,而且在很多试验中取得了显著的效果[17-18]。在单因素试验的基础上,选用N=8的Plackett-Burman设计对生淀粉酶发酵条件中的5个因素的显著性进行考察,试验因素与水平见表1,设计及结果表2,利用Design-Expert V8.0.6软件进行主效应分析,结果见表3。由表3中的P值和贡献值可见,发酵温度、发酵时间、发酵初始pH对酶活贡献最大,其对酶活的贡献大小为发酵温度>发酵时间>发酵初始pH,而装液量和接种量对酶活贡献相对较小。因此选发酵温度、发酵时间、发酵初始pH为评价因素设计响应面优化试验。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experimental design

表2 Plackett-Burman试验结果Table 2 Results of Plackett-Burman experiments

表3 各因素主效应分析Table 3 Main effects analysis of each factor
2.3 最陡爬坡试验研究最大响应区域
在PB试验基础上,将发酵时间和温度的值按照步长依次增大,pH按照步长逐步减小进行最都爬坡试验设计,试验设计和结果见表4。

表4 最陡爬坡试验设计结果Table 4 Results of the steepest ascent experimental design
由表4可知,第2组试验,当发酵时间为36 h,发酵初始pH值为7,发酵温度为25℃时,酶活最大。所以选择以第2组试验作为中心组合试验的中心点,进行中心组合试验设计。
2.4 响应面设计分析结果
2.4.1 Box-Behnken试验设计

表5 Box-Behnken试验设计及结果Table 5 Design and results of Box-Behnken experiments
运用Design-Expert V8.0.6软件,以酶活(Y)为响应值,对X1发酵时间、X2pH和X3发酵温度这3个最显著因素进行3因素3水平的中心组合试验设计,设计结果与响应值见表5。
2.4.2 回归模型建立与方差分析
运用Design-Expert V8.0.6软件对中心组合试验数据(见表5)进行回归模型方差分析,结果见表6。对各因素进行二次多项式回归拟合后,得到回归方程:


表6 回归模型方差分析Table 6 Variance analysis of regression model
由表6可知,该回归模型的影响达到极显著水平(P<0.01),其自变量X1,X3,X2X3,X12,X22,X32对响应值影响显著(P<0.05),其他项影响均不显著(P>0.05)。失拟项表示所用模型与试验的拟合程度,该设计失拟项P值为0.460 8>0.05,因而无失拟因素存在。回归方程的决定系数R2= 0.989 7>0.9,校正决定系数R2(Adj)为0.971 2>0.9,表明响应值变化有98.97%来源于所选变量,说明模型拟合度较好,该回归方程可用于代替试验真实点对试验结果进行初步分析和预测。
2.5 响应面最优结果分析
为了进一步研究相关变量间的交换作用以及确定最优点,通过Design-Expert V8.0.6软件绘制响应面曲线图进行可视化分析,结果见图6。3组以生淀粉酶酶活为响应值的趋势图,其等高线图可直观反应出两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形与之相反。图6A,图6B等高线均呈椭圆形,表明两因素交互作用均显著,图6C等高线接近圆形,交互作用不显著;并且发酵时间与发酵温度,发酵时间与pH的交互作用最强。
由图6可知,响应值存在最大值,经软件分析获得酶活预测值最大时对应的发酵条件为:发酵时间37.9 h,发酵温度25.2℃,pH 7.1,软件分析预测最大酶活为450.4U/mL。为方便实际操作,修改最佳发酵条件为发酵时间38h,发酵温度25℃,pH7,重复3次验证试验,平均酶活为445.2U/mL,与理论值符合良好,表明采用响应面法优化得到的最佳条件准确可靠。
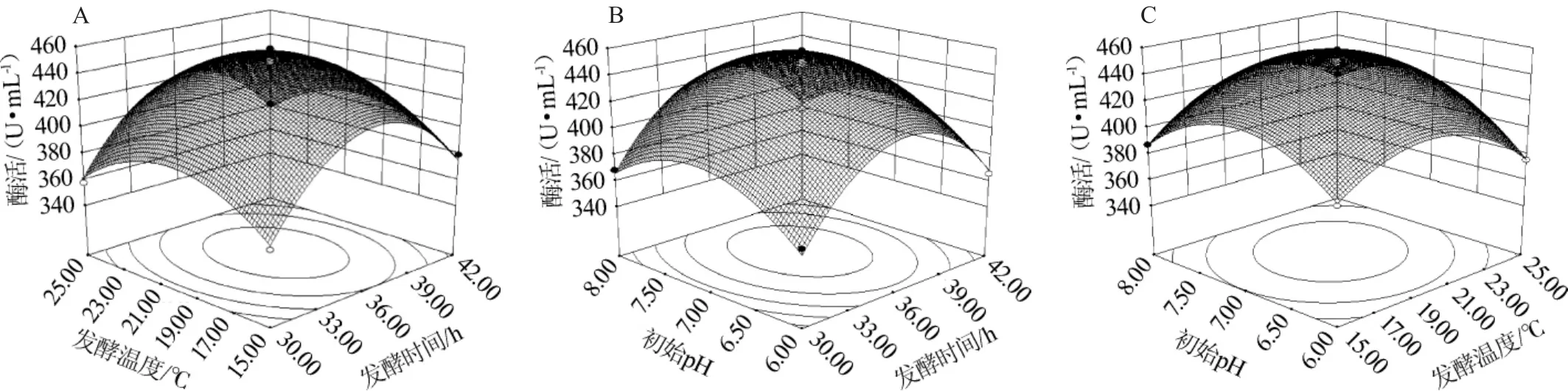
图6 发酵时间、初始pH与发酵温度交互作用对酶活的响应曲面及等高线Fig.1 Response surface plots and contour line of effects of interaction between fermentation time,initial pH and fermentation temperature
3 结论
以单因素试验为基础采用响应面法对生淀粉酶菌株ZXS-1发酵条件进行研究,得到最优发酵条件为发酵时间38h,发酵温度25℃,pH7。在此最佳发酵条件下,生淀粉酶酶活达到445.2 U/mL,比优化之前提高了25.6%。
假单胞杆菌(Pseudomonassp.)ZXS-1最适生长温度为25℃,根据MORITA R Y[19]对低温微生物的定义,该菌株属于耐冷菌,发酵粗酶液最适作用温度为25℃,属于低温酶。海洋环境低温、高盐、高压,菌株ZXS-1与其他国内外筛选的生淀粉酶的菌株相比[20],具有适应低温环境(25℃),耐盐性极好,耐高压等优良特征。海洋生淀粉酶对无蒸煮的酒精发酵和性质不稳定的多孔淀粉制备更具有优势。因此,对该菌株发酵条件的研究,可为其进一步发酵放大乃至工业化生产提供理论基础。
[1]谭海刚,李静.生淀粉酶细菌菌株的筛选及其酶学性质研究[J].粮油食品科技,2012,20(5):56-58.
[2]唐丹,黄茂,张子凤,等.酒精发酵无蒸煮工艺的研究现状[J].中国酿造,2012,31(9):17-20.
[3]李显,范小平,蒋卓,等.多孔淀粉的成孔技术及应用研究进展[J].食品工业科技,2016,37(12):354-360.
[4]姚卫蓉,姚惠源.复合淀粉酶酶解生淀粉机理探讨[J].工业微生物,2005,35(4):15-18.
[5]卢福芝,覃巧艳,黄燕红,等.生淀粉酶产生菌产酶条件与酶学性质的研究[J].饲料工业,2014(S1):109-113.
[6]曾丽娟,杨键,陈英,等.生淀粉酶生产菌株Paenibacillussp.的筛选和酶的纯化及酶学性质[J].生物加工过程,2010,8(4):62-66.
[7]马晓梅,赵辉.淀粉酶产生菌MSP13筛选及其产酶条件初步优化[J].食品科学,2015,36(11):177-181.
[8]刘波,曾丽萍,邬应龙.红曲霉固态发酵产生淀粉酶培养基的优化[J].食品科学,2014,35(7):181-186.
[9]MEHTA D,SATYANARAYANA T.Biochemical and molecular characterization of recombinant acidic and thermostable raw-starch hydrolysing α-amylase from an extreme thermophileGeobacillus thermoleovorans[J]. J Mol Catal B Enzym,2013,s85-86:229-238.
[10]李鑫,郝林,马玲.解淀粉芽孢杆菌HRH317抑菌物质发酵条件的优化[J].中国酿造,2017,36(2):25-29.
[11]李彧娜,石贵阳,王武,等.响应面法优化Rhizopus microsporusvar,chinensis产生淀粉酶的条件[J].食品工业科技,2010,31(11):184-186.
[12]陈炳,冷云伟,权武,等.响应面分析法优化玫瑰香葡萄醋发酵工艺的研究[J].中国酿造,2017,37(2):111-114.
[13]章晔敏,邵一凡,熊妍妍,等.响应面法优化鹿皮曲霉ZJOU-AC1产壳聚糖酶的发酵条件[J].中国酿造,2016,35(11):93-98
[14]OKOLOBN,EZEOGULI,MBACN.Productionofrawstarchdigesting amylase byAspergillus nigergrown on native starch sources[J].J Sci Food Agr,2006,69(1):109-115.
[15]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-429.
[16]袁慎亮,邢德明,窦少华,等.高产纤溶酶菌株CNY16发酵条件优化及其酶学特性初步研究[J].微生物学通报,2014,41(8):1621-1628.
[17]齐西珍,王利强,孟鹏,等.利用响应面法优化α-糖苷酶抑制剂发酵培养基[J].微生物学通报,2012,39(2):203-210.
[18]郑朋朋,李珊,戚丽蓉,等.山楂多糖的提取及其抗氧化作用[J].中国酿造,2015,34(6):107-113.
[19]MORITA R Y.Psychrophilic bacteria[J].Bacteriol Rev,1975,39(2): 144-167.
[20]XU Q S,YAN Y S,FENG J X.Efficient hydrolysis of raw starch and ethanol fermentation:a novel raw starch-digesting glucoamylase from Penicillium oxalicum[J].Biotechnol Biofuels,2016,9(1):216.
Optimization of fermentation conditions of marine raw starch amylase strains by response surface method
ZHOU Xinshang1,2,PANG Fei1,2,DOU Shaohua1,2*,REN Nannan1,2,ZHANG Qingfang1,2
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China; 2.Liaoning Technology of Marine Microbiological Engineering Research Center,Dalian 116622,China)
Raw starch amylase is an enzyme that catalyzes starch directly,which is widely used in food,industry,medicine and other fields.In this study,the effects of fermentation time,temperature,initial pH,loaded volume and inoculum on the activity of raw starch amylase were researched by single factor experiments.On the basis of this,the fermentation conditions of the marine raw starch amylase strain ZXS-1 were optimized by response surface method.The results showed that the optimum fermentation conditions were as follows:fermentation time 38 h,temperature 25℃and initial pH 7.Under the conditions,the activity of raw starch amylase was up to 445.2 U/ml,which was 25.6%higher than that of before the optimization.
raw starch amylase;optimization of fermentation conditions;response surface method
TQ920.6
0254-5071(2017)07-0080-05
10.11882/j.issn.0254-5071.2017.07.018
2016-12-23
国家高技术研究发展计划‘863计划’项目(No.2014AA093512);辽宁省自然科学基金项目(No.2014020134)
周新尚(1990-),男,硕士研究生,研究方向为微生物工程及酶工程。
*通讯作者:窦少华(1979-),男,副教授,博士,研究方向为微生物工程及酶工程。

