例析“电解质溶液”考点
张逸卓
(浙江省杭州高级中学高二2班,浙江 杭州 150080)
例析“电解质溶液”考点
张逸卓
(浙江省杭州高级中学高二2班,浙江 杭州 150080)
电解质溶液中存在的电离平衡和水解平衡,是高中化学重要的基础理论之一,是中学化学核心知识.因其综合性强,概念性强,核心性强,不仅和教材中的氧化还原反应、离子反应、化学平衡等可以综合应用,而且和日常生活、工农业生产、科学实验等内容联系密切,是高考必考的内容.
电解质溶液;电离平衡;水解平衡;高中化学
一、考查强、弱电解质的概念
例1 用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1、V2,则V1、V2的关系正确的是( ).
A.V1>V2B.V1 解析 HCl强酸,CH3COOH是弱酸,两者溶液pH=2时其c(CH3COOH)﹥c(HCl).而两者与NaOH反应的量相同,即c(CH3COOH)·V2=c(HCl)·V1,则有V1﹥V2. 选A. 例2 将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( ). A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大 C.醋酸电离平衡向左移动 D.溶液的pH增大 例3 将纯水加热至较高温度,下列叙述正确的是( ). A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性 C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性 解析 水的电离程度随温度升高而增大,其c(H+)和c(OH-)同步增大,但仍相等,所以仍呈中性,水的离子积kω=c(H+)·c(OH-)会增大,且pH因c(H+)增大而减少. 选D. 例5 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( ). A.Na2CO3NaHCO3NaCl NH4Cl B.Na2CO3NaHCO3NH4Cl NaCl C.(NH4)2SO4NH4Cl NaNO3Na2S D.NH4Cl (NH4)2SO4Na2S NaNO3 例6 1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( ). A.9.0 B.9.5 C.10.5 D.11.0 解析 酸碱恰好反应,则V(酸)·c(H+)=V(碱)·c(OH-)代入数据1×10-2.5=10×c(OH-),c(OH-)=1×10-3.5mol·L-1,其pH=14-3.5=10.5. 选C. 例7 下列溶液中各微粒的浓度关系不正确的是( ). A.0.1 mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) C.0.1 mol·L-1NaHCO3溶液中: D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>(OH-) [1]王磊,胡久华.高中新课程必修课教育学化学,[M].北京:北京大学出版社,2006. [责任编辑:季春阳] 2017-05-01 张逸卓(2000-),男,浙江杭州人,杭州高级中学钱江校区高二年级. G632 B 1008-0333(2017)16-0097-02二、考查电离平衡及移动
三、考查水的电离和溶液pH变化
四、考查电离常数
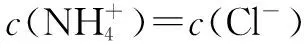
五、考查盐类水解和溶液的酸碱性、pH大小比较

六、考查pH的计算
七、考查溶液中微粒浓度的大小比较


