氟伐他汀对SAH患者sICAM-1、hs-CRP的影响研究
曹文锋, 吴凌峰, 潘 婕, 文 安, 吴晓牧,
氟伐他汀对SAH患者sICAM-1、hs-CRP的影响研究
曹文锋1, 吴凌峰1, 潘 婕1, 文 安2, 吴晓牧1,2
目的 研究氟伐他汀对蛛网膜下腔出血(SAH)患者血清细胞间黏附分子-1(sICAM-1)、高敏C反应蛋白(hs-CRP)的浓度变化的影响。方法 60例临床确诊的SAH患者随机分为氟伐他汀组和对照组,氟伐他汀组在常规治疗基础上加用氟伐他汀40 mg,每晚一次口服;对照组仅给予同样的常规治疗。于起病24 h、第3天、第7天、第14天分别检测两组患者sICAM-1、hs-CRP的含量。两组以SAH病程第14天末或者死亡为本研究终点。采用SPSS 15.0统计软件进行统计学分析,数据以均数±标准差表示,组间比较进行卡方或秩和检验,以P<0.05作为差异显著性指标。结果 氟伐他汀组患者sICAM-1水平呈逐渐降低趋势,而对照组第3天、第7天的sICAM-1水平均呈较前次升高,直至第14天出现降低。氟伐他汀组第3天、第7天、第14天测得的sICAM-1水平均显著低于对照组(P<0.05)。氟伐他汀组血清hs-CRP水平呈逐渐降低趋势,第7天和第14天测得的血清hs-CRP水平均显著低于对照组患者(P<0.05)。结论 氟伐他汀能有效降低SAH患者血清ICAM-1和hs-CRP的含量水平。
蛛网膜下腔出血; sICAM-1; hs-CRP; 氟伐他汀
脑卒中是我国第一位致死原因,蛛网膜下腔出血(subarachnoid hemorrhage,SAH)约占急性脑卒中的10%,发病率约为2~20/(10万人·年)。脑血管痉挛(cerebral vasospasm,CVS)是SAH最常见的并发症之一,发生率高达16%~66%,约半数病例引起严重脑缺血或迟发性缺血性脑损害,出现神经功能障碍,是SAH患者致死和致残的重要原因[1],因此,CVS的发生机制及其防治成为热点研究内容。
近年来,随着国内外各项研究的深入,认为炎症反应、氧合血红蛋白、舒缩血管物质等可能参与了CVS的发生[2]。目前越来越多的研究显示SAH后伴随的炎症和免疫反应在CVS的发生机制中起着重要的作用。各种炎症因子参与了CVS发生,影响血管内皮功能及血管平滑肌的增殖。其中细胞间黏附分子-1(intercellular adhesion molecule,ICAM-1)为细胞粘附分子免疫球蛋白超家族中的一种单链跨膜糖蛋白,它可能为一种起关键作用的粘附分子,参与了痉挛血管壁炎症介导过程[3]。近年,Kubo等研究发现SAH患者迟发性CVS与sICAM-1和高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)显著有关[4]。Fountas等经血管造影证实的SAH后CVS患者中,观察到脑脊液和血清的CRP明显增高[5],SAH患者第14天 hs-CRP是迟发性脑血管痉挛的预测因子[6],进一步证实炎症因子参与了CVS的发生。
近几年研究显示他汀类药物对于SAH患者具有抗炎抗氧化及神经保护作用[7],关于氟伐他汀是否有降低SAH患者炎性指标,目前国内外相关报道较少。本研究选择具有亲脂性且易通过血脑屏障的氟伐他汀对SAH患者进行干预,观察氟伐他汀治疗对SAH患者的sICAM-1和hs-CRP水平变化情况,现报道如下。
1 资料与方法
1.1 临床资料
1.1.1 病例纳入和排除标准 纳入标准:经头部CT扫描或者行腰椎穿刺确诊为SAH者,非外伤所致。排除标准:1 m内有明确脑外伤史、血液系统疾病致凝血障碍、起病前1 m内口服他汀类药物者、行数字减影脑血管造影术(DSA)或头颈CTA或颈血管彩超提示存在部内外血管重度狭窄或者闭塞者。
1.1.2 一般资料 本研究共纳入患者60例。男22例,女38例,年龄31~78岁,平均58.0岁,从发病到入院时间4~21 h,平均10.6 h。以突发头痛起病54例,突发头痛伴意识障碍12例,恶心呕吐45例,头晕17例,癫痫发作8例,有单瘫或偏瘫6例,有多个肢体瘫痪2例。昏迷时间≤24 h 4例,昏迷在24 h~48 h 3例,超过1 w 1例,死亡1例。患者入院后进行NIHSS评分。
1.1.3 影像资料 对所有患者在入院6 h内完善头部CT扫描,发现51例为单纯蛛网膜下腔出血,4例蛛网膜下腔出血合并脑室出血,3例蛛网膜下腔出血合并脑内血肿,其余2例为腰穿证实蛛网膜下腔出血诊断;根据CT结果行Fisher分级。
1.1.4 入组前检查 患者入院后即刻进行凝血功能、血液常规、生化等项目检查,经头部CT或腰穿确诊为SAH后,当天即进行CTA或MRA、DSA检查,如果患者为“烟雾病”或严重部位内外血管狭窄或其它不符合入组标准时即排除,同时,如果患者SAH为颅内动脉瘤等病因需外科急诊开颅手术也不在入组范围。
1.2 研究分组 将60例SAH患者随机分为两组:(1)氟伐他汀组:在常规治疗(尼莫地平针0.02 mg/(kg·h)维持微量泵入14 d,脱水降颅压治疗,控制血压、血糖、抗纤溶、抑酸护胃、安静卧床、保持大便通畅等治疗)基础上加用氟伐他汀胶囊40 mg(40 mg/粒,北京诺华制药有限公司生产)每晚一次口服,共14 d;(2)对照组:给予氟伐他汀组同样的常规治疗,共14 d。两组以SAH病程第14天末或者死亡或出院无法随访者为本研究终点。
1.3 血液标本的采取和处理 患者起病24 h内、第3天、第7天、第14天抽取外周静脉血。采用酶联免疫吸附法(ELISA)检测患者sICAM-1水平和hs-CRP水平(试剂盒名称及规格:人可溶性细胞间粘附分子-1和人超敏反应C反应蛋白ELISA试剂盒,规格均为96T,产地美国,上海联硕生物科技有限公司提供)。
2 结 果
2.1 患者入组后基本情况 60例患者随机分配到氟伐他汀组和对照组,其中氟伐他汀组年龄为(57.67±8.45)岁,对照组为58.47±10.33岁,两组间年龄无明显差异(P=0.74)。两组患者入院时Hunt-Hess分级、Fisher分级经卡方检验,两组均无显著性差异(P>0.05)。在研究期间内,氟伐他汀组共有28例完成研究,有2例在第7天后自动出院。对照组中1例在第9天死亡,其余29例完成研究。氟伐他汀组中有8例、对照组中10例采取了介入治疗处理动脉瘤或血管畸形。两组均未进行开颅手术或脑室外引流术。氟伐他汀组有5例、对照组有6例进行了腰穿脑脊液置换术。
2.2 两组患者sICAM-1变化情况 通过ELISA方法对两组患者起病24 h内、起病第3天、第7天、第14天血清ICAM-1的水平进行了检测,统计所得平均值(见表1),变化趋势(见图1)。数据显示,氟伐他汀组患者sICAM-1水平呈逐渐降低趋势,而对照组第3天、第7天的sICAM-1水平均呈逐渐升高趋势,直至第14天出现降低。第3天、第7天、第14天测得的氟伐他汀治疗组患者sICAM-1水平均显著低于对照组患者(P<0.05)。
2.3 两组患者血清hs-CRP变化情况 对两组患者起病24 h内、第3天、第7天、第14天的血清hs-CRP水平进行了检测,统计所得平均值(见表2),变化趋势(见图2)。数据显示,氟伐他汀组患者血清hs-CRP水平呈逐渐降低趋势,而对照组第3天的血清hs-CRP水平较入院时升高,并于之后逐渐降低。第7天、第14天测得的氟伐他汀组患者血清hs-CRP水平均显著低于对照组患者(P<0.05)。

表1 氟伐他汀组和对照组患者sICAM-1变化情况
注:采用秩和检验,与对照组比较*P<0.05

表2 氟伐他汀组和对照组患者血清hs-CRP变化情况
注:采用秩和检验,与对照组比较*P<0.05
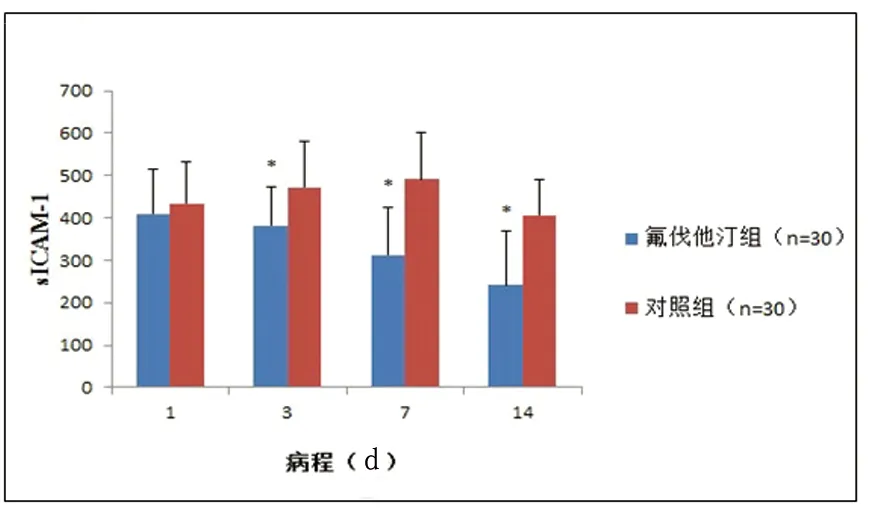
图1 患者血清ICAM-1水平变化情况*P<0.05
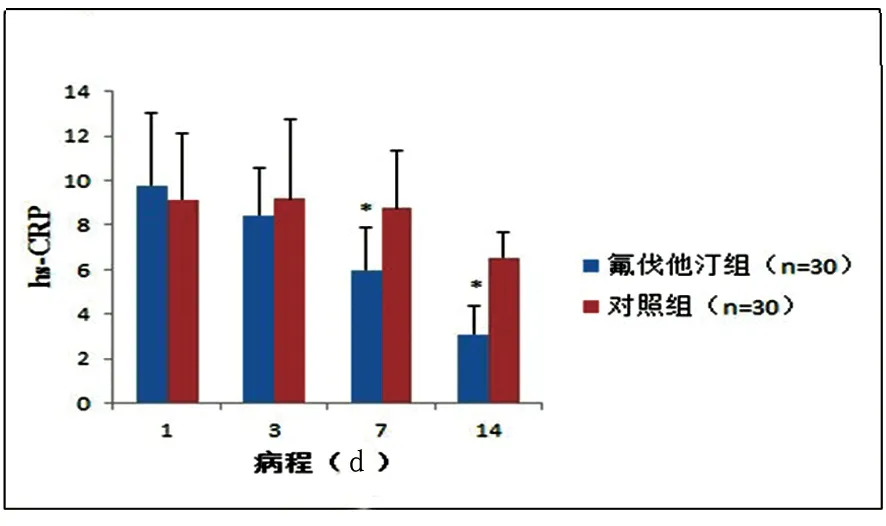
图2 患者血清hs-CRP水平变化情况*P<0.05
3 讨 论
SAH后CVS是最常见的并发症之一,其发生率高达16%~66%[1],是SAH患者致死和致残的重要原因。SAH后CVS的发生机制比较复杂,目前认为主要有以下几种机制:氧合血红蛋白、血管活性物质、炎性反应和炎性细胞因子、内皮细胞凋亡、微血栓形成在SAH后CVS中起到了重要的作用,其中sICAM-1和hs-CRP是炎性反应和炎性细胞因子中研究较多的因子[8~10]。研究表明,SAH后血液细胞崩解可触发免疫炎性介质的级联式释放反应,其裂解产物能启动免疫炎性反应,导致某些炎性细胞因子,如白介素(interleukin,IL)、hs-CRP、ICAM-1、肿瘤坏死因子(TNF)、单核细胞趋化因子(MCP-1)等水平升高[9,11]。多项研究证明免疫炎症反应及其释放的各种炎症细胞因子在SAH后发生CVS的病理机制中发挥重要作用[12]。作为炎症因子之一的ICAM-1,是细胞粘附分子免疫球蛋白超家族中的一种单链跨膜糖蛋白[13],其相对分子量大小约为76~114×103,主要通过与淋巴细胞功能相关抗原-1[即LFA-1 (CD11a/CD18)]以及补体受体-3(CR3),即Mac-1(CD11b/CD18)等相结合,从而介导白细胞与血管内皮细胞的粘附,并参与协助白细胞通过血管壁的过程[14]。已有研究证实,ICAM-1可能为一种关键作用的粘附分子,参与了痉挛血管壁炎症介导过程[15]。在SAH后迟发性脑缺血性神经功能损伤的一系列研究中,Rothoer等研究观察到脑脊液和血清ICAM-1增加与经颅多普勒(transcranial Doppler,TCD)测得血流速度增加相一致,但与CT扫描所见迟发损伤无关,他们认为炎症因子(ICAM-1)参与了SAH后CVS的病理过程[8]。近年,Kubo等研究发现SAH患者迟发性CVS与sICAM-1及hs-CRP显著有关[9]。Witkowska等研究显示早期检测SAH患者的sICAM-1水平可以作为一项预后的评价指标[16]。作为炎症反应发生敏感指标的C反应蛋白(C reactive protein,CRP),在SAH后CVS患者的脑脊液和血清中的含量均有升高,且发现其升高水平与预后有密切相关性[17]。Srinivasan等研究显示SAH患者白细胞反应性增多及hs-CRP水平增高与不良预后明显相关[18]。因此临床上可以通过检测sICAM及hsCRP来预测炎性反应的程度,对预后有一定的帮助[19]。同时通过一些治疗降低炎性指标或许对临床症状的改善起到较大的作用。最近荟萃分析显示他汀类药物能够降低动脉瘤性SAH血管痉挛的发生率,但不能降低迟发性缺血性神经损害及继发性脑梗死、死亡的发生率[20]。
本研究选用氟伐他汀作为治疗用药,结果表明氟伐他汀组患者sICAM-1水平呈逐渐降低趋势,而对照组第3天、第7天的sICAM-1水平均呈较前次升高,直至第14天出现降低。氟伐他汀组患者第3天、第7天、第14天测得的sICAM-1水平均显著低于对照组(P<0.05),提示氟伐他汀治疗可有效降低sICAM-1的含量水平。氟伐他汀组患者血清hs-CRP水平呈逐渐降低趋势,第7天和第14天测得的hs-CRP水平均显著低于对照组患者(P<0.05),提示氟伐他汀治疗可有效降低血清hs-CRP的含量水平。
氟伐他汀是一个全合成的降胆固醇药物,可竞争性抑制HMG-CoA还原酶,从而减少胆固醇的前体物质(3-甲基-3,5-二羟戊酸)的合成,达到降低胆固醇的目标。根据研究证实,目前常用的他汀脑脊液中的浓度分别为:辛伐他汀33%、氟伐他汀为28%、西立伐他汀为23.8%、洛伐他汀为10.8%、阿托伐他汀为4.9%[21]。他汀药物的疗效与药物浓度呈正相关,而氟伐他汀在脑脊液中的浓度达到28%,在炎性反应明显的患者中,由于血脑屏障的破坏,浓度可能更高,能满足治疗的需要。在以往研究中,辛伐他汀和阿托伐他汀用于SAH研究较多,氟伐他汀研究甚少,本研究为SAH的治疗提供一定的研究基础。
总之,本研究结果表明氟伐他汀可显著降低SAH患者sICAM-1和hs-CRP水平,但还需更大量样本研究支持;对患者神经功能的改善、CVS发生是否有预防作用还有待进一步研究。
[1]Tseng MY.Participants in the International Multidisciplinary Consensus Conference on the Critical Care Management of Subarachnoid Hemorrhage.Summary of evidence on immediate statins therapy following aneurysmal subarachnoid hemorrhage[J].Neurocrit Care,2011,15(2):298-301.
[2]Romero FR,Cataneo DC,Cataneo AJM.C-reactive protein and vasospasm after aneurysmal subarachnoid hemorrhage[J].Acta Cirargica Brasileira,2014,29(4):340-345.
[3]Raab M,Daxecker H,Markovic S,et al.Variation of adhesion molecule expression on human umbilical vein endothelial cells upon multiple cytokine application [J].Clin Chim Acta,2002,321(1-2):11-16.
[4]Kubo Y,Ogasawara K,Kakino S,et al.Serum inflammatory adhesion molecules and high- sensitivity C-reactive protein correlates with delayed ischemic neurologic deficits after subarachnoid hemorrhage[J].Surg Neurol,2008,69(6):592-596.
[5]Fountas KN,Tasiou A,Kapsalaki EZ,et al.Serum and cerebrospinal fluid C-reactive protein levels as predictors of vasospasm in aneurysmal subarachnoid hemorrhage[J].Clinical Article Neurosurg Focus,2009,26(5):E22.
[6]Badjatia N,Carpenter A,Fernandez L,et al.Relationship between C-reactive protein,systemic oxygen consumption,and delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage[J].Stroke,2011,42(9):2436-2442.
[7]Bhardwaj A.Statins as neuroprotectants after subarachnoid hemorrhage[J].Crit Care Med,2012,40(2):695-697.
[8]Rothoerl RD,Schebesch KM,Kubitza M,et al.ICAM-1 and VCAM-1 expression following aneurysmal subarachnoid hemorrhage and their possible role in the pathophysiology of subsequent ischemic deficits[J].Cerebrovasc Dis,2006,22(2-3):143-149.
[9]Kubo Y,Ogasawara K,Kakino S,et al.Serum inflammatory adhesion molecules and high-sensitivity C-reactive protein correlates with delayed ischemic neurologic deficits after subarachnoid hemorrhage[J].Surg Neurol,2008,69(6):592-596.
[10]Sasaki T,Kikkawa Y.Proposed mechanism of cerebral vasospasm: our hypothesis and current topics[J].Acta Neurochir Suppl,2013,115:53-56.
[11]Muroi C,Mink S,Seule M,et al.Monitoring of the inflammatory response after aneurysmal subarachnoid haemorrhage in the clinical setting: review of literature and report of preliminary clinical experience[J].Acta Neurochir Suppl,2011,110(1):191-196.
[12]Miller BA,Turan N,Chau M,et al.Inflammation,Vasospasm,and Brain Injury after Subarachnoid Hemorrhage[J].Biomed Res Int,2014,7:2-8.
[13]Rothlein R,Dustin ML,Marlin SD,et al.A human intercellular adhesion molecule (ICAM-1) distinct from LFA-1[J].J Immunol,1986,137(4):1270-1274.
[14]Marlin SD,Springer TA.Purified intercellular adhesion molecule-1 (ICAM-1) is a ligand for lymphocyte function-associated antigen 1 (LFA-1)[J].Cell,1987,51(5):813-819.
[15]Raab M,Daxecker H,Markovic S,et al.Variation of adhesion molecule expression on human umbilical vein endothelial cells upon multiple cytokine application[J].Clin Chim Acta,2002,321(1/2):11-16.
[16]Witkowska AM,Borawska MH,Socha K,et al.TNF-alpha and sICAM-1 in intracranial aneurismal rupture[J].Arch Immunol Ther Exp (Warsz),2009,57(2):137-140.
[17]Fountas KN,Tasiou A,Kapsalaki EZ,et al.Serum and cerebrospinal fluid C-reactive protein levels as predictors of vasospasm in aneurysmal subarachnoid hemorrhage.Clinical article[J].Neurosurg Focus,2009,26(5):E22.
[18]Srinivasan A,Aggarwal A,Gaudihalli S,et al.Impact of early leukocytosis and elevated high-sensitivity C-reactive protein on delayed cerebral ischemia and neurologic outcome after subarachnoid hemorrhage[J].World Neurosurg,2016,6(90):90-95.
[19]Juvela S,Kuhmonen J,Siironen J.C-reactive protein as predictor for poor outcome after aneurysmal subarachnoid haemorrhage[J].Acta Neurochir (Wien),2012,154(3):397-404.
[20]Shen J,Huang KY,Zhu Y,et al.Effect of statin treatment on vasospasm-related morbidity and functional outcome in patients with aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis[J].J Neurosurg,2016,10(7):1-11.
[21]Sierra S,Ramos MC,Molina P.Statins as neuroprotectants:a comparative in vitro study of lipophilicity,blood-brain-barrier penetration,lowering of brain cholesterol,and decrease of neuron cell death[J].J Alzheimer’s Dis,2011,23(9):307-318.
Effects of fluvastatin on sICAM-1、hs-CRP level in patients with subarachnoid hemorrhage
CAOWenfeng,WULingfeng,PANJie,etal.
(DepartmentofNeurology,JiangxiProvincialPeople’sHospital,Nanchang330006,China)
SAH; sICAM-1; hs-CRP; Fluvastatin
1003-2754(2017)06-0512-04
2017-04-03;
2017-05-25
(1.江西省人民医院神经内科,江西 南昌 330006;2.江西省神经病学研究所,江西 南昌 330006)
吴晓牧,E-mail:wuxm79@163.com
R743.35
A

