芍药苷上调慢性压迫性损伤大鼠脊髓背角和背根节内Sirt1表达
郑晖,杨柳英,郑文,2,张娟,郭小文,陶涛
(1.浙江中医药大学附属第一医院 麻醉科,浙江 杭州 310000;2.温州医科大学 第一临床医学院,浙江 温州 325035)
芍药苷上调慢性压迫性损伤大鼠脊髓背角和背根节内Sirt1表达
郑晖1,杨柳英1,郑文1,2,张娟1,郭小文1,陶涛1
(1.浙江中医药大学附属第一医院 麻醉科,浙江 杭州 310000;2.温州医科大学 第一临床医学院,浙江 温州 325035)
目的:观察芍药苷对慢性压迫性损伤(CCI)大鼠的疼痛行为和Sirt1在脊髓背角及背根节的表达变化。方法:选择雄性SD大鼠48只,按照设计随机分为假手术组(Sham组)、阴性对照组(SC组)、CCI组和芍药苷组。每组在术前和术后3、7和14 d检测大鼠的后足热缩足反射潜伏期(TWL)和机械缩足反射阈值(MWT);选择在术后3、7和14 d的相同时间处死大鼠,取大鼠L4~5节段的脊髓和背根节组织备用,用realtime PCR检测Sirt1在组织内表达水平,采用Western blot法检测组织内Sirt1蛋白表达变化。结果:术后3、7和14 d,与Sham组比,CCI组TWL与MWT值均显著降低(P<0.05),并且在术后3 d达到最小值;real-time PCR结果显示,与Sham组相比,术后7 d和14 d,CCI组脊髓背角及背根节的Sirt1基因表达显著降低(P<0.05),与SC组对比,芍药苷组脊髓背角及背根节的Sirt1基因的表达上调(P<0.05);Western blot结果表明芍药苷组脊髓背角及背根节的Sirt1蛋白的表达随时间逐步升高,但在14 d时仍低于SC组(P<0.05)。结论:芍药苷能够缓解神经病理性疾病引发的疼痛,其中上调脊髓背角和背根节Sirt1的表达是其可能机制。[关键词] 芍药苷;慢性压迫性损伤;脊髓背角;背根节;Sirt1; 大鼠
神经病理性疼痛(neuropathic pain,NP)是一系列的躯体感觉系统的疾病或者病变引起的疼痛,具有持续性[1]。这类疼痛目前仍然是世界上最常见的导致患者生活困难甚至诱发患者残疾的常见原因。沉默信息调节因子-2(silent information regulator 2,Sir2)相关酶1(silent mating type information regulation 2 homolog 1,Sirt1)是一种核蛋白,可以参与生物体内多种复杂的生命活动,上调脊髓神经元的Sirt1表达能够有效地减轻或者缓解神经疼痛[2]。药物可以通过靶向作用于Sirt1,引起其所在信号通路的改变,从而使慢性压迫性损伤(chronic constrictive injury,CCI)大鼠的神经病理性疼痛得到有效缓解[3]。有研究表明芍药苷对损伤的神经元具有保护作用[4],并且我们通过前期的预实验发现芍药苷能够影响CCI大鼠对痛觉的反应,所以本研究旨在验证芍药苷在参与CCI大鼠痛觉变化的同时能否引起Sirt1蛋白的表达改变,为临床治疗神经病理性疼痛提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康状况良好的雄性SD大鼠48只,体质量220~260 g,购自温州医科大学实验动物中心,动物许可证编号:SCXK(浙)2010-0044。1.1.2 主要试剂:Sirt1及β-actin抗体购自美国Abcam公司,实验中涉及的DAB显色剂、二抗购自北京中杉金桥生物技术有限公司,纯度约99.99%的芍药苷购自中国医学科学院药物所,real-time PCR相关酶及试剂购自大连Takara公司,实验中引物由北京六合华大基因公司设计,实验中刺激痛觉测试计和测痛计均购自美国健康医疗仪器国际公司。
1.2 方法
1.2.1 实验动物分组:将48只SD大鼠随机分成假手术组(Sham组)、CCI组、芍药苷组和阴性对照组(SC组),每组12只。其中Sham组仅通过手术暴露坐骨神经但不进行结扎,CCI组仅通过手术对坐骨神经结扎,芍药苷组将坐骨神经结扎后按照60 mg/kg的标准[5]腹腔注射芍药苷,并且持续14 d,SC组在坐骨神经结扎后向大鼠腹腔注射适量的0.9%氯化钠溶液,持续至术后14 d。
1.2.2 CCI大鼠制备:参照文献[6]建立CCI模型,5%水合氯醛按照300 mg/kg的标准腹腔注射麻醉大鼠,选择大鼠的右侧腿部皮肤切开,将皮下组织与肌肉分离,露出坐骨神经,用手术丝线间隔1 mm左右结扎4道,在结扎时注意结扎强度,保持大鼠小腿肌肉可以发生轻度颤动,然后缝合。模型制作成功标准:手术后3 d大鼠的痛阈下降30%,右侧爪内收,后足能够轻微外翻并且跛行。
1.2.3 行为学测定:术前1 d及术后3、7和14 d对大鼠的各项行为学反应进行检测,测定时间选取每天10:00至14:00,保持恒温25 ℃。热缩足反射潜伏期(thermal withdrawal latency,TWL)的测定:采用痛觉测试计为336爪/尾刺激大鼠并记录TWL值。仪器参数设置:在空闲时加热头的激光发射强度设定为20%;如果在工作时加热头激光发射强度设定为60%,中间中断时间为25 s,避免造成动物受伤;触发温度设定为30 ℃。分别将大鼠置于实验台透明玻璃板上,待大鼠稳定之后,即可用加热头刺激大鼠术侧足底部,此刻出现的抬腿回避时间记为1次TWL。5 min/次刺激,检测3次TWL取其平均值。机械缩足反射阈值(mechanical withdrawal threshold,MWT)的测定:将各组大鼠置于透明且箱底部为1 cm×1 cm铁丝网的有机玻璃箱中,测试开始前先让大鼠适应箱内环境15 min左右。使用已备测痛计,方向从下往上垂直地刺激大鼠手术侧足底的光滑部分皮肤,并且逐渐加大测痛计刺激强度,记录发生如舔足、甩腿等足回缩反应时的刺激强度,即为MWT,10 s/次刺激,5次后取MWT平均值。
1.2.4 Real-time PCR:新鲜组织保存在液氮中,每次实验开始前将组织从液氮中取出,在研钵中保持液氮存在的环境下将组织研磨充分。加入10% SDS和分离缓冲液研磨混匀,然后加入蛋白酶K在37 ℃恒温放置1~2 h,加入NaCl之后进行离心,收集上清液后采用氯仿-异戊醇法提取组织DNA。PCR反应条件为94 ℃预变性3 min,然后依次是94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环30次,最后72 ℃延伸5 min。引物序列如下:18 s rRNA的正向引物:5’-ATTCCGATAACGAACGAGAG-3’;反向引物:5’-GGCATCACAGACCTGTTATTG-3’。Sirt1的正向引物:5’-GGATCCTTCATTTATCAGAGTTGCCACC-3’;反向引物:5’-CTTCGAGGTTCTTCTAAACTTGGACTCTGG-3’。
1.2.5 Western blot:取出液氮中保存的组织后在含有液氮环境下研磨充分,在研钵内添加1 mL裂解液混匀,然后室温静置约1 h,采用15 000×g离心1 h后,BCA法测定上清中蛋白浓度,计算样品量之后再经过Western blot步骤:上样,电泳,转膜,10%浓度牛奶室温封闭1 h左右,加入一抗后在4 ℃孵育过夜。一抗被洗去后加入二抗,室温2 h后洗去二抗,采用ECL荧光显色法观察结果。
1.3 统计学处理方法 采用SPSS13.0软件进行统计学分析。计量资料以±s表示,Western blot显色结果采用Image J软件对条带的灰度值进行分析。其中多组间比较采用两因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠术前及术后各时间点TWL和MTW值比较 术后观察发现所有大鼠均未发生自残和伤口感染现象。对各组大鼠检测TWL和MWT发现,术前各组大鼠间TWL和MWT值差异均无统计学意义(P>0.05)。Sham组大鼠并未出现爪内收和运动障碍等变化,各时间点TWL和MWT值差异无统计学意义(P>0.05)。CCI组大鼠TWL和MWT值在术后3 d达到最低值,与术前比差异有统计学意义(P<0.05),而且和Sham组的各相同时间点比,CCI组大鼠的TWL和MWT值显著降低(P<0.05)。CCI组与SC组各相对应的时间点TWL和MWT值差异均无统计学意义(P>0.05)。芍药苷组的组内对比发现,在术后3 d TWL和MWT值降至最低,但在术后7 d TWL与MWT值明显回升(P<0.05),术后14 d时与7 d时对比两者未出现明显回升,但是其与Sham组仍存在差异(P<0.05),见表1-2。以上结果说明芍药苷可以降低CCI大鼠的热痛觉和机械痛觉的过敏进展。
表1 各组大鼠术前及术后各时间点TWL值比较(n=4,±s)
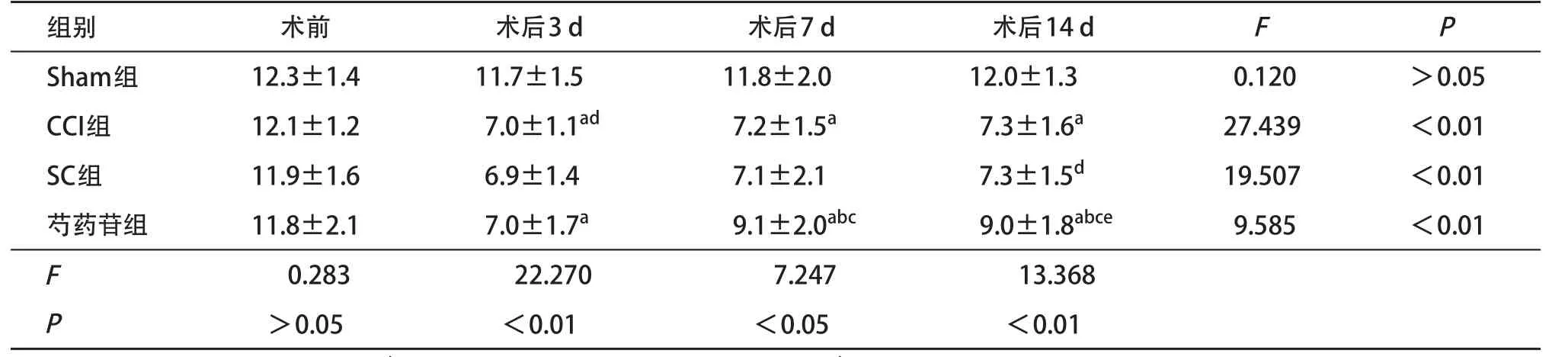
表1 各组大鼠术前及术后各时间点TWL值比较(n=4,±s)
与Sham组比:aP<0.05;与CCI组比:bP<0.05;与SC组比:cP<0.05;与术前比:dP<0.05;与术后3 d比:eP<0.05
组别术前术后3 d术后7 d术后14 dFP Sham组12.3±1.411.7±1.511.8±2.012.0±1.3 0.120>0.05 CCI组12.1±1.2 7.0±1.1ad7.2±1.5a7.3±1.6a27.439<0.01 SC组11.9±1.6 6.9±1.4 7.1±2.1 7.3±1.5d19.507<0.01芍药苷组11.8±2.1 7.0±1.7a9.1±2.0abc9.0±1.8abce9.585<0.01 F 0.28322.2707.24713.368 P >0.05<0.01<0.05<0.01
表2 各组大鼠术前及术后各时间点MWT值比较(n=4,±s)
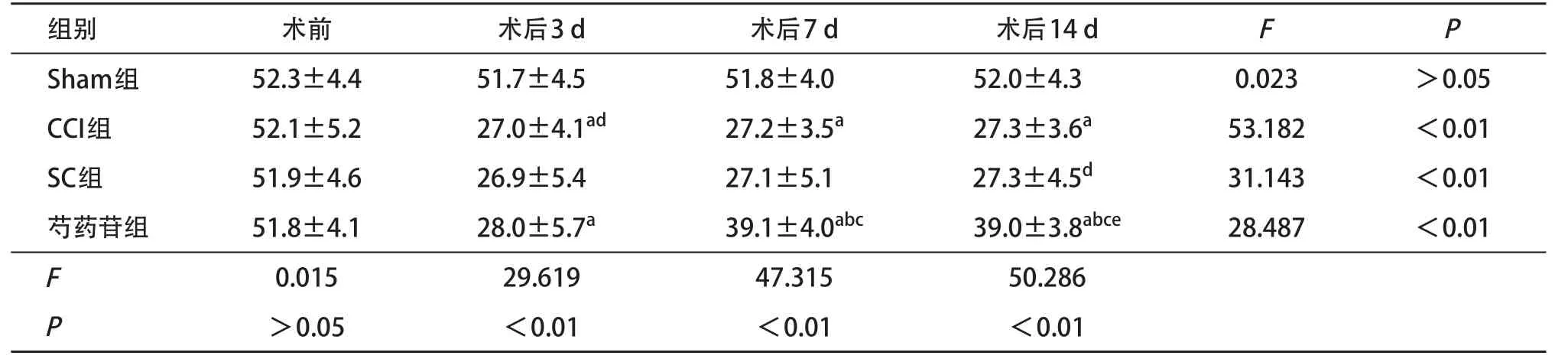
表2 各组大鼠术前及术后各时间点MWT值比较(n=4,±s)
与Sham组比:aP<0.05;与CCI组比:bP<0.05;与SC组比:cP<0.05;与术前比:dP<0.05;与术后3 d比:eP<0.05
组别术前术后3 d术后7 d术后14 dFP Sham组52.3±4.451.7±4.551.8±4.052.0±4.30.023>0.05 CCI组52.1±5.227.0±4.1ad27.2±3.5a27.3±3.6a53.182<0.01 SC组51.9±4.626.9±5.427.1±5.127.3±4.5d31.143<0.01芍药苷组51.8±4.128.0±5.7a39.1±4.0abc39.0±3.8abce28.487<0.01 F 0.01529.61947.31550.286 P >0.05<0.01<0.01<0.01
2.2 Real-time PCR检测术后不同时间Sirt1表达术后3 d,CCI组、芍药苷组和SC组分别与Sham组相比,大鼠脊髓背角内Sirt1基因表达显著降低(P<0.05);术后7 d芍药苷组大鼠的Sirt1基因表达较术后3 d上调,并且与CCI组和SC组对比上调显著,差异有统计学意义(P<0.05);术后14 d芍药苷组Sirt1基因表达较术后7 d上调,且较CCI组和SC组升高,差异有统计学意义(P<0.05),见表3。术后3 d,CCI组、芍药苷组和SC组大鼠脊髓背根节处Sirt1基因较Sham组降低,差异有统计学意义(P<0.05);术后7、14 d,芍药苷组Sirt1基因表达较CCI组和SC组明显增加,差异有统计学意义(P<0.05);且术后14 d,芍药苷组的Sirt1高于7 d时的表达水平(P<0.05),见表4。在脊髓背角和背根节处,14 d时芍药苷组与SC组的Sirt1水平仍存在差异,差异有统计学意义(P<0.05)。表明芍药苷可以上调脊髓背角和背根节处Sirt1基因表达以缓解大鼠痛觉过敏的发展。
表3 各组大鼠脊髓背角处术后各时间点Sirt1/18s rRNA值比较(n=4,±s)
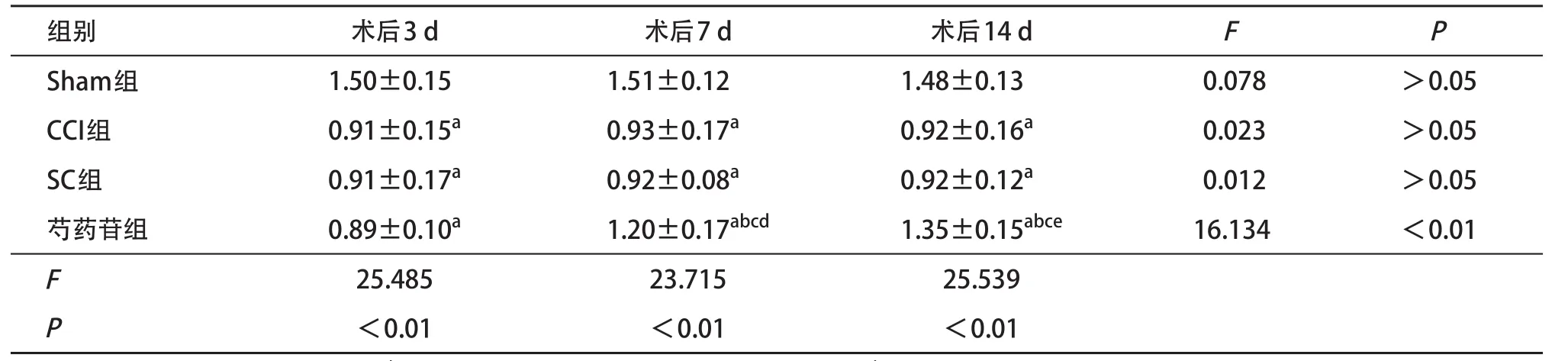
表3 各组大鼠脊髓背角处术后各时间点Sirt1/18s rRNA值比较(n=4,±s)
与Sham组比:aP<0.05;与CCI组比:bP<0.05;与SC组比:cP<0.05;与术后3 d比:dP<0.05;与术后7 d比:eP<0.05
组别术后3 d术后7 d术后14 dFP Sham组1.50±0.151.51±0.121.48±0.13 0.078>0.05 CCI组0.91±0.15a0.93±0.17a0.92±0.16a0.023>0.05 SC组0.91±0.17a0.92±0.08a0.92±0.12a0.012>0.05芍药苷组0.89±0.10a1.20±0.17abcd1.35±0.15abce16.134<0.01 F 25.48523.71525.539 P <0.01<0.01<0.01
表4 各组大鼠脊髓背根节处术后各时间点Sirt1/18s rRNA值比较(n=4±s)
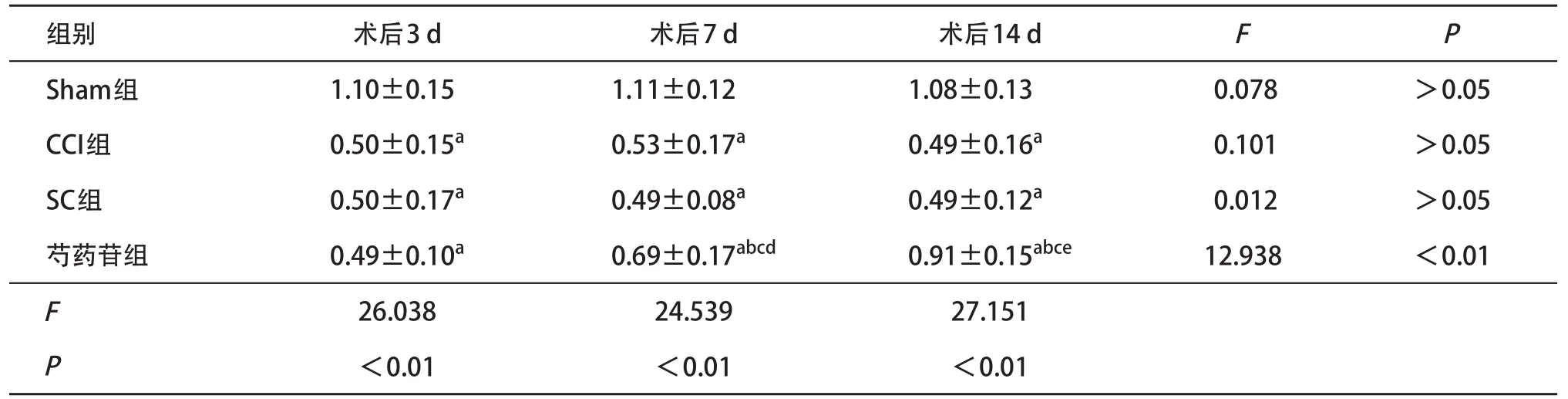
表4 各组大鼠脊髓背根节处术后各时间点Sirt1/18s rRNA值比较(n=4±s)
与Sham组比:aP<0.05;与CCI组比:bP<0.05;与SC组比:cP<0.05;与术后3 d比:dP<0.05;与术后7 d比:eP<0.05
组别术后3 d术后7 d术后14 dFP Sham组1.10±0.151.11±0.121.08±0.13 0.078>0.05 CCI组0.50±0.15a0.53±0.17a0.49±0.16a0.101>0.05 SC组0.50±0.17a0.49±0.08a0.49±0.12a0.012>0.05芍药苷组0.49±0.10a0.69±0.17abcd0.91±0.15abce12.938<0.01 F 26.03824.53927.151 P <0.01<0.01<0.01
2.3 Western blot检测Sirt1蛋白表达水平 术后3、7、14 d,各组大鼠脊髓背角及背根节处Sirt1蛋白的Western blot检测结果显示,芍药苷组大鼠脊髓背角的Sirt1蛋白表达从术后3、7到14 d逐渐升高,差异有统计学意义(P<0.05),见图1和表5。芍药苷组大鼠脊髓背根节Sirt1蛋白水平随着术后时间延长也逐渐升高,差异有统计学意义(P<0.05),见图2和表6。但在14 d时芍药苷组Sirt1基因在脊髓背角和背根节处的表达仍低于SC组,差异有统计学意义(P<0.05)。这表明芍药苷能够通过上调Sirt1蛋白表达影响大鼠的痛觉进展,但距SC组表达水平仍存在差距。

图1 芍药苷组和SC组大鼠脊髓背角处Sirt1蛋白表达电泳图(n=4)
表5 术后3、7、14 d芍药苷组和SC组大鼠脊髓背角处Sirt1蛋白表达(n=4,±s)

表5 术后3、7、14 d芍药苷组和SC组大鼠脊髓背角处Sirt1蛋白表达(n=4,±s)
与SC组比:aP<0.05;与术后3 d比:bP<0.05;与术后7 d比:cP<0.05
组别术后3 d术后7 d术后14 dFP SC组1.47±0.141.46±0.201.47±0.18 0.007>0.05芍药苷组0.35±0.06a0.79±0.13ab0.94±0.17ac34.263<0.01 F 324.41155.6930.44 P <0.01<0.01<0.01

图2 芍药苷组和SC组大鼠脊髓背根节处Sirt1蛋白表达电泳图(n=4)
3 讨论
在本研究中,通过对大鼠的疼痛行为学检测发现,制作大鼠CCI模型后大鼠的TWL和MWT值较术前显著降低,说明该模型符合后续实验的要求。通过查阅文献,我们发现芍药苷浓度为60 mg/kg时其作用在CCI大鼠脊髓的效果较为明显[5]。给大鼠腹腔注射芍药苷后,术后7 d CCI大鼠疼痛行为学结果表明,TWL和MWT均出现了不同程度的回升。同时real-time PCR和Western blot结果表明,芍药苷在改变疼痛行为学数据的同时,在脊髓背角和背根节处出现Sirt1基因的mRNA水平和蛋白水平上升,并且其变化趋势与疼痛发展及痛觉过敏现象的改变相一致。说明芍药苷能够在一定程度上改善CCI大鼠痛觉过敏现象,并且Sirt1蛋白可能参与这一过程。
神经病理性疼痛是一种由于躯体的感觉系统受损或者某些疾病所致的神经疼痛,主要表现以痛觉过敏和异常性疼痛为主[7]。当前治疗此类疼痛还是以药物为主,辅以微创治疗或者调控神经等方式。近年来随着研究的深入,许多中药或者其提取物的有效成分逐渐被用于神经病理性疾病的治疗,使治疗取得了一定的效果。如陈勇等[8]研究发现白屈菜红碱和苦参碱都具有缓解CCI大鼠与TWL和MWT相关的过敏现象,而且还能够抑制炎症相关因子的分泌。CHERNG等[9]研究证实黄苓苷可以有效减轻因为脊神经结扎而产生的疼痛过敏相关症状。在对此类中药成分及效果进行研究的同时,也有研究从分子层面探讨这类药物作用机制。刘双等[10]研究发现,姜黄素能够通过促进神经细胞的增殖发挥神经保护作用。郑晋伟等[11]研究发现姜黄素能够显著缓解神经病理性疼痛,其可能的机制是通过降低脊髓背角和脊髓背根节处CX3CR1基因的表达,从而实现对神经病理性疼痛的调控。GAO等[12]研究发现,在对CCI大鼠腹腔注射大黄素后,大鼠的疼痛症状明显缓解的同时还伴有脊髓背根神经节中P2X3受体的表达降低。
表6 术后3、7、14 d芍药苷组和SC组大鼠脊髓背根节处Sirt1蛋白表达(n=4,±s)

表6 术后3、7、14 d芍药苷组和SC组大鼠脊髓背根节处Sirt1蛋白表达(n=4,±s)
与SC组比:aP<0.05;与术后3 d比:bP<0.05;与术后7 d比:cP<0.05
组别术后3 d术后7 d术后14 dFP SC组1.15±0.151.14±0.171.11±0.12 0.119>0.05芍药苷组0.15±0.02a0.39±0.09ab0.84±0.11ac107.214<0.01 F 262.0091.2216.50 P <0.01<0.01<0.01
芍药苷是芍药的主要活性成分,是一种单帖类糖苷化合物。已有研究发现芍药苷具有多种生物学效应,例如抗肿瘤作用、抗氧自由基作用和缓解平滑肌痉挛等[13]。另有研究发现芍药苷还具有神经保护作用,其可能的机制是通过抑制星形胶质细胞,然后增强ATP敏感的钾通道的表达从而降低细胞膜的兴奋性、增强脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达以及抑制细胞色素c的释放、NF-κB的激活等多个环节而发挥神经保护作用[14]。Sirt1在脑神经元中有广泛分布,在诱导基因沉默中发挥重要作用,能够在细胞核与细胞质间往返[15],参与神经元细胞的程序性死亡和能量代谢[16]。但是目前,芍药苷发挥神经保护作用的具体靶点及其机制尚不明确。由于芍药苷能够影响BDNF的表达,Sirt1蛋白同样也能够调节BDNF的活性[17],并且目前Sirt1通过与BDNF的相互作用而影响神经病理性疼痛的恢复尚未见报道。所以我们在研究芍药苷改善CCI大鼠疼痛行为学TWL 和MWT这一现象后,又分别在CCI大鼠的脊髓背角和背根节处进一步探讨了分子生物学层面Sirt1基因的改变,结果发现芍药苷可能的作用途径是上调Sirt1基因表达,进一步调节位于Sirt1基因下游的BDNF蛋白表达,最终实现对CCI大鼠的抗痛觉过敏与镇痛效应。本研究初步揭示Sirt1基因表达与芍药苷缓解神经病理性疼痛的相关性,也表明芍药苷是中药治疗神经病理性疼痛的有效成分。在后续的研究中,我们将对Sirt1参与的细胞信号通路进行研究,探究芍药苷减轻由CCI导致的神经病理性疼痛的可能信号途径,为中药治疗神经病理性疼痛提供理论基础。
[1] COSTIGAN M, SCHOLZ J, WOOLF C J. Neuropathic pain: a maladaptive response of the nervous system to damage[J]. Annu Rev Neurosci, 2009, 32: 1-32.
[2] SHAO H, XUE Q, ZHANG F, et al. Spinal SIRT1 activation attenuates neuropathic pain in mice[J]. PLoS One, 2014, 9(6): e100938.
[3] GUI Y, LI A, CHEN F, et al. Involvement of AMPK/SIRT1 pathway in anti-allodynic effect of troxerutin in CCI-induced neuropathic pain[J]. Eur J Pharmacol, 2015, 769: 234-241.
[4] 吴玉梅, 许汉鹏, 王春婷, 等. 芍药苷对培养小鼠皮层神经元的保护作用[J]. 中国药理学与毒理学杂志, 2002, 16(3): 172-175.
[5] 冯仲锴, 孙永强, 刘汝银, 等. 芍药苷对大鼠脊髓损伤的神经保护机制[J]. 免疫学杂志, 2016, 32(5): 376-381.
[6] BENNETT G J, XIE Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988, 33(1): 87-107.
[7] JENSEN T S, BARON R, HAANPÄÄ M, et al. A new defi -nition of neuropathic pain[J]. Pain, 2011, 152(10): 2204-2205.
[8] 陈勇, 梁应平, 郭莲, 等. 白屈菜红碱预先给药对神经病理性疼痛大鼠疼痛行为和脊髓星形胶质细胞活化的影响[J].临床麻醉学杂志, 2014, 30(1): 77-80.
[9] CHERNG C H, LEE K C, CHIEN C C, et al. Baicalin ame-liorates neuropathic pain by suppressing HDAC1 expression in the spinal cord of spinal nerve ligation rats[J]. J Formos Med Assoc, 2014, 113(8): 513-520.
[10] 刘双, 程建华, 韩钊, 等. 姜黄素对局灶脑缺血再灌注损伤的神经保护作用及对新生神经细胞增殖的影响[J]. 温州医学院学报, 2013, 43(3): 171-174.
[11] 郑晋伟, 郑昌健, 曹红, 等. 姜黄素下调神经病理性疼痛大鼠脊髓背角和背根节CX3CR1的表达[J]. 中国中药杂志, 2011, 36(18): 2552-2556.
[12] GAO Y, LIU H, DENG L, et al. Effect of emodin on neuropathic pain transmission mediated by P2X2/3 receptor of primary sensory neurons[J]. Brain Res Bull, 2011, 84(6):406-413.
[13] 刘洋, 崔广智, 张艳军, 等. 芍药苷预处理对皮质酮损伤皮层神经元保护作用机制研究[J]. 中国中药杂志, 2010, 35(18): 2457-2459.
[14] LIU J, JIN D Z, XIAO L, et al. Paeoniflorin attenuates chronic cerebral hypoperfusion-induced learning dysfunction and brain damage in rats[J]. Brain Res, 2006, 1089(1):162-170.
[15] TANNO M, SAKAMOTO J, MIURA T, et al. Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1[J]. J Biol Chem, 2007, 282(9): 6823-6832.
[16] FULCO M, SCHILTZ R L, IEZZI S, et al. Sir2 regulates skeletal muscle differentiation as a potential sensor of the redox state[J]. Mol Cell, 2003, 12(1): 51-62.
[17] ZOCCHI L, SASSONE-CORSI P. SIRT1-mediated deacetylation of MeCP2 contributes to BDNF expression[J]. Epigenetics, 2012, 7(7): 695-700.
(本文编辑:贾建敏)
Paeoniflorin up-regulates expression of Sirt1 in spinal dorsal horn and dorsal root ganglia in chronic constriction injury rat
ZHENG Hui1, YANG Liuying1, ZHENG Wen1,2, ZHANG Juan1, GUO Xiaowen1, TAO Tao1. 1.Department of Anesthesia, the First Affi liated Hospital of Zhejiang Chinese Medical University, Hangzhou, 310000; 2.The First Clinical Medical College, Wenzhou Medical University, Wenzhou, 325035
Objective:To observe the effect of paeonifl orin on pain behavior and the expression of Sirt1 in spinal dorsal horn and dorsal root ganglion in rats with chronic constriction injury.Methods:Forty-eight male SD rats were randomly divided into sham operation group, negative contract group (SC group), CCI group and paeonifl orin group. Heat shrinkable foot refl ex latency (TWL) and mechanical paw withdrawal refl ex threshold (MWT) were detected for rats in each group at 1 day before operation and postoperative 3, 7 and 14 days. Rats were sacrifi ced at 3, 7 and 14 days after surgery then L4-5 segment of spinal cord and dorsal root section organization was taken, and real-time PCR was used for expression of Sirt1, Western blot was used in the same time to detect the change of Sirt1 protein level.Results:At 3, 7 and 14 days after surgery, TWL and MWT of CCI group decreased signifi cantly compared with sham group (P<0.05), and achieved the minimum value at the third day. Real-time PCR showed that the expression of Sirt1 of CCI group of spinal dorsal horn and dorsal root ganglia were signifi cantly decreased at the 7th day and 14th day after surgery compared with sham group (P<0.05); the expression of Sirt1 of paeonifl orin group was upregulated compared with SC group (P<0.05); the results of Western blot also showed that the level of Sirt1 protein in the dorsal horn and dorsal root ganglion were gradually increased with time, and there was difference between the Sirt1 group and the SC group at 14th day.Conclusion:Paeonifl orin can alleviate by pain neuropathic disease caused, and the up regulation of the expression of Sirt1 protein in dorsal horn and dorsal root ganglion of the spinal cord is a possible mechanism.
paeonifl orin; chronic constrictive injury; spinal cord; dorsal root ganglion; Sirt1; rats
R971
A
10.3969/j.issn.2095-9400.2017.06.010
2016-08-05
浙江省中医药科学研究基金资助项目(2015ZB052)。
郑晖(1977-),男,浙江诸暨人,主治医师,硕士。

