吴茱萸碱对人胰腺癌SW1990细胞株体内外增殖及凋亡的影响
陈辉,王兆洪,陈龙,范恒伟,周斌,徐鲁白,童洪飞
(温州医科大学附属第二医院 肝胆胰外科,浙江 温州 325027)
吴茱萸碱对人胰腺癌SW1990细胞株体内外增殖及凋亡的影响
陈辉,王兆洪,陈龙,范恒伟,周斌,徐鲁白,童洪飞
(温州医科大学附属第二医院 肝胆胰外科,浙江 温州 325027)
目的:通过体内外实验探讨吴茱萸碱对人胰腺癌SW1990细胞株增殖及凋亡的影响。方法:人胰腺癌细胞株SW1990在经0、5、10、20、40、80 μmol/L吴茱萸碱分别作用12、24、48 h后,应用CCK-8法检测吴茱萸碱对SW1990细胞的增殖抑制作用;流式细胞术检测吴茱萸碱对SW1990细胞周期的影响;Western blot检测SW1990细胞中Active Caspase-3及Active Caspase-8的表达。建立裸鼠胰腺癌原位移植瘤模型,分别予以0、10、20、30 mg/kg吴茱萸碱腹腔注射处理2周,每周给药3次后,观察裸鼠生长情况;处死裸鼠后,检测原位移植瘤重的变化;Western blot及免疫组织化学法检测肿瘤组织中Active Caspase-3及Active Caspase-8的表达。结果:吴茱萸碱对SW1990细胞的增殖抑制作用呈浓度和时间依赖性;胰腺癌SW1990细胞在G2/M期的细胞数明显增加;Western blot检测示SW1990细胞中Active Caspase-3及Active Caspase-8蛋白的表达明显升高。在体内,随着吴茱萸碱浓度的增加,对裸鼠原位胰腺移植瘤的生长抑制更明显,瘤体中Active Caspase-3及Active Caspase-8蛋白的表达明显升高。结论:吴茱萸碱可显著抑制人胰腺癌SW1990细胞增殖,其作用在一定时间内呈浓度和时间依赖性,作用机制可能是将胰腺癌细胞的生长阻滞在G2/M期。同时吴茱萸碱可激活Caspase-8,并活化其下游的Caspase-3,从而促进肿瘤细胞的凋亡。
吴茱萸碱;胰腺癌;细胞增殖;细胞凋亡;细胞周期;Caspase-3;Caspase-8
胰腺癌是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,其发病率和病死率近年来明显上升,5年生存率<1%,是预后最差的恶性肿瘤之一[1]。治疗上多采用以外科手术为主的综合治疗,但手术切除率低,复发率高。化疗是治疗不能手术切除的胰腺癌,以及预防胰腺癌术后复发的主要手段之一。吉西他滨是治疗进展期胰腺癌及胰腺癌术后复发的“金标准”化疗方案[2],但是吉西他滨化疗的有效率低于10%,故研究一种新的有效的化疗药物迫在眉睫。研究[3-4]表明,中药姜黄素、百里醌等药物显著抑制胰腺癌细胞增殖。
吴茱萸碱(Evodiamine)为中药吴茱萸的主要成分[5],对宫颈癌、肺癌、结肠癌等多种肿瘤有抑制作用,其机制可能是通过抑制肿瘤的增殖、转移、血管形成,并促进其凋亡而发挥抗肿瘤作用[6]。本研究观察吴茱萸碱对人胰腺癌SW1990细胞增殖及凋亡以及裸鼠胰腺癌原位移植瘤模型的影响,并探讨其可能机制。
1 材料和方法
1.1 试剂 吴茱萸碱(药物纯度大于98%)、胰蛋白酶、碘化丙锭(PI)、二甲基亚砜(DMSO)购自美国Sigma公司;RPMI1640培养基购自美国Gibco公司;CCK-8试剂盒(批号:C0038)、Tubulin抗体、FITC标记山羊抗小鼠IgG(H+L)购自上海碧云天生物技术研究所;胎牛血清购自杭州四季青生物工程公司;Caspase-3抗体、Caspase-8抗体和β-actin抗体购自美国Abcam公司。
1.2 细胞培养 人胰腺癌细胞SW1990(购于美国ATCC公司)培养于含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的RPMI1640培养液中,置于含5% CO2,37 ℃细胞培养箱中培养,每3 d换液1次。细胞单层贴壁生长,约80%融合时胰蛋白酶消化传代。
1.3 CCK-8法检测细胞存活率 收集处于对数生长期的SW1990胰腺癌细胞,接种到96孔板,4×103个/孔,细胞贴壁后,分别加入吴茱萸碱0、5、10、20、40、80 μmol/L作用12、24、48 h,每组重复5孔,同时设置空白组(不加细胞,加入等量PBS)。药物作用结束前1 h,各孔加入0.01 mL CCK-8,继续培养1 h,酶标仪(Bio-Tek,ELX800)测A450值,实验重复3次。细胞抑制率=[1-(试验组A值-空白组A值)/(对照组A值-空白组A值)]×100%。
1.4 流式细胞术检测吴茱萸碱对SW1990细胞周期的影响 将细胞浓度为2×105个/mL的SW1990胰腺癌细胞接种于6孔板中,孵育24 h后,以0、5、10、20、40、80 μmol/L的吴茱萸碱继续孵育12、24、48 h后,收集细胞,以2 000 r/min离心10 min,弃去上清,用70%的冰乙醇,在4 ℃环境下固定过夜,经PI染液(PI 2.5 mg,RNase 0.5 mg及Trtition-X-100 0.25 mL)800 μL,避光染色30 min后,过500目尼龙网过滤,流式细胞仪进行检测,激发波长为488 nm。
1.5 Western blot检测SW1990胰腺癌细胞Active Caspase-3及Active Caspase-8蛋白的表达 收集处于对数生长期的SW1990细胞,经0、5、10、20、40、80 μmol/L的吴茱萸碱处理48 h后,RIPA裂解液裂解,提取上清液,测量蛋白浓度。取等量蛋白质样品(20 μg/孔),8% SDS-PAGE电泳,半干转膜仪转膜,5%脱脂奶粉封闭后滴加兔抗人Caspase-3或者Caspase-8抗体为一抗,HRP标记的羊抗兔IgG为二抗,ECL显色,X线胶片曝光。
1.6 裸鼠饲养 40只4~6周龄健康BALB/c雌性裸鼠购自中国科学院上海实验动物中心,动物合格证号:SCXK(沪)2012-0002,体质量18~20 g,饲养于SPF屏障系统的洁净层流架内,室温控制在(25± 1)℃,相对湿度为40%~60%。
1.7 模型建立及分组 将5×106~10×106个处于对数生长期的SW1990细胞悬浮于50 μL无血清RPMI1640培养基中,细胞存活率>90%,75%的乙醇消毒裸鼠腹部皮肤,用戊巴比妥钠(50 mg/kg)腹腔麻醉裸鼠,取左上腹直肌旁1 cm切口,暴露脾脏和胰腺尾部,用50 μL微量注射器吸取50 μL胰腺癌细胞悬液,在放大镜下注射到脾脏下面的胰尾部被膜下,以薄膜下出现可鉴别的隆起性液泡而无液体渗漏到腹腔为注射成功的标志[7],注射成功后分两层关闭腹壁。随机分成4组,每组10只,手术后第3周开始给药,分别予以0、10、20、30 mg/kg腹腔吴茱萸碱处理2周后,每周给药3次,观察裸鼠生长情况,2周后脱臼法处死裸鼠,留取荷瘤鼠的心脏、肝脏、肾脏、胃肠道,留取胰腺肿瘤并称重,测量后将各脏器组织一部分用4%多基甲醛固定,另一部分保存于液氮中备用。
1.8 Western blot检测裸鼠原位移植瘤组织中Active Caspase-3及Active Caspase-8蛋白的表达从荷瘤裸鼠中取出肿瘤组织,用常规方法提取各
组肿瘤细胞的总蛋白,BCA法定量蛋白浓度。每标本上样约80 μg蛋白于12% SDS-PAGE凝胶,电压80 V 约30 min,改电压为125 V约持续1 h。然后从凝胶中采用半干转膜法转移蛋白质至PVDF膜,用含5%无脂牛奶TBST封闭,滴加兔抗人抗体4 ℃孵育过夜,HRP标记的羊抗兔IgG抗体孵育1 h,用ECL发光液显色。
1.9 免疫组织化学法检测裸鼠原位移植瘤组织中Ki-67、Active Caspase-3及Active Caspase-8蛋白的表达 取固定好的肿瘤组织,经脱水、透明、浸蜡、包埋、切片,常规脱蜡水化。按照二步法试剂盒所示的操作步骤进行染色,切片经脱水、透明、封片。在高倍镜(Olympus BX51,×400)下随机选择10个视野,Image-pro plus 6软件分析平均光密度。
1.10 统计学处理方法 应用SPSS16.0统计软件进行分析。计量数据以±s表示,组间比较采用重复测量资料方差分析或单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 吴茱萸碱对SW1900胰腺癌细胞增殖的抑制作用 CCK-8法检测结果显示:0、5、10、20、40、80 μmol/L吴茱萸碱分别作用12、24、48 h,均能明显抑制胰腺癌细胞SW1990的生长,且随着浓度的增加及时间的延长,吴茱萸碱对胰腺癌细胞增殖的抑制率增加,呈明显的时间依赖性和浓度依赖性(见图1)。

图1 吴茱萸碱对SW1990胰腺癌细胞增殖的抑制作用
2.2 吴茱萸碱对SW1900胰腺癌细胞周期的影响流式细胞术检测结果显示:0、5、10、20、40、80 μmol/L吴茱萸碱分别作用12、24、48 h,随着作用时间的延长和药物浓度的增加,G2/M期细胞比率增加,差异有统计学意义(P<0.05),呈明显的时间依赖性和浓度依赖性(见表1)。
2.3 SW1990胰腺癌细胞中蛋白Active Caspase-3 及Active Caspase-8的表达 吴茱萸碱作用于SW1990细胞48 h后Western blot检测胰腺癌细胞中蛋白Active Caspase-3及Active Caspase-8的表达,结果显示随着吴茱萸碱浓度的增加,Active Caspase-3及Active Caspase-8的表达均升高(见图2)。
表1 吴茱萸碱对胰腺癌细胞SW1990 G2/M周期分布的影响(n= 5,±s,%)
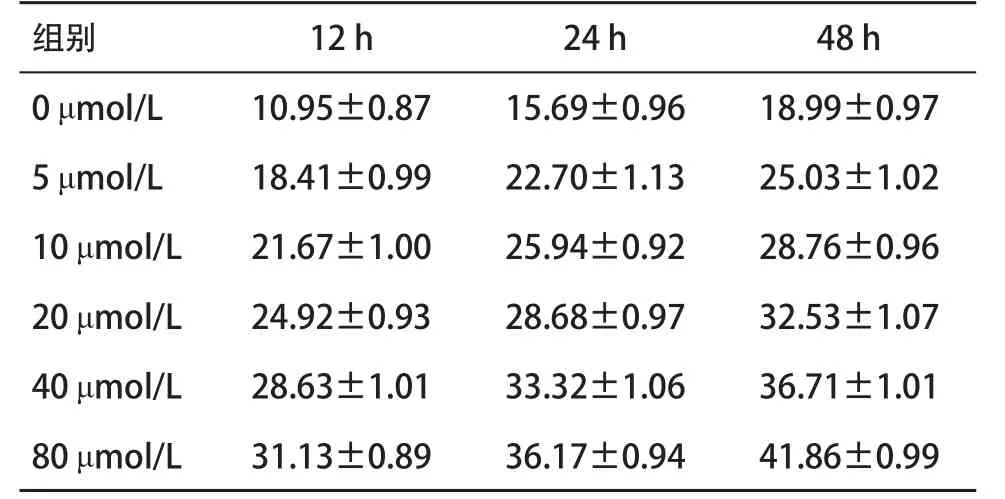
表1 吴茱萸碱对胰腺癌细胞SW1990 G2/M周期分布的影响(n= 5,±s,%)
注:各时间点间、各浓度组间比较,差异均有统计学意义(P<0.05)
组别12 h24 h48 h 0 μmol/L10.95±0.8715.69±0.9618.99±0.97 5 μmol/L18.41±0.9922.70±1.1325.03±1.02 10 μmol/L21.67±1.0025.94±0.9228.76±0.96 20 μmol/L24.92±0.9328.68±0.9732.53±1.07 40 μmol/L28.63±1.0133.32±1.0636.71±1.01 80 μmol/L31.13±0.8936.17±0.9441.86±0.99

图2 吴茱萸碱作用于SW1990细胞48 h后Western blot检测细胞中Active Caspase-3及Active Caspase-8的表达
2.4 吴茱萸碱对裸鼠胰腺癌原位移植瘤生长的抑制作用 处死裸鼠后称重瘤体,对照组、10 mg/kg、20 mg/kg、30 mg/kg吴茱萸碱组瘤体质量分别为(1.37±0.11)g、 (1.04±0.08)g、 (0.76±0.07)g、(0.42±0.05)g,显示随着吴茱萸碱浓度的增加,其对裸鼠原位胰腺移植瘤的生长抑制作用更加明显(P<0.05)。
2.5 胰腺癌原位移植瘤组织中Active Caspase-3及Active Caspase-8的表达 随着吴茱萸碱浓度的增加,裸鼠胰腺癌原位移植瘤组织中Active Caspase-3及Active Caspase-8的表达均增加(见图3)。
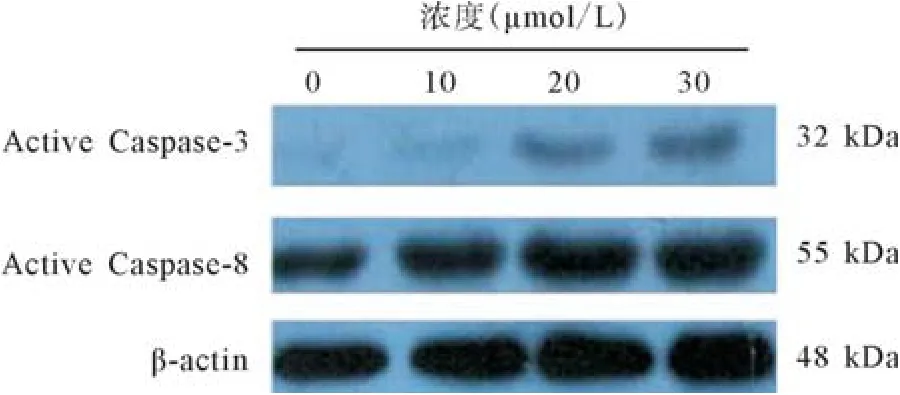
图3 吴茱萸碱处理裸鼠后,Western blot检测裸鼠胰腺癌原位移植瘤组织中Active Caspase-3及Active Caspase-8的表达
2.6 裸鼠胰腺癌原位移植瘤组织中ki-67、Active Caspase-3及Active Caspase-8的表达 处死裸鼠后,免疫组织化学检测Ki-67、Active Caspase-3及Active Caspase-8在裸鼠胰腺癌原位移植瘤组织中的表达,结果显示,随着吴茱萸碱浓度的升高,Ki-67的表达降低,Active Caspase-3及Active Caspase-8的表达升高(见图4及表2)。

图4 免疫组织化学法检测裸鼠胰腺癌原位移植瘤组织中Ki-67、Active Caspase-3及Active Caspase-8的表达(×200)
表2 免疫组织化学法检测裸鼠胰腺癌原位移植瘤组织中Ki-67、Active Caspase-3及Active Caspase-8的表达(n=10,±s)

表2 免疫组织化学法检测裸鼠胰腺癌原位移植瘤组织中Ki-67、Active Caspase-3及Active Caspase-8的表达(n=10,±s)
与0 mg/kg组比:aP<0.05
组别Ki-67Active Caspase-3Active Caspase-8 0 mg/kg 0.18±0.020.09±0.010.08±0.01 10 mg/kg 0.14±0.01a0.12±0.01a0.11±0.01a20 mg/kg 0.12±0.01a0.16±0.02a0.14±0.02a30 mg/kg 0.10±0.01a0.18±0.01a0.17±0.01a
3 讨论
中药抗癌在国际上尚存有争议,有效治疗机制的不明确、中药联合及中西药联合治疗理论依据的匮乏[8-9],限制了中药在国际上的认可及应用。尽管如此,一项调查报告显示,在美国有40%的癌症患者服用含中药成分的药品。近年来,越来越多的中药单体被提炼出来,此类药品纯度高,化学性质较为单一,便于实验研究,吴茱萸碱即为其中之一。
在体外实验中,0~80 μmol/L内的不同浓度的吴茱萸碱均对人胰腺癌细胞株SW1990增殖有抑制作用,且随着吴茱萸碱浓度的增加及作用时间的延长,细胞增殖的抑制率明显增加。张醇等[10]研究证实吴茱萸碱可使肿瘤细胞的细胞周期阻滞在G2/M期,而吴茱萸碱引起的肿瘤细胞增殖抑制大部分发生在这一期。本研究流式细胞术检测结果显示,随着吴茱萸碱浓度的增加及作用时间的延长,被阻滞在G2/M期的胰腺癌SW1990细胞的比率也明显增多。G2/M期主要进行RNA合成和蛋白质准备分裂,这揭示吴茱萸碱可能影响了细胞生存所需蛋白质的合成,从而实现对肿瘤细胞的增殖抑制。我们通过检测不同浓度吴茱萸碱处理胰腺癌裸鼠原位移植瘤结果显示,随着吴茱萸碱浓度的增加,对肿瘤生长的抑制明显增强,免疫组织化学检测结果证实,Ki-67随着吴茱萸碱浓度的升高表达降低。
目前研究认为吴茱萸碱可诱导胃癌细胞SGC-7901细胞发生Caspase蛋白酶依赖性的凋亡[11]。本研究中,Western blot结果示Active Caspase-3、Active Caspase-8在低剂量吴茱萸碱组胰腺癌细胞中高表达,同一作用时间随着吴茱萸碱浓度的升高而表达升高;在裸鼠原位移植瘤组织中,随着吴茱萸碱作用时间的延长和浓度的升高,Active Caspase-8、Active Caspase-3的表达也升高,提示吴茱萸碱可以通过促进Caspase-8酶原的激活,从而激活Caspase-3,促进胰腺癌细胞的凋亡。
综上所述,吴茱萸碱可显著抑制人胰腺癌SW1990细胞生长,并呈浓度和时间依赖性,其作用机制可能是将胰腺癌SW1990细胞的生长阻滞在G2/M期。同时吴茱萸碱通过激活Caspase-3及Caspase-8等因子,促进胰腺癌SW1990细胞的凋亡,故在胰腺癌的治疗上我们可以将Caspase-3及Caspase-8作为靶点。
[1] STATHIS A, MOORE M J. Advanced pancreatic carcinoma: current treatment and future challenges[J]. Nat Rev Clin Oncol, 2010, 7(3): 163-172.
[2] TEAGUE A, LIM K H, WANGGILLAM A. Advanced pancreatic adenocarcinoma: a review of current treatment strategies and developing therapies[J]. Ther Adv Med Oncol, 2015, 7(2): 68-84.
[3] SU J, ZHOU X, WANG L, et al. Curcumin inhibits cell growth and invasion and induces apoptosis through downregulation of Skp2 in pancreatic cancer cells[J]. Am J Cancer Res, 2016, 6(9): 1949-1962.
[4] MUJAHID Y, SANJEEV B, MOMIN M, et al. Synthesis, characterization and anti-tumor activity of novel thymoquinone analogs against pancreatic cancer[J]. Bioorg Med Chem Lett, 2013, 23(10): 3101-3104.
[5] HAN S, WOO J K, JUNG Y, et al. Evodiamine selectively targets cancer stem-like cells through the p53-p21-Rb pathway[J]. Biochem Biophys Res Commun, 2016, 469(4):1153-1158.
[6] JIANG J L, HU C P. Evodiamine: a novel anti-cancer alkaloid from Evodia rutaecarpa[J]. Molecules, 2009, 14(5):1852-1859.
[7] WEI W T, CHEN H, WANG Z H, et al. Enhanced antitumor effi cacy of gemcitabine by evodiamine on pancreatic cancer via regulating PI3K/Akt pathway[J]. Int J Bio Sci, 2012, 8 (1): 1-14.
[8] JIA Y, DU H, YAO M, et al. Chinese herbal medicine for myelosuppression induced by chemotherapy or radiotherapy: a systematic review of randomized controlled trials[J]. Evid Based Complement Alternat Med, 2015, 2015(3):690976.
[9] MAN S, GAO W, WEI C, et al. Anticancer drugs from traditional toxic Chinese medicines[J]. Phytother Res, 2012, 26(10): 1449-1465.
[10] 张醇, 梁华平. 吴茱萸碱抗肿瘤活性研究进展[J]. 中国新药杂志, 2010(17): 1558-1562.
[11] 张元新, 葛雅琨. 吴茱萸碱与紫杉醇协同抑制胃癌细胞SGC-7901的研究[J]. 吉林农业大学学报, 2014(3): 314-318.
(本文编辑:丁敏娇)
The effects of Evodiamine on the proliferation and apoptosis of pancreatic cancer SW1990 cells in vivo and in vitro
CHEN Hui, WANG Zhaohong, CHEN Long, FAN Hengwei, ZHOU Bin, XU Lubai, TONG Hongfei. Department of Hepatobiliary, the Second Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To investigate the effects of Evodiamine on the proliferation and apoptosis of pancreatic cancer SW1990 cells.Methods:Pancreatic cancer SW1990 cells were mixed with different concentrations of Evodiamine (0, 5, 10, 20, 40, 80 μmol/L) after 12, 24, 48 hours respectively. The SW1990 cells’ proliferation was detected by cell counting Kit-8 (CCK-8). The SW1990 cells’ cycle was detected with fl ow cytometry test. Nude mouse models were established with orthotopic transplantation tumor, which were injected with different concentrations of Evodiamine for 2 weeks. The orthotopic transplantation tumor’s weight was measured after sacrifi ced. The expression of Active Caspase-3 and Active Caspase-8 in tumor tissues was detected by Western blot and immunohistochemistry.Results:Evodiamine inhibited the proliferation effect of SW1990 cells by concentration and time dependence. The quantity of pancreatic cancer SW1990 cells in G2/M phase signifi cantly increased. The expressions of Active Caspase-3 and Active Caspase-8 protein signifi cantly increased. With increasing of Evodiamine concentrations, the inhibiting effect on the nude mouse’s growth of pancreas transplantation tumor was more remarkable and the expressions of Active Caspase-3 and Active Caspase-8 increased much more obviously in the tumor tissues.Conclusion:Evodiamine can signifi cantly inhibit human pancreatic cancer SW1990 cells’ proliferation with concentration and time dependence. Its mechanism may retard the growth of pancreatic cancer cells in G2/M phase. In the meantime, Evodiamine can activate Caspase-8 and Caspase-3, then promote the apoptosis of pancreatic cancer cells.
Evodiamine; pancreatic cancer; cell proliferation; apoptosis; cell cycle; Caspase-3; Caspase-8
R735.9
A
10.3969/j.issn.2095-9400.2017.06.009
2016-10-13
浙江省中医药管理局青年基金资助项目(2014ZQ020);温州市公益性科技计划项目(Y20140694)。
陈辉(1983-),男,浙江温州人,主治医师,硕士。
童洪飞,副主任医师,Email:tonghongfei@163.com。

