“精准医疗”背景下的靶向药物研究
——心肌缺血区靶向机制及药物设计策略※
刘 峰 董少红 吴美善 梁瑞娟 熊 玮 刘华东 陈科奇
“精准医疗”背景下的靶向药物研究
——心肌缺血区靶向机制及药物设计策略※
刘 峰 董少红 吴美善 梁瑞娟 熊 玮 刘华东 陈科奇
如何实现对严重危害人类健康疾病的精准治疗是目前医学界的难题和研究热点。随着“精准医疗”计划启动,药物设计也随之进入“精准”靶向药物分子设计时代。全球范围内患病人数最高的心血管疾病是目前全球范围内导致人类病死的主要疾病之一,远高于因肿瘤及其他疾病病死人数,而其中缺血性心肌疾病已成为威胁人类健康的头号杀手。目前,虽有多种治疗心肌缺血药物,但多数缺乏组织特异性,同时因缺血区血液循环障碍,使药物在缺血区的分布往往不甚理想。本研究综述并探讨了针对靶向于心肌缺血区的药物被动、主动以及理化实现机制与相关策略。
精准医疗;心肌缺血;药物靶向;分子靶向药物设计;作用机制
心肌缺血主要是因心肌耗氧量与冠状动脉血氧供给间的失衡造成的心肌严重供血不足。目前多种抗心肌缺血相关药物应用于临床,但大部分具有明显弊端:诸如由于心血管疾病生理特性,药物缺乏心肌组织特异性,药物因半衰期短而易在体内降解,或者药物无法最终进入心肌细胞发挥药效作用;因心肌组织缺血造成血液循环障碍而必须大剂量给药方可起效,但增加药物剂量会引起一定不良反应,从而限制了临床药物治疗的广泛应用。而通过药物载体技术包裹药物进行创新制剂开发,旨在实现药物代谢及组织分布行为的改变,特异性地提高病灶部位药物浓度,进而在病灶部分靶向发挥作用,以达到提高药物治疗效果的目的。心血管药物靶向给药技术已成为国内外研究的热点及趋势,靶向给药技术主要利用病灶部位的生理及病理特性实现靶向作用,因此靶向药物的研发首先应考虑的主要问题便是心血管疾病的生理病理特性。心肌缺血的病理机制较为复杂,心肌收缩、舒张能力降低;心肌电生理发生变化;心肌细胞凋亡;心肌能量代谢发生改变(图1)。
1 基于被动机制的靶向策略
被动机制的靶向策略主要基于心肌病变部位的生理、病理特点,依靠递药系统性质的改变,实现药物在病变部位的有效释放进而蓄积。国内外研究最早且临床应用较多的被动靶向给药技术是脂质体,通过给药载体的类细胞膜结构实现药物在体内代谢及组织分布,最终将药物成功的靶向分布于靶标。目前研究证实,药物可以通过脂质体及其他载体实现在心肌缺血组织中积聚,同时脂质体可非特异性地粘连至细胞表面对受损细胞膜进行修补,进而完成脂质体在一定程度上的心肌保护[1]。由于脂质体的部分辅助治疗作用,脂质体载体是目前最常用于心肌缺血区靶向研究的药物载体。对载有含顺磁及荧光脂质的纳米胶束和纳米脂质体在再灌注损伤小鼠模型中靶向集聚于急性再灌注引起心肌梗死区中,并且粒径小的纳米胶束具有更快积累速度[2]。
心肌缺血区的药物被动靶向机制研究目前主要集中于EPR效应,即心肌缺血造成的药物透过增强以及药物滞留[3],以及利用或避免网状内皮系统识别和结合实现靶向病灶组织的被动靶向策略。纳米脂质体、高分子纳米球、脂质纳米球、纳米乳液及胶束等纳米给药技术均可以通过减少粒径、表面正电荷化以及长循环等技术基于靶组织EPR效应采用被动靶向机制实现心肌靶向作用。EPR效应在肿瘤及炎症等病变部位也广泛存在,是目前研究药物系统被动靶向的病理生理学基础。尤其是实体瘤的特殊病理生理学特征,如高密度且结构完整性差的血管分布、局部血管通透性高等可以充分实现大分子药物物质的肿瘤血管渗出,并且在组织产生药物滞留效应[4]。对于缺血心肌组织而言,药物粒子尤其是大分子粒子的尺寸以及负载电荷决定了其药物的 EPR效应。药物粒子的尺寸对药物在缺血区分布的 EPR效应最为明显,其次当药物粒子尺寸相当时,由于缺血区细胞表面的负电性特点,荷载正电的药物粒子更易实现 EPR效应[5]。通过在药物表面修饰聚乙二醇可以减少网状内皮系统识别,例如阿霉素脂质体通过在其表面修饰 PEG可减少其在血液中被清除,从而增加肿瘤治疗效果,并降低阿霉素造成的心脏不良反应[6-7]。相反,利用被网状内皮系统识别机制可以作为靶向治疗炎性相关疾病的研究思路,例如利用该机制对动脉粥样硬化进行成像和治疗[8]。
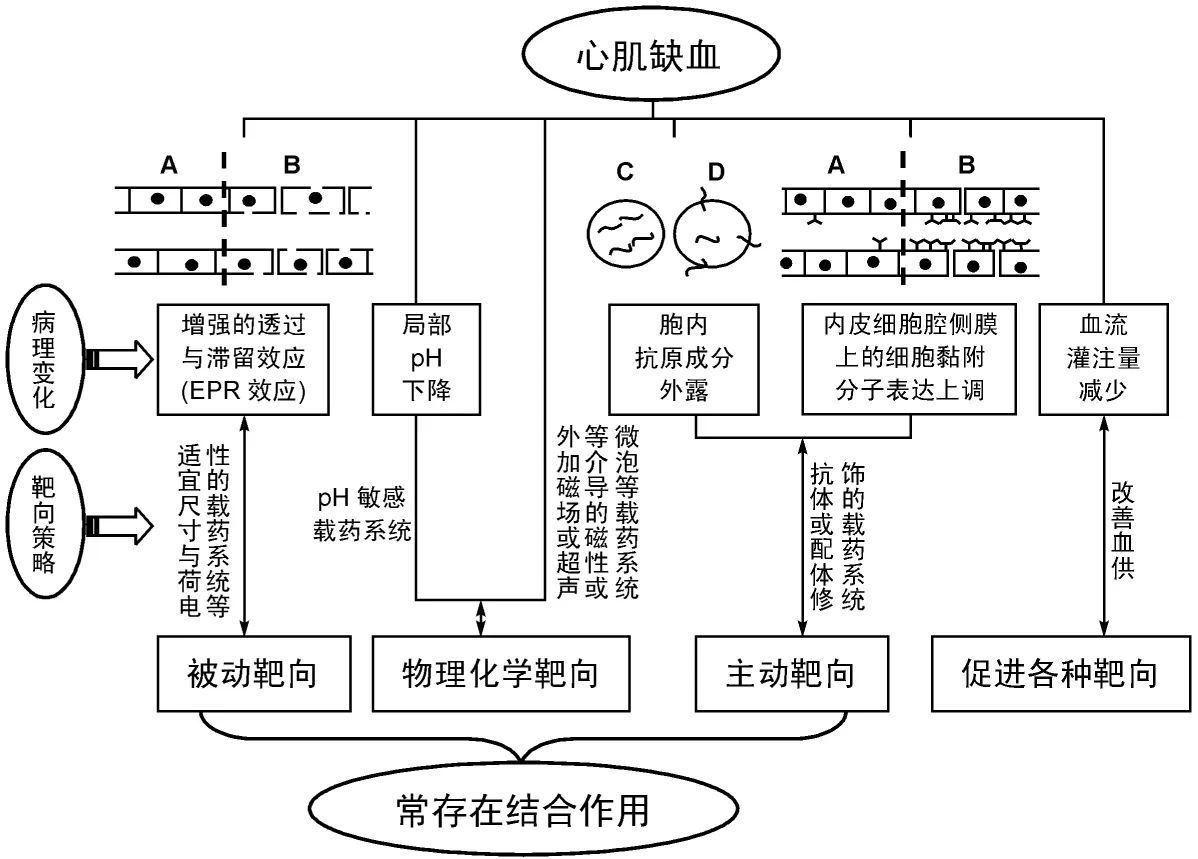
图1 心肌缺血区组织的病理与靶向
近年来,针对治疗心肌缺血药物(如外源性腺苷、谷胱甘肽和辅酶Q10等)靶向设计多通过脂质体药物载体以及药物EPR效应来实现,而心肌缺血区血流灌注速度、血管通透性以及药物半衰期 3个方面决定了靶向药物的最终分布效应[9]。多种疾病发生与体内辅酶Q10缺乏有关,例如心脏病、高血压、帕金森病、癌症、牙周疾病、哮喘以及人类免疫缺陷病毒感染。口服辅酶Q10对心血管相关疾病的治疗具有显著临床价值,尤其是对线粒体功能障碍导致的心肌疾病。因此,辅酶Q10心肌靶向制剂的研究对于心肌梗死相关心肌疾病的治疗,尤其是缺血再灌注引起心肌组织损伤的保护与治疗具有重要的临床应用价值。此外,制备成功的ATP脂质体应用于急性心肌梗死兔中发现,接受ATP脂质体冠状动脉给药兔的心肌梗死区面积显著缩小,进一步研究发现ATP脂质体经PEG修饰后可以显著增加ATP脂质体的体内循环时间,可有效提高受损心肌细胞ATP水平[10]。
基于上述研究结论,目前一直认为利用药物粒子EPR效应、基于心肌缺血区被动靶向策略的药物设计主要满足以下两点:①为提高聚合物亲水性及其水中的弥散效果,聚合物药物的流体动力学直径应大于肾小球毛细血管截留临界值。②为提高胶态载体系统的隐形性,规避Kupffer细胞识别、截留,胶态载体系统均要完成其表面的亲水修饰。
2 基于主动机制的靶向策略
基于主动机制的药物靶向策略(又称为“生物导弹”)主要依靠药物特异性的识别目标靶位的特殊分子(诸如受体、抗原、凝集素、叶酸或转运体等)进行特异性的结合,进而触发细胞吞吐机制,最终完成药物载体在病变组织和细胞内的靶向选择性富集效果。
2.1 抗体介导的药物靶向机制细胞内抗原成分因细胞膜在缺血环境下功能紊乱而出现外露现象,而该部分外露抗原成分可以作为外源性载药系统主动进行靶向结合的靶标,最终实现药物在受损心肌组织的主动靶向分布及富集。研究显示肌球蛋白在缺血导致细胞膜破裂后并未流出细胞外,该特点使肌球蛋白成为药物主动靶向策略最为常用的靶点[11]。而前期动物实验采用放射性同位素标记(采用131I、111In 和99mTc)的抗肌球蛋白抗体在兔或犬心梗区的高度灵敏度和特异性,充分证实了肌球蛋白作为常用靶点的有效性[12]。抗肌球蛋白免疫脂质体经 PEG修饰后可以延长其在血液循环中的时间,进而增加在动物心梗区的主动靶向集聚。此外,肌钙蛋白 I抗体也可以通过主动靶向策略实现其在心肌缺血区的富集。
此外,心肌缺血区通过局部炎性反应可在细胞膜上产生大量细胞黏附分子,因其独有的特异性,也可以作为载药系统的表面修饰与改性,最终实现基于主动靶向机制心肌缺血区的药物富集。
2.2 受体介导的药物靶向机制β肾上腺素能受体配基烯丙洛尔修饰脂质体经大鼠静脉注射后,其在心脏和肺的含量分别增加了4.9倍和7.4倍。β1受体在心肌缺血时的增量及敏感性均显著,鉴于此对 β1受体配体进行脂质体修饰有助于进一步提高药物主动靶向效果,增加心肌细胞对药物的摄取。
此外,利用病毒载体介导心肌缺血区药物靶向研究也逐渐增多,考虑到特异性不高以及基因无法长期表达的缺点,进一步研究方向主要集中于通过加载组织特异性调控元件(心室特异性肌球蛋白轻链-2启动子/增强子)提高该类药物载体的心肌靶向效果。
3 基于理化机制的靶向策略
由于有氧代谢受阻,酸性代谢产物增加及清除受阻,心肌缺血最终导致缺血区细胞内酸中毒。为此针对缺血区酸性环境的 pH敏感靶向制剂可以实现药物在缺血区的靶向聚集及释放。
对急性心肌梗死组织施以外加磁场可以产生一定保护作用。由此设计的药物磁性靶向在实现心肌缺血区诊断作用的同时,还可以达到外加磁场以及药物的保护作用。此外,以微泡作为载体负载药物或基因的超声靶向微泡破裂法,通过超声波与微泡相互作用实现药物在靶区释放在心血管疾病中的应用也逐渐增多。也有研究证实,微泡-靶基因混合物(表达特定基因的质粒与脂质微泡共孵育)利用UTMD可以实现目标基因在心肌组织的靶向释放及表达[13-14]。但UTMD能否成功用于人体尚需进一步证实。
4 总结
靶向心肌缺血区给药策略常需要联合多种机制来实现,因此设计心肌缺血区的靶向给药系统应综合考虑各种靶向机制以达到最佳效果。目前,虽已取得一些进展,探明一些药物分布影响因素,发现一些特异性靶标,但有限的靶标数量及其特异性仍限制了药物靶向分布。今后针对缺血区血供改善、提高靶标的靶向效率、新靶标的发现及多种靶向策略组合应用将是该领域进一步的研究方向,尤其是缺血区血供的快速恢复与多种靶向机制的有机组合。
[1] 中国抗癌协会大肠癌专业委员会专家组.结直肠癌肝转移转化治疗中靶向药物合理应用的专家指导意见[J].中华胃肠外科杂志, 2013,16(10):1000-1004.
[2] 毕红,余乐乐,宋梦梦,等.无机纳米载体在靶向药物输送中的应用研究进展[J].安徽大学学报(自然科学版),2011,35(3):1-8.
[3] 童光武.分子靶向药物在晚期NSCLC患者中的疗效探讨[J].临床肺科杂志,2016,21(9):1682-1685.
[4] 李健,沈琳.分子靶向药物在胃肠道肿瘤综合治疗中的应用[J].中华胃肠外科杂志,2014,17(11):1062-1067.
[5] 绮娴.肺动脉高压靶向药物联合治疗进展[J].中国循环杂志, 2013,28(8):637-639.
[6] AL de Barros,M Ld,DC Soares,et al.Long-circulating,pH-sensitive liposomes verSus long-circulating,non-pH-sensitive liposomes as a delivery system for tumor identification[J].J Biomed Nanotechnol, 2013,9(9):1636-1643.
[7] CML De,AC de,EA Leite,et a1.Antitumor effectiveness and toxicity of cisplatin-loaded long-circulating and pH-sensitive liposomes against Ehrlich ascetic tumor[J].Exp Biol Med(Maywood),2012, 237(8):973-984.
[8] F Yu,JM Yang,JJ Li.Preparation of novel gypenosides long-circulating liposomes consisted by sphingomyelin and beta-sitosterol modified by PEG[J].Zhongguo Zhong Yao Za Zhi,2014,39(6):238-242.
[9] Leuschner F,Dutta P,Gorbatov R,et a1.Therapeutic siRNA silencing in inflammatory monocytes in mice[J].Nat Biotechnol,2011,29(11): 1005-1010.
[10] 张萍萍,朱虹,刘兰茹,等.基于靶向药物的医保药品谈判实践研究[J].中国卫生事业管理,2016,33(4):275-278.
[11] 汪霖.人类表皮生长因子受体2阳性肿瘤靶向药物研究进展[J].实用肿瘤学杂志,2016,30(3):266-270.
[12] 高艳娥,薛琴琴.宫颈癌分子靶向药物的研究进展[J].西安交通大学学报(医学版),2013,34(5):557-562.
[13] 张勰义,宋少莉,黄钢,等.核素标记受体酪氨酸激酶靶向药物显像研究进展[J].上海交通大学学报(医学版),2013,33(1):104-108.
[14] 胡劼,苏海砾,宗瑜瑾,等.利用载舒尼替尼的多聚体微泡实现超声介导的靶向药物运输[J].中国医学影像技术,2013,29(2):161-164.
10.12010/j.issn.1673-5846.2017.02.062
深圳市人民医院,广东深圳 518100
深圳市科技计划项目(编号:JCYJ20160422151912249)
刘峰,博士学位,医师。研究方向:心力衰竭、冠状动脉粥样硬化性心脏病、分子靶向治疗等研究
董少红,Email:iceicelover@163.com

