miR-497和miR-34a在铂敏感和铂耐药卵巢上皮癌患者中的表达差异及机制研究
曹丽娟,刘文博(承德市中心医院妇产科,河北承德 067000)
miR-497和miR-34a在铂敏感和铂耐药卵巢上皮癌患者中的表达差异及机制研究
曹丽娟*,刘文博(承德市中心医院妇产科,河北承德 067000)
目的:探讨微小核糖核酸miR-497和miR-34a在铂敏感和铂耐药卵巢上皮癌(EOC)患者中表达的差异及机制。方法:选取2008年1月-2012年1月于我院妇产科行卵巢癌分期手术或肿瘤细胞减灭术的EOC患者72例,术后均行以铂类药物为基础的规范化疗,并进行随访(时间为2008年7月-2016年7月)。根据患者对铂类药物的敏感性将其分为铂敏感组(42例)和铂耐药组(30例)。采用实时荧光定量聚合酶链反应法检测两组患者肿瘤组织中miR-497和miR-34a的表达水平,并考察其与患者总生存时间的相关性;采用巢式降落式甲基化特异性聚合酶链反应法检测患者miR-497和miR-34a启动子区DNA甲基化水平,采用蛋白印迹法考察组蛋白H3第9位赖氨酸残基二甲基化(H3K9me2)水平,采用染色质免疫共沉淀法检测miR-497和miR-34a启动子区H3K9me2水平。结果:铂敏感组患者miR-497和miR-34a的表达水平均显著高于铂耐药组,差异均有统计学意义(P<0.05);72例患者的总生存期为(45.7±17.5)个月,与其miR-497和miR-34a表达水平呈正相关(r2分别为0.271 4、0.378 2,P<0.01)。铂耐药组患者miR-497和miR34a启动子区DNA甲基化水平均显著高于铂敏感组,且其启动子区H3K9me2水平也显著高于铂敏感组,差异均有统计学意义(P<0.05或P<0.01);而铂耐药组患者H3K9me2水平虽略高于铂敏感组,但差异无统计学意义(P>0.05)。结论:EOC患者肿瘤组织中miR-497和miR-34a的表达水平与铂化疗的敏感性及患者的生存时间有关,启动子区DNA甲基化和组蛋白甲基化可能是其表达变化的机制之一。
微小核糖核酸;miR-497;miR-34a;卵巢上皮癌;铂耐药;DNA甲基化;组蛋白甲基化;启动子区
卵巢上皮癌(Epithelial ovarian cancer,EOC)在女性生殖系统恶性肿瘤中病死率位居第一位[1-2]。分期手术或细胞减灭术后行顺铂为主的化疗是目前治疗EOC的重要手段之一,但铂耐药的产生是导致化疗失败和肿瘤复发的中心环节,且耐药机制十分复杂[3]。微小核糖核酸(miRNAs)是一类内源性小分子非编码RNA,主要在转录后发挥基因表达的调控作用,参与多种生理及病理过程[4-5]。相关文献报道,miR-497和miR-34a与卵巢癌细胞凋亡、侵袭等病理过程密切相关,且多种miRNAs可经不同机制参与EOC细胞铂耐药的产生[6-7]。但在此过程中,miRNAs的异常表达受何种方式调节尚不清楚。DNA甲基化和组蛋白甲基化是表观遗传学调控的重要方式,可通过调控不同基因的表达来介导EOC细胞铂耐药的产生[8-9],但其是否影响EOC患者miRNAs的表达目前仍不清楚。本研究旨在探讨miR-497和miR-34a在铂耐药和铂敏感EOC患者中表达的差异及机制,并分析其表达水平与EOC患者生存时间的相关性,初步探讨miR-497和miR-34a在EOC铂耐药中的价值。
1 资料与方法
1.1 研究对象
本研究方案经医院医学伦理委员会审核通过后,选取2008年1月-2012年1月在我院妇产科诊治的EOC患者72例作为研究对象。纳入标准:(1)于我院初治的EOC患者;(2)既往无其他恶性肿瘤病史;(3)经卵巢癌分期手术或肿瘤细胞减灭术治疗;(4)术中冰冻切片及术后病理检查确诊为EOC;(5)术前未经放、化疗及其他方式治疗;(6)术后行以铂类药物为基础的规范化疗;(7)有完整的临床资料和随访资料(包括肿瘤复发时间和总生存期)。排除标准:(1)合并自身免疫性疾病者;(2)肝功能严重障碍者;(3)严重高血压及心脏疾病患者;(4)孕妇。
1.2 材料
1.2.1 仪器 QuantStudio®3型实时荧光定量聚合酶链反应(RT-qPCR)仪(美国Applied Biosystems公司);T100 Thermal Cycler型PCR仪、Mini-PROTEAN®Tetra手灌胶系统、Mini-PROTEAN®3 DodecaTM小型高通量电泳槽和ChemiDocTM凝胶成像系统(美国Bio-Rad公司);5247R型台式高速冷冻离心机(德国Eppendorf公司);SW-CJ-2FD型双人超净工作台(苏州苏洁净化设备公司)。
1.2.2 试剂 miRNA提取试剂盒(批号:DP501),miRNA逆转录试剂盒(批号:KR201),miR-497、miR-34a和U6(内参)RT-qPCR引物(批号分别为CD201-0441、CD201-0034和CD201-0145)均购自天根生化科技有限公司;AxyPrep基因组DNA小量制备试剂盒(美国AXYGEN公司,批号:AP-MN-MS-GDNA-50G);DNA甲基化修饰试剂盒(北京天漠科技开发有限公司,批号:D5001);anti-H3K9me2、anti-H3(美国Abcam公司,批号分别为ab1220、ab1791);辣根过氧化物酶(HRP)标记二抗(北京中杉金桥生物技术有限公司,批号:ZDR-5306);核蛋白和浆蛋白提取试剂盒(批号:KGP150)、十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒(批号:KGP113)均购自江苏凯基生物技术股份有限公司;蛋白G磁珠(Protein G agarose,美国ThermoFisher公司,批号:88803);磷酸盐缓冲液(PBS,美国Hyclone公司,pH=7.4);甲醛、甲醇、甘氨酸等为分析纯。
1.3 方法
1.3.1 治疗与分组方法 术后所有患者均参照美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[10]行以铂类药物为基础的规范化疗,并进行随访。随访时间为2008年7月-2016年7月,随访内容包括:患者对铂类药物的敏感性、随访终止时患者的总生存时间等。
参照NCCN指南对EOC铂耐药和铂敏感的定义[10]、根据患者对铂类药物的敏感性,将其分为铂耐药组和铂敏感组[铂耐药:初次接受铂类药物化疗,停药后6个月内复发;铂敏感:初次接受铂类药物化疗,停药后6个月及以上复发,或不复发。复发标准:经CT、磁共振成像(MRI)或多普勒超声等影像学检查诊断为EOC复发]。其中铂耐药组患者30例,年龄28~70岁,平均年龄(55.7±7.2)岁;浆液性卵巢癌14例,黏液性卵巢癌10例,子宫内膜样癌6例;早期(Ⅰ~Ⅱ期)16例,晚期(Ⅲ~Ⅳ期)14例。铂敏感组患者42例,年龄26~72岁,平均年龄(53.5±6.1)岁;浆液性卵巢癌20例,黏液性卵巢癌12例,子宫内膜样癌10例;早期(Ⅰ~Ⅱ期)24例,晚期(Ⅲ~Ⅳ期)18例。两组患者年龄、肿瘤类型和分期比较,差异均无统计学意义(P>0.05),具有可比性。
1.3.2 RT-qPCR法检测miR-497和miR-34a的表达 按照miRNA提取试剂盒说明书提取两组患者肿瘤组织中的miRNA;按照miRNA逆转录试剂盒说明书将miRNA逆转录为cDNA;以cDNA为模板进行RT-qPCR分析。PCR反应条件为:94℃预变性5 min;94℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。PCR扩增反应线性梯度良好、熔解曲线峰形单一则表明特异性良好。以内参U6的表达水平为参照,按照2-ΔΔCt法分析待测miRNA的表达水平,ΔΔCt=(Ct待测物-Ct内参)(Ct值表示每个反应管内荧光信号到达设定阈值时所经历的循环数)。
1.3.3 巢式降落式甲基化特异性PCR(nt-MSP)法检测miR-497和miR-34a启动子区DNA甲基化水平 按照AxyPrep基因组的DNA小量制备试剂盒说明书操作,提取两组患者的DNA;在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)和Ensembl网站(http://asia.ensembl.org/index.html)查找miR-497和miR-34a的启动子区;使用在线甲基化引物设计网 站 (http://www.urogene.org/cgi- bin/methprimer/ methprimer.cgi)预测miR-497和miR-34a启动子区CpG岛含量及CpG岛分布情况,并设计外引物和内引物(甲基化和非甲基化引物)(见表1)。采用DNA甲基化修饰试剂盒和亚硫酸盐修饰法对DNA进行甲基化修饰,采用nt-MSP法检测其miR-497和miR-34a启动子区DNA甲基化水平的改变。外引物扩增反应条件:95℃预变性5 min;95℃变性30 s,62℃退火30 s,72℃延伸30 s,共20个循环,每个循环下降0.5℃,直至达到退火温度(Tm),72℃再延伸5 min。继续以其PCR产物为模板,进行内引物的扩增反应,条件同外引物。取PCR产物5 μL于2%琼脂糖凝胶上电泳,于凝胶成像系统上成像,分析其甲基化条带的吸光度(OD甲)值和非甲基化条带的吸光度(OD非)值,甲基化水平=OD甲/(OD甲+OD非)。
1.3.4 蛋白印迹法检测组蛋白H3第9位赖氨酸残基二甲基化(H3K9me2)水平 采用核蛋白和浆蛋白提取试剂盒提取两组患者核蛋白,采用二辛可宁酸(Bicincho-ninic acid,BCA)法进行蛋白定量。取核蛋白样品10 μL进行SDS-PAGE凝胶电泳,切取相应位置的凝胶进行半干转膜,转膜后采用5%脱脂奶粉封闭2 h,与anti-H3K9me2或anti-H3混合,于4℃下孵育过夜。洗膜后与HRP标记二抗混合,于室温下孵育2 h,置凝胶成像系统上成像,并分析条带灰度值。以anti-H3为内参,计算H3K9me2与H3灰度值的比值,考察H3K9me2水平。

表1 miR-497和miR-34a的nt-MSP引物Tab 1 nt-MSPprimers of miR-497 and miR-34a
1.3.5 染色质免疫共沉淀法检测miR-497和miR-34a启动子区H3K9me2水平 将患者EOC组织匀浆后,以质量分数为1%的甲醛于室温下固定10 min,以终浓度为0.125 mol/L的甘氨酸中止交联(室温水平轻微摇动5 min)。离心后尽量吸尽上清液,用冷PBS冲洗2次。以SDS裂解液重悬组织沉淀,超声(25 Hz,超声15 s,间隔50 s,重复10次)使DNA破碎为100~1 000 bp大小的片段。以离心半径6 cm、转速12 000 r/min离心15 min后取上清液100 μL,加入anti-H3K9me2 4 μL,于24℃下孵育过夜,经蛋白G琼脂糖珠沉淀后,于65℃水浴中解交联。以纯化后的DNA为模板,对miR-497和miR-34a启动子区进行PCR扩增反应。所用引物:上游5′-TTGCCCCACACACTCGAGTG-3′、下游5′-CTCGCAGCCTTTGCCAATTA-3′(miR-497);上游5′-TTAGAGATTTAAACCGTGAAATGAT-3′、下游5′-TCCTACAACCTAGGTACTCTGGTAC-3′(miR-34a)。反应体系及条件、计算方法同“1.3.2”项。
1.4 统计学方法
应用SPSS 19.0软件对数据进行统计分析。计量资料以s表示,组间比较采用非配对Student’s t检验;相关性分析采用直线相关检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者miR-497和miR-34a的表达水平比较
铂敏感组患者miR-497和miR-34a的表达水平(1.29±0.51和1.29±0.43)显著高于铂耐药组(0.58± 0.40和0.59±0.27),差异均有统计学意义(P<0.01),详见图1。
2.2 miR-497和miR-34a表达水平与EOC患者总生存时间的相关性分析

图1 两组患者miR-497、miR-34a表达水平比较Fig 1 Comparison of miR-497 and miR-34a expression levels between 2 groups
随访结果显示,72例患者的总生存时间为(45.7± 17.5)个月,且其miR-497和miR-34a表达水平与总生存时间呈正相关(r2分别为0.271 4、0.378 2,P<0.01),详见图2。
2.3 两组患者miR-497和miR-34a启动子区DNA甲基化水平比较

图2 miR-497和miR-34a表达水平与EOC患者总生存时间的相关性分析Fig 2 The correlation analysis of miR-497 and miR-34a expression levels with overall survival period of EOC patients
铂耐药组患者miR-497和miR-34a启动子区甲基化水平[(0.67±0.17)和(0.57±0.22)]均显著高于铂敏感组患者[(0.37±0.18)和(0.32±0.20)],差异均有统计学意义(P<0.01),详见图3、图4。
2.4 两组患者H3K9me2水平比较

图3 两组患者miR-497和miR-34a启动子区DNA甲基化电泳图Fig 3 DNA methylation electrophorogram of miR-497 and miR-34a promoter regions of 2 groups
与铂敏感组患者(0.38±0.21)比较,铂耐药组患者H3K9me2水平(0.46±0.18)虽有上升趋势,但组间比较差异无统计学意义(P>0.05),详见图5、图6。
2.5 两组患者miR-497和miR-34a启动子区H3K9me2水平比较

图4 两组患者miR-497和miR-34a启动子区DNA甲基化水平比较Fig 4 Comparison of DNA methylation levels in miR-497 and miR-34a promoter regions between 2 groups
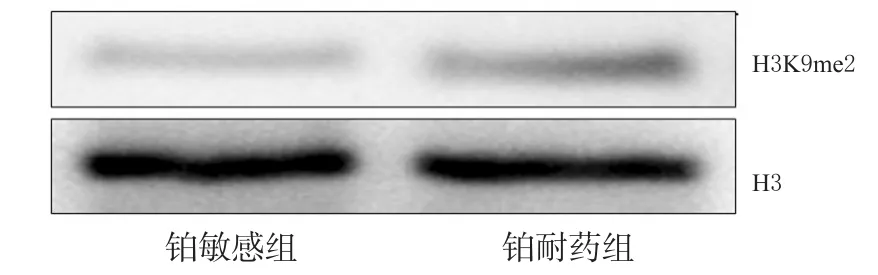
图5 两组患者H3K9me2凝胶成像图Fig 5 H3K9me2 gel imaging of 2 groups

图6 两组患者H3K9me2水平比较Fig 6 Comparison of H3K9me2 levels between 2 groups
铂耐药组患者miR-497和miR-34a启动子区H3K9me2水平[(0.61±0.28)和(0.58±0.25)]显著高于铂敏感组患者[(0.37±0.22)和(0.45±0.30)],差异均有统计学意义(P<0.05或P<0.01),详见图7。
3 讨论

图7 两组患者miR-497和miR-34a启动子区H3K9me2水平比较Fig 7 Comparison of H3K9me2 levels of miR-497 and miR-34a promoter regions between 2 groups
EOC发病隐匿、进展迅速,是致死率最高的女性生殖系统恶性肿瘤,每年可导致全球125 000人死亡[11]。至少约20%的EOC患者对一线化疗药物天然耐药,而化疗耐药是导致EOC治疗失败、肿瘤复发和病死率居高不下的重要因素之一[12]。因此,寻找EOC癌细胞耐药的靶点,阐明其耐药机制是目前亟待解决的问题。
既往关于EOC耐药的研究多集中于DNA和蛋白水平,随着分子生物学技术的发展,miRNAs受到越来越多的关注。miRNAs是一类内源性的单链非编码RNA,长约22个核苷酸,主要通过与靶信使RNA(Message RNA,mRNA)3′UTR区结合、抑制其降解和翻译等方式来发挥抑制基因表达的作用[13]。miRNAs具有重要的生理学功能,其表达异常可导致多种疾病的发生与发展[4-5]。miRNAs可通过不同机制或通路来诱导癌细胞耐药的产生:Liu J等[14]研究表明,miR-30a-5p高表达可增强癌细胞生长和集落形成能力,促进癌细胞迁移和侵袭,并与卵巢癌细胞耐药密切相关;Zhu H等[15]研究表明,miR-17-92高表达和miR-134低表达可导致其靶基因表达发生改变,介导卵巢癌细胞耐药的产生;Wu DD等[16]研究表明,miR-873通过靶向调节三磷酸腺苷结合盒转运子B亚家族成员1(ABCB1)的表达水平来介导卵巢癌细胞的多重耐药。由此可见,miRNAs的异常表达可能导致卵巢癌细胞耐药。相关文献报道,miR-497可通过靶向调节配对盒2(Paired box 2,PAX2)抑制卵巢癌细胞增殖并诱导其凋亡[6];miR-34a可通过直接靶向调节锌指转录因子(Snail)来抑制上皮细胞向间充质细胞转化、癌细胞侵袭和癌细胞团形成的能力[7]。但miR-497和miR-34a在铂敏感和铂耐药EOC患者中的表达尚不清楚。本研究结果显示,铂耐药组患者miR-497和miR-34a的表达水平显著低于铂敏感组,且其表达与EOC患者总生存时间呈正相关,提示miR-497和miR-34a可能在EOC铂耐药中发挥作用。
DNA甲基化是指基因组内CpG岛二核苷酸的胞嘧啶被甲基所修饰,从而在不改变基因结构的基础上调控基因的表达,是真核生物中一种常见的碱基共价修饰过程[17]。组蛋白甲基化是指发生在组蛋白H3和H4氮端赖氨酸或精氨酸残基上的甲基化,其功能主要体现在转录调控、异染色质形成和基因印记等方面,是表观遗传学的重要调控方式,依据组蛋白甲基化位点的不同而呈现不同的生物学效应,如组蛋白H3K4位点的甲基化可以导致基因活化,而H3K9二甲基化修饰则是基因沉默的标志[18]。有文献报道,表观遗传学机制在卵巢癌天然耐药和获得性耐药中发挥了重要作用,药物治疗可逆转异常的表观遗传状态,因此,正常表观遗传状态的维持可能成为逆转卵巢癌细胞耐药的潜在靶点[19]。研究表明,与铂敏感卵巢癌细胞系比较,铂耐药组酵母错配修复基因人同源物(hMLH1)启动子区DNA甲基化水平升高,组蛋白甲基化酶(EZH2)在铂耐药细胞系A2780/DDP中的表达高于铂敏感细胞系A2780[20]。由于miR-497和miR-34a启动子区CpG位点丰富,且DNA甲基化和组蛋白甲基化具有协同作用,因此,DNA甲基化和组蛋白甲基化可能参与了miR-497和miR-34a表达的调控。本研究结果显示,miR-497和miR-34a启动子区DNA甲基化和H3K9me2水平均显著升高,提示表观遗传学修饰可能影响了miR-497和miR-34a的表达。
综上所述,miR-497和miR-34a在EOC铂耐药中发挥着作用,且与EOC患者总生存时间呈正相关;启动子区DNA甲基化和组蛋白甲基化可能参与调控miR-497和miR-34a的表达。本研究从miRNAs的DNA甲基化和组蛋白甲基化角度出发,初步探讨了EOC铂耐药的机制,为EOC铂耐药提供了干预靶点,但EOC铂耐药机制复杂,仍有待后续深入研究。
[1] Yang ZJ,Zhao BB,Li L.The significance of the change pattern of serum CA125 level for judging prognosis and diagnosing recurrences of epithelial ovarian cancer[J].J Ovarian Res,2016,doi:11.1186/s13048-016-0266-3.
[2] Shen Y,Li L.Serum HE4 superior to CA125 in predicting poorer surgical outcome of epithelial ovarian cancer[J]. Tumour Biol,2016,37(11):14765-14772.
[3] 谢聪,尹如铁,李玉玲,等.铂耐药和铂敏感上皮性卵巢癌中ERCC1、survivin蛋白的表达及临床应用价值[J].四川大学学报(医学版),2011,42(1):86-89.
[4] Chen JQ,Papp G,Szodoray P,et al.The role of microRNAs in the pathogenesis of autoimmune diseases[J].Autoimmun Rev,2016,15(12):1171-1180.
[5] Alipoor SD,Adcock IM,Garssen J,et al.The roles of mi-RNAs as potential biomarkers in lung diseases[J].Eur J Pharmacol,2016,doi:10/1016/j.ejphar.2016.09.015.
[6] Lin Z,Zhao J,Wang X,et al.Overexpression of microRNA-497 suppresses cell proliferation and induces apoptosis through targeting paired box 2 in human ovarian cancer [J].Oncol Rep,2016,36(4):2101-2107.
[7] Dong P,Xiong Y,Watari H,et al.MiR-137 and miR-34a directly target Snail and inhibit EMT,invasion and sphereforming ability of ovarian cancer cells[J].J Exp Clin Cancer Res,2016,35(1):132.
[8] Jasty S,Krishnakumar S.Profiling of DNA and histone methylation reveals epigenetic-based regulation of gene expression during retinal differentiation of stem/progenitor cells isolated from the ciliary pigment epithelium of human cadaveric eyes[J].Brain Res,2016,doi:10.1016/j. brainres.2016.09.001.
[9] Bonito NA,Borley J,Wilhelm-Benartzi CS,et al.Epigenetic regulation of the homeobox gene MSX1 associates with platinum-resistant disease in high-grade serous epithelial ovarian cancer[J].Clin Cancer Res,2016,22(12):3097-3104.
[10] National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Ovarian Cancer[S].2009-02-01.
[11] Sankaranarayanan R,Ferlay J.Worldwide burden of gynaecological cancer:the size of the problem[J].Best Pract Res Clin Obstet Gynaecol,2006,20(2):207-225.
[12]刘玲.miRNA-mRNA差异表达与卵巢上皮癌多药耐药关系的研究[D].南宁:广西医科大学,2014.
[13] Kacperska MJ,Walenczak J,Tomasik B.Plasmatic microRNA as potential biomarkers of multiple sclerosis:literature review[J].Adv Clin Exp Med,2016,25(4):775-779.
[14] Liu J,Wu X,Liu H,et al.Expression of microRNA-30a-5p in drug-resistant and drug-sensitive ovarian cancer cell lines[J].Oncol Lett,2016,12(3):2065-2070.
[15] Zhu H,Yang SY,Wang J,et al.Evidence for miR-17-92 and miR-134 gene cluster regulation of ovarian cancer drug resistance[J].Eur Rev Med Pharmacol Sci,2016,20(12):2526-2531.
[16]Wu DD,Li XS,Meng XN,et al.MicroRNA-873 mediates multidrug resistance in ovarian cancer cells by targeting ABCB1[J].Tumour Biol,2016,37(8):10499-10506.
[17] 赵丽,曹成建,刘现梅,等.ERO1α及其DNA甲基化在同型半胱氨酸抑制肝细胞增殖中的作用[J].中国药理学通报,2014,30(12):1743-1747.
[18] Tsai CT,So CW.Epigenetic therapies by targeting aberrant histone methylome in AML:molecular mechanisms,current preclinical and clinical development[J].Oncogene,2017,36(13):1753-1759.
[19] Borley J,Brown R.Epigenetic mechanisms and therapeutic targets of chemotherapy resistance in epithelial ovarian cancer[J].Ann Med,2015,47(5):359-369.
[20] Strathdee G,MacKean MJ,Illand M,et al.A role for methylation of the hMLH1 promoter in loss of hMLH1 expression and drug resistance in ovarian cancer[J].Oncogene,1999,18(14):2335-2341.
(编辑:张元媛)
Expression Difference and Its Mechanisms of miR-497 and miR-34a in Platinum-sensitive and Platinum-resistant Epithelial Ovarian Carcinoma Patients
CAO Lijuan,LIU Wenbo(Dept.of Gynaecology and Obstetrics,Chengde Municipal Central Hospital,Hebei Chengde 067000,China)
OBJECTIVE:To investigate the expression difference and its mechanism of miR-497 and miR-34a in platinum-sensitive and platinum-resistant epithelial ovarian carcinoma(EOC)patients.METHODS:A total of 72 EOC patients underwent ovarian cancer staging surgery or cytoreductive surgery were selected from department of gynaecology and obstetriscs of our hospital during Jan.2008-Jan.2012.They
standardized platinum chemotherapy after surgery and were followed up(during Jul.2008-Jul.2016).According to the sensitivity to platinum,those patients were divided into platinum-sensitive group(42 cases)and platinum-resistant group(30 cases).Real-time fluorescent quantitative PCR was adopted to detect the expression of miR-497 and miR-34a in tumor tissue,and the relationship of it with total survival period was investigated.The levels of DNA methylation of miR-497 and miR-34a promoter region were determined by nest type land type methylation specific PCR.Western blot assay was used to detect the H3K9 dimethylation(H3K9me2)levels.The H3K9me2 levels of miR-497 and miR-34a promoter region were determined by chromatin immunoprecipitation method.RESULTS:The expression levels of miR-497 and miR-34a in platinum-sensitive group were significantly higher than platinum-resistant group,with statistical significance(P<0.05).Total survival period of 72 patients was(45.7±17.5)months,which was positively correlated with the expression levels of miR-497 and miR-34a(r2were 0.271 4,0.378 2,P<0.01).The DNA methylation of miR-497 and miR-34a promoter region in platinum-resistant group was significantly higher than platinum-sensitive group,and H3K9me2 level of promoter region was significantly higher than platinum-sensitive group,with statistical significance(P<0.05 or P<0.01).H3K9me2 levels of platinum-resistant group were slightly higher than that of platinum-sensitive group,but there was no statistical significance(P>0.05).CONCLUSIONS:The expression of miR-497 and miR-34a in tumor tissue of EOC patients are related to the sensitivity of platinum chemotherapy and the survival time of patients.DNA methylation and histone methylation of promoter region may be one of the mechanisms of their expression changes.
MicroRNAs;miR-497;miR-34a;Epithelial ovarian cancer;Platinum resistant;DNA methylation;Histone methylation;Promoter region
R737.31
A
1001-0408(2017)17-2308-06
2016-09-27
2017-04-20)
*副主任医师。研究方向:妇科肿瘤。电话:0314-2028107。E-mail:18603140900@wo.cn
DOI10.6039/j.issn.1001-0408.2017.17.02

