注射用丹参多酚酸与8种常用溶剂的配伍稳定性考察
周 岩,李德坤,周大铮,杨悦武,鞠爱春,王晓毅,叶正良#(1.天津医科大学药学院,天津300070;2.天津天士力之骄药业有限公司,天津 30002;3.天津市中药注射剂安全性评价企业重点实验室,天津 30002;.天津天士力集团研究院创新研究中心,天津 30002)
注射用丹参多酚酸与8种常用溶剂的配伍稳定性考察
周 岩1,2,3*,李德坤2,3,周大铮2,3,杨悦武2,3,鞠爱春2,3,王晓毅4,叶正良2,3#(1.天津医科大学药学院,天津300070;2.天津天士力之骄药业有限公司,天津 300402;3.天津市中药注射剂安全性评价企业重点实验室,天津 300402;4.天津天士力集团研究院创新研究中心,天津 300402)
目的:考察注射用丹参多酚酸与8种临床常用溶剂的配伍稳定性。方法:参照药品说明书,取注射用丹参多酚酸适量,分别与0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、复方氯化钠注射液、甘露醇注射液、甘油果糖氯化钠注射液、乳酸钠林格注射液、葡萄糖氯化钠注射液各250 mL配伍。在室温避光条件下,分别于配伍后0、1、2、4、8 h观察各配伍液的外观,检测其pH、不溶性微粒数、最大吸收波长和最大吸收度,并采用高效液相色谱法测定各配伍液中丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y的含量。结果:在上述条件下,各配伍液在8 h内外观和pH均无明显变化,最大吸收波长为284.5~286.0 nm。与甘露醇注射液配伍后,配伍液中粒径≥10 μm的微粒数(配伍后1~8 h)和≥25 μm的微粒数(配伍后4~8 h)均超出2015年版《中国药典》规定范围,最大吸收度变化明显(RSD=9.17%,n=5),且丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y相对百分含量的降幅均超过了10%(RSD分别为14.65%、6.45%、8.97%、12.49%,n=5);与乳酸钠林格注射液配伍后,配伍液中迷迭香酸和紫草酸的相对百分含量变化较大(RSD分别为14.57%、7.28%,n=5);与5%葡萄糖注射液配伍后4~8 h、与甘油果糖氯化钠注射液配伍后8 h,配伍液中迷迭香酸的相对百分含量均低于90%(RSD分别为6.30%、4.86%,n=5);与甘油果糖氯化钠注射液配伍后0 h,配伍液中粒径≥25 μm的微粒数超出药典标准;其他配伍液中不溶性微粒数均符合药典标准,最大吸收度变化不大(RSD<5%,n=5),且各待测物相对百分含量的变化均未超过10%。结论:临床应避免注射用丹参多酚酸与甘露醇注射液、乳酸钠林格注射液和甘油果糖氯化钠注射液配伍使用;与5%葡萄糖注射液配伍后应在4 h内使用;可与0.9%氯化钠注射液、10%葡萄糖注射液、复方氯化钠注射液、葡萄糖氯化钠注射液配伍使用。
注射用丹参多酚酸;配伍稳定性;高效液相色谱法;丹酚酸B;迷迭香酸;紫草酸;丹酚酸Y
注射用丹参多酚酸是以丹参的水溶性有效部位丹参多酚酸为活性成分的冻干粉注射剂,具有活血通络之效,可用于治疗轻中度脑梗死引起的半身不遂、口舌涡斜、舌强言蹇、偏身麻木等症状[1-2]。该药药品说明书指出,其用法用量为静脉滴注,临用前先以适量0.9%氯化钠注射液溶解,再用0.9%氯化钠注射液稀释至250 mL,每日1次,每次1支(含丹参多酚酸100 mg)。而临床常用溶剂包括5%葡萄糖注射液、葡萄糖氯化钠注射液、复方氯化钠注射液等。中药注射剂与常用溶剂可能存在配伍禁忌,导致配伍液颜色发生变化、大量不溶性微粒和絮状沉淀产生,影响患者用药安全[3-4]。目前,关于注射用丹参多酚酸临床安全使用方面的研究相对较少,且尚未深入探讨配伍后各成分含量的变化情况。因此,为增加注射用丹参多酚酸配伍溶剂的可选择性,本文考察了其与8种临床常用溶剂的配伍稳定性,现报道如下。
1 材料
1.1 仪器
1100型高效液相色谱仪(美国安捷伦科技公司);DR500型紫外-可见分光光度计(美国HACH公司);DX-2型pH计(杭州东星仪器设备厂);GWF-5J型微粒分析仪(天津天河分析仪器有限公司);XS105型精密电子分析天平[梅特勒-托利多仪器(上海)有限公司];Milli-Q型制水机(美国Milipore公司)。
1.2 药品与试剂
注射用丹参多酚酸[天津天士力之骄药业有限公司,批准文号:国药准字Z20110011,批号:20150302,规格:每支装0.13 g(含丹参多酚酸100 mg)];0.9%氯化钠注射液(批准文号:国药准字H37022336,批号:1401101904,规格:250 mL∶2.25 g)、复方氯化钠注射液(批准文号:国药准字H37022023,批号:1404210523,规格:500 mL∶氯化钠4.25 g、氯化钾0.15 g、氯化钙0.165 g)、甘露醇注射液(批准文号:国药准字H20033747,批号:1503242142,规格:250 mL∶50 g)、甘油果糖氯化钠注射液(批准文号:国药准字H20057114,批号:111070513,规格:250 mL∶甘油25 g、果糖12.5 g、氯化钠2.25 g)均购自辰欣药业股份有限公司;5%葡萄糖注射液(批准文号:国药准字 H13022474,批号:1406301302,规格:250 mL∶12.5 g)、10%葡萄糖注射液(批准文号:国药准字H13022477,批号:140610190,规格:500 mL∶50 g)、葡萄糖氯化钠注射液(批准文号:国药准字H13022490,批号:1410141902,规格:500 mL∶葡萄糖25 g、氯化钠4.5 g)均购自石家庄四药有限公司;乳酸钠林格注射液(中国大冢制药有限公司,批准文号:国药准字H12020009,批号:5B71F2,规格:500 mL);迷迭香酸对照品(批号:111871-201505,纯度:98.5%)、丹酚酸B对照品(批号:111562-201410,纯度:96.2%)均由中国食品药品检定研究院提供;紫草酸对照品(天津一方科技有限公司,批号:10092603,纯度:97.6%);丹酚酸Y对照品(实验室自制,纯度:99%);乙腈、磷酸为色谱纯,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 配伍液的制备 参照注射用丹参多酚酸药品说明书规定的临床使用浓度(130 mg∶250 mL),精密称取注射用丹参多酚酸各适量,分别使用“1.2”项下8种溶剂定容至250 mL量瓶中(见表1),于室温下避光保存,备用。

表1 各配伍液中注射用丹参多酚酸的加入量(mg)Tab 1 The amount of Salvianolic acid for injection added in each mixture(mg)
2.1.2 混合对照品溶液的制备 精密称取丹酚酸B对照品8.27 mg、迷迭香酸对照品1.26 mg、紫草酸对照品1.78 mg、丹酚酸Y对照品1.18 mg置于同一10 mL量瓶中,加流动相使其溶解,并稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤后,取续滤液,得丹酚酸B、迷迭香酸、紫草酸、丹酚酸Y质量浓度分别为0.827、0.126、0.178、0.118 mg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备 取“2.1.1”项下各配伍液适量,经0.22 μm微孔滤膜过滤后,得供试品溶液,备用。
2.2 含量测定
2.2.1 色谱条件 色谱柱:Agela XBP C18(250 mm×4.6 mm,5 μm);流动相:0.05%磷酸水溶液-乙腈(78∶22,V/ V);流速:0.7 mL/min;检测波长:288 nm;柱温:25 ℃;进样量:10 μL。
2.2.2 专属性考察 取各溶剂、混合对照品溶液、供试品溶液适量,按“2.2.1”项色谱条件进样分析。结果显示,丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y峰形良好,分离完全,详见图1。
2.2.3 标准曲线的绘制 精密量取“2.1.2”项下混合对照品溶液0.4、1、2、4、8、10 mL,分别置于10 mL量瓶中,用流动相稀释至刻度,摇匀,得丹酚酸B质量浓度为33.08、82.7、165.4、330.8、661.6、827 μg/mL,迷迭香酸质量浓度为5.04、12.6、25.2、50.4、100.8、126 μg/mL,紫草酸质量浓度为7.12、17.8、35.6、71.2、142.4、178 μg/mL,丹酚酸Y质量浓度为4.72、11.8、23.6、47.2、94.4、118 μg/mL的系列标准溶液,进样分析,记录色谱图。以各待测物峰面积(A)为纵坐标、质量浓度(c)为横坐标,进行线性回归。结果显示,丹酚酸B、迷迭香酸、紫草酸、丹酚酸Y的质量浓度分别在33.08~827、5.04~126、7.12~178、4.72~118 μg/mL范围内线性关系良好,详见表2。
2.2.4 精密度试验 精密量取“2.1.2”项下混合对照品溶液各1、4、8 mL,分别置于10 mL量瓶中,用流动相稀释至刻度,摇匀,得丹酚酸B低、中、高质量浓度(82.7、330.8、661.6 μg/mL),迷迭香酸低、中、高质量浓度(12.6、50.4、100.8 μg/mL),紫草酸低、中、高质量浓度(17.8、71.2、142.4 μg/mL),丹酚酸Y低、中、高质量浓度(11.8、47.2、94.4 μg/mL)的质控样品。各质量浓度样品重复测定3次,连续测定3 d,根据当日标准曲线计算其实测质量浓度,考察日内、日间精密度。结果显示,日内、日间RSD均小于3%(n=3),表明精密度良好,详见表3。
2.2.5 加样回收率试验 精密称取已知含量的同批次注射用丹参多酚酸各适量,置于10 mL量瓶中,再分别加入一定量的混合对照品溶液(相当于基底量的50%、100%、200%),每个质量浓度各3份,用流动相稀释并定容,按“2.2.1”项色谱条件进样分析,计算各样品的加样回收率。结果表示,各样品的加样回收率为97.1%~103.8%,RSD<3%(n=3)。
2.2.6 稳定性试验 精密量取“2.1.2”项下混合对照品溶液各1、4、8 mL,分别置于10 mL量瓶中,用流动相稀释至刻度,摇匀,在室温、避光条件下,分别于配制后0、3.5、7、10.5、14、18、24 h按“2.2.1”项色谱条件进样分析,记录色谱图,考察各混合对照品溶液的稳定性。精密称取注射用丹参多酚酸260 mg,加流动相溶解并定容至250 mL,得高质量浓度待测溶液;分别取该待测溶液5、2.5 mL,置于10 mL量瓶中,用流动相定容,得中、低质量浓度待测溶液。在室温、避光条件下,取上述3种质量浓度溶液,分别于配制后0、3.5、7、10.5、14、18、24 h按“2.2.1”项色谱条件进样分析,记录色谱图,考察各待测溶液的稳定性。结果显示,上述各溶液中丹酚酸B、迷迭香酸、紫草酸、丹酚酸Y峰面积的RSD均小于3%(n=7),表明溶液在24 h内稳定性良好。

图1 高效液相色谱图Fig 1 HPLC chromatograms
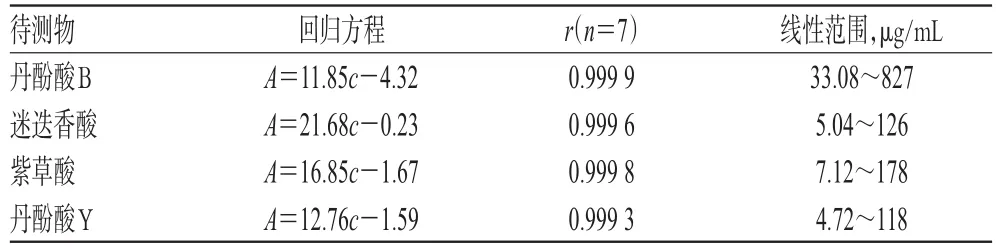
表2 回归方程和线性范围Tab 2 Regression equations and linear ranges
2.3 配伍稳定性试验
2.3.1 外观观察 在室温、避光条件下,分别于配制后0、1、2、4、8 h观察各配伍液的外观(颜色、气体、沉淀)变化情况。结果显示,注射用丹参多酚酸与8种溶剂配伍后8 h内,各配伍液均为淡黄色液体,颜色均无明显变化,且无沉淀、气体产生。
2.3.2 pH和不溶性微粒的测定 在室温、避光条件下,分别于配制后0、1、2、4、8 h采用pH计测定各配伍液的pH;参照2015年版《中国药典》(四部)通则中“不溶性微粒检测法”,采用光阻法测定上述时间点各配伍液中的不溶性微粒数,各样品重复测定3次[标示装量为100 mL及以上的静脉用注射液除另有规定外,每1 mL中含10 μm及以上(≥10 μm)的微粒数不得超过25粒,含25 μm及以上(≥25 μm)的微粒数不得超过3粒[5]]。
结果显示,注射用丹参多酚酸与8种溶剂配伍后8 h内,各配伍液的pH无明显变化(RSD<2%,n=5)。注射用丹参多酚酸与甘露醇注射液的配伍液中粒径≥10 μm的微粒数(配伍后1~8 h)和≥25 μm的微粒数(配伍后4~8 h)超出2015年版《中国药典》规定范围;与甘油果糖氯化钠注射液的配伍液中的粒径≥25 μm的微粒数(配伍后0 h)超出药典标准;其他配伍液中的粒径≥10 μm和≥25 μm的微粒数均符合规定,详见表4、表5。
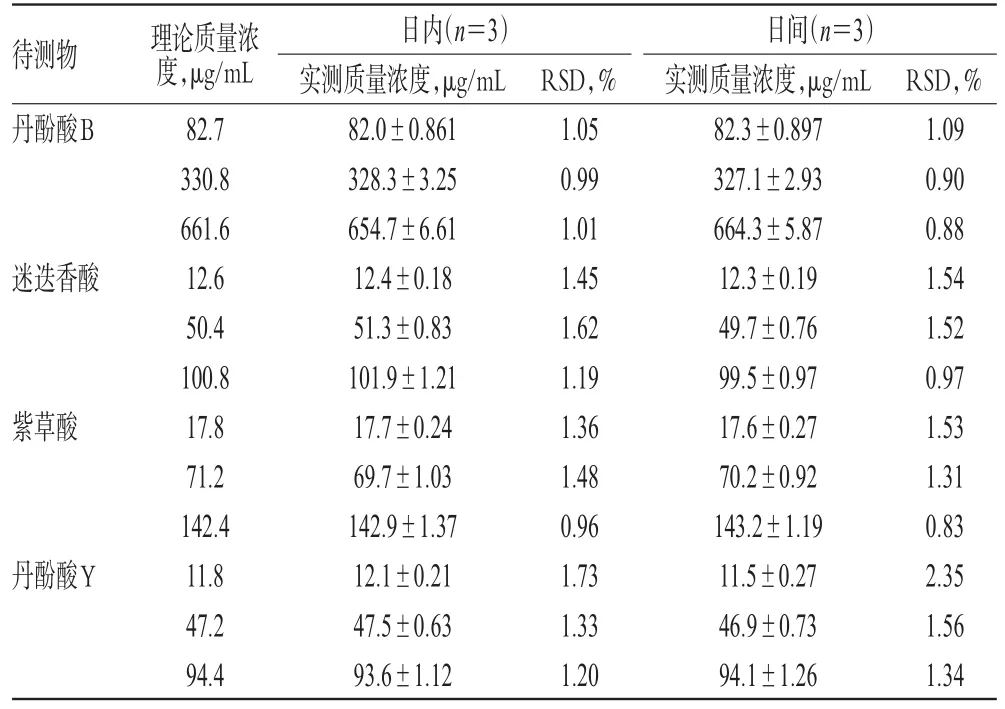
表3 精密度试验结果Tab 3 Results of precision tests

表4 各配伍液的pHTab 4 The pH value of different mixtures
表5 各配伍液中的不溶性微粒数(s,n=3,粒/mL)Tab 5 The number of insoluble particles of different mixtures(s,n=3,grain/mL)
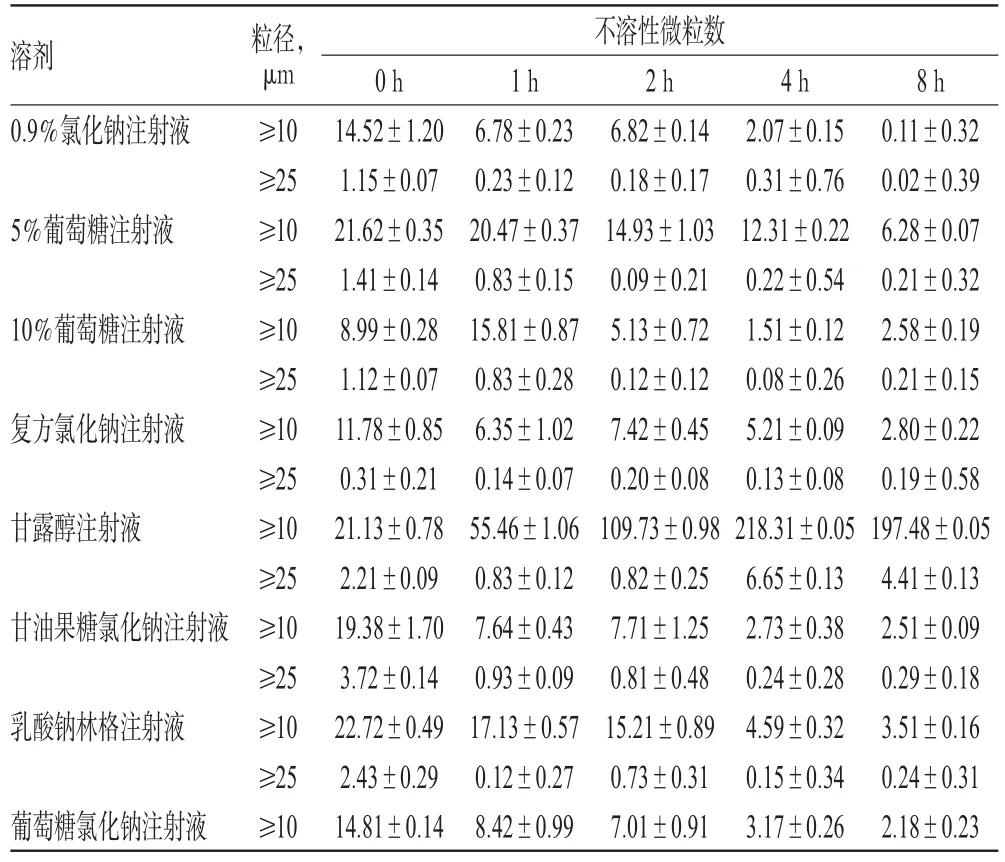
表5 各配伍液中的不溶性微粒数(s,n=3,粒/mL)Tab 5 The number of insoluble particles of different mixtures(s,n=3,grain/mL)
溶剂0.9%氯化钠注射液不溶性微粒数5%葡萄糖注射液10%葡萄糖注射液复方氯化钠注射液甘露醇注射液甘油果糖氯化钠注射液乳酸钠林格注射液葡萄糖氯化钠注射液粒径,μm≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10 0 h 14.52±1.20 1.15±0.07 21.62±0.35 1.41±0.14 8.99±0.28 1.12±0.07 11.78±0.85 0.31±0.21 21.13±0.78 2.21±0.09 19.38±1.70 3.72±0.14 22.72±0.49 2.43±0.29 14.81±0.14 1 h 6.78±0.23 0.23±0.12 20.47±0.37 0.83±0.15 15.81±0.87 0.83±0.28 6.35±1.02 0.14±0.07 55.46±1.06 0.83±0.12 7.64±0.43 0.93±0.09 17.13±0.57 0.12±0.27 8.42±0.99 2 h 6.82±0.14 0.18±0.17 14.93±1.03 0.09±0.21 5.13±0.72 0.12±0.12 7.42±0.45 0.20±0.08 109.73±0.98 0.82±0.25 7.71±1.25 0.81±0.48 15.21±0.89 0.73±0.31 7.01±0.91 4 h 2.07±0.15 0.31±0.76 12.31±0.22 0.22±0.54 1.51±0.12 0.08±0.26 5.21±0.09 0.13±0.08 218.31±0.05 6.65±0.13 2.73±0.38 0.24±0.28 4.59±0.32 0.15±0.34 3.17±0.26 8 h 0.11±0.32 0.02±0.39 6.28±0.07 0.21±0.32 2.58±0.19 0.21±0.15 2.80±0.22 0.19±0.58 197.48±0.05 4.41±0.13 2.51±0.09 0.29±0.18 3.51±0.16 0.24±0.31 2.18±0.23

?
2.3.3 紫外吸收光谱检测 在室温、避光条件下,分别于配制后0、1、2、4、8 h对各配伍液进行全波长扫描(200~500 nm),测定其最大吸收波长和最大吸收度。结果显示,注射用丹参多酚酸与8种溶剂配伍后,各配伍液的最大吸收波长为284.5~286.0 nm;注射用丹参多酚酸与甘露醇注射液配伍后,最大吸收度发生明显变化(RSD=9.17%,n=5),而其他配伍液的最大吸收度无明显变化(RSD<5%,n=5),详见表6。
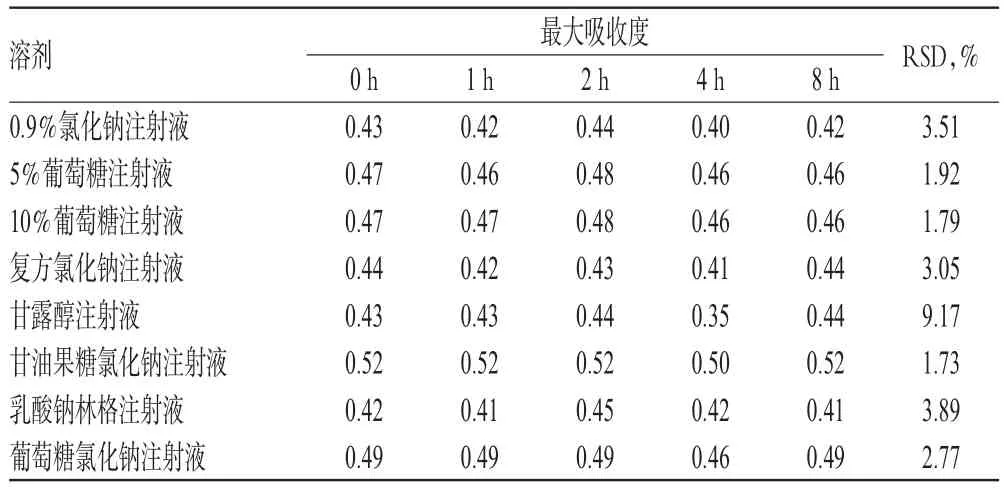
表6 各配伍液的最大吸收度Tab 6 The maximal absorbance of different mixtures
2.3.4 相对百分含量的测定 在室温、避光条件下,分别于配制后0、1、2、4、8 h采用“2.2”项下方法测定各配伍液中丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y的质量浓度。以0 h的质量浓度为100%,换算出其他时间点的相对百分含量。根据注射用丹参多酚酸产品内部质量控制标准的要求,丹酚酸B、迷迭香酸、紫草酸相对百分含量的变化不能超过10%。含量测定结果显示,注射用丹参多酚酸与甘露醇注射液配伍后,配伍液中丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y的相对百分含量变化较大(RSD分别为14.65%、6.45%、8.97%、12.49%,n=5),且这4种成分相对百分含量在配伍后8 h的降幅均超过了10%;与乳酸钠林格注射液配伍后,配伍液中迷迭香酸和紫草酸的相对百分含量变化较大(RSD分别为14.57%、7.28%,n=5),且在配伍后1 h迷迭香酸的相对百分含量增加了47.37%;与5%葡萄糖注射液配伍后4~8 h、与甘油果糖氯化钠注射液配伍后8 h,迷迭香酸的相对百分含量均低于90%(RSD分别为6.30%、4.86%,n=5);其他配伍液中各待测物相对百分含量的变化均未超过10%,详见表7。
3 讨论
注射用丹参多酚酸在临床使用中为常温现配现用,无避光要求。本研究考察了配伍后8 h内的溶液稳定性,由于注射用丹参多酚酸中主要成分丹酚酸B不稳定,见光易分解,因此在试验过程中,将各配伍液置于常温条件下避光保存。
中药注射剂在临床使用过程中,易受温度、pH、光照、联合用药等因素的影响,主要表现为颜色变化、产生沉淀、不溶性微粒数超标、主要成分含量变化等[4,6]。如以丹参为原料的复方丹参注射液与10%葡萄糖注射液、0.9%氯化钠注射液、葡萄糖氯化钠注射液配伍后,不溶性微粒数超标[7];香丹注射液与5%葡萄糖注射液配伍后,不溶性微粒数超标[8]。不溶性微粒会引发静脉炎、血管堵塞、肉芽肿、动脉硬化、热原反应等,大分子微粒还会导致过敏反应,并产生肿块;当不溶性微粒粒径大于人体最小的毛细血管直径时,会产生增生反应,形成肉芽肿或栓塞,大量的肉芽肿会直接影响脑、肺、心、肾等器官的正常生理功能,甚至会危及生命[9-10]。2015年版《中国药典》明确规定了静脉用注射液中粒径≥10 μm和≥25 μm的微粒数量,以规范其质量。本研究结果显示,注射用丹参多酚酸与甘露醇注射液的配伍液中粒径≥10 μm(配伍后1~8 h)和≥25 μm(配伍后4~8 h)的不溶性微粒数均超过药典规定,其原因可能为:(1)甘露醇注射液是甘露醇在常温下的过饱和溶液,加入注射用丹参多酚酸后,其中的辅料会导致过饱和的甘露醇溶液析出纤细结晶,使配伍液中的不溶性微粒增加[11];(2)无机盐如氯化钠和氯化钾等的加入会导致甘露醇注射液中的甘露醇析出,注射用丹参多酚酸中含有约7%的无机盐,两者配伍后,使甘露醇析出,导致配伍液中的不溶性微粒增加[12]。因此,注射用丹参多酚酸不宜与甘露醇注射液配伍使用。注射用丹参多酚酸与甘油果糖氯化钠注射液的配伍液(0 h)中粒径≥25 μm的微粒数超出药典标准,推测可能受到甘油果糖氯化钠注射液中甘油、果糖等成分的影响,使得丹酚酸B、迷迭香酸等未完全溶解,致使配伍液中微粒数增加;而随着放置时间的延长,配伍液中上述成分逐渐溶解,使得不溶性微粒数逐渐减少[10]。

表7 各配伍液中丹酚酸B、迷迭香酸、紫草酸和丹酚酸Y的相对百分含量Tab 7 The relative content of salvianolic acid B,rosmarinic acid,lithospermic acid and salvianolic acid Y in different mixtures
丹酚酸B、迷迭香酸、紫草酸的含量为注射用丹参多酚酸内部质量控制标准中所需检测的成分,且三者的含量约占80%;此外有研究表明,丹酚酸Y对心脑血管疾病具有积极的治疗作用,且抗氧化应激作用亦明显强于丹酚酸B[13]。因此,本研究选择丹酚酸B、迷迭香酸、紫草酸、丹酚酸Y作为配伍稳定性含量变化考察的目标成分。结果显示,注射用丹参多酚酸与甘露醇注射液配伍后,上述4种主要成分的相对百分含量发生较大变化;与乳酸钠林格注射液配伍后,迷迭香酸和紫草酸的相对百分含量变化明显;与5%葡萄糖注射液、甘油果糖氯化钠注射液配伍并长时间放置后,迷迭香酸的相对百分含量均降至88.82%。同时笔者还发现,有些成分的相对百分含量高于初始含量,有些成分的相对百分含量先升高后降低,推测原因可能是注射用丹参多酚酸中各酚酸类成分可通过水解等反应相互转化,例如其主要成分丹酚酸B可发生酯键水解生成紫草酸和丹参素,紫草酸呋喃环开环后生成丹酚酸D和原儿茶醛,导致注射用丹参多酚酸溶解后各成分含量不稳定[14-15]。
中药注射剂由于自身成分复杂、受原料药和辅料影响较大、临床使用不规范等因素,导致其不良反应报告在药品不良反应报告中占据很大的比例,中药注射剂占中成药不良反应/事件报告总数的50.9%,其严重不良事件报告占中药严重不良事件报告总数的87.2%[16]。本研究综合外观、pH、不溶性微粒数、最大吸收波长和吸收度、4种主要成分的含量等多项指标,对注射用丹参多酚酸与8种临床常用注射液的配伍稳定性进行全面考察,为临床合理应用提供了依据。在本试验中,需保证避光操作,防止注射用丹参多酚酸溶解后,配伍液中的酚酸类成分见光分解,影响试验结果;在不溶性微粒测定前,需搅拌后静置,防止气泡影响微粒的检查。
综上所述,注射用丹参多酚酸不宜与甘露醇注射液、乳酸钠林格注射液和甘油果糖氯化钠注射液配伍使用;与5%葡萄糖注射液配伍后应在4 h内使用;可与0.9%氯化钠注射液、10%葡萄糖注射液、复方氯化钠注射液、葡萄糖氯化钠注射液配伍使用。由于条件限制,本研究未能完全模拟临床药物配制情形,可能会对不溶性微粒的检查结果有所影响;此外,在研究中还发现,配伍液中有些成分的含量波动较大,推测是由于其中的酚酸类成分不稳定、相互转化所致,故有待对其转化过程和机制进行进一步探讨。
[1] 杨淑萍.中药丹参药理作用研究进展[J].医药前沿,2013(29):149-151.
[2] 周凤,邓幼清,陈小红,等.注射用丹参多酚酸治疗脑梗死恢复期(瘀血阻络型)临床研究[J].实用中西医结合临床,2013,13(8):8-9、13.
[3] 苏秀玲.中药注射剂溶剂的选择与配伍禁忌[J].海峡药学,2015,27(3):213-214.
[4] 石浩强,许倍铭,葛覃.从溶剂的选择谈安全使用中药注射剂[J].中国药房,2012,23(43):4125-4126.
[5] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:114-115.
[6] 蔡楚华.6种常用中药注射液与溶剂配伍前后不溶性微粒的测定[J].中国药房,2013,24(27):2560-2562.
[7] 王华强,王灵芝,王秀丽.丹参类注射液临床配伍禁忌[J].山东中医杂志,2012,31(4):299-301.
[8] 任贵香,刘学逊.香丹注射液与输液配伍的稳定性[J].中国民族民间医药,2009,18(19):22.
[9] 梁慧慧,陈昕怡,钱江辉,等.注射剂中不溶性微粒的测定及其对微循环功能的影响[J].中国药房,2015,26(10):1369-1372.
[10] 陈瑞芳.不同条件下几种抗菌药物和中药注射粉针不溶性微粒的试验研究[D].长沙:中南大学,2013.
[11] 李丽,段建瑞.静脉输注甘露醇致静脉炎的护理干预效果观察[J].全科护理,2012,10(7):631-632.
[12] 郭世彪,张文军,程春梅.两种常用注射溶剂配伍禁忌[J].中国药物与临床,2010,10(2):234-235.
[13] Gong J,Ju A,Zhou D,et al.Salvianolic acid Y:a new protector of PC12 cells against hydrogen peroxide-induced injury from Salvia officinalis[J].Molecules,2015,20(1):683-692.
[14] 黄世超.若干丹参酚酸的降解和解离性质研究[D].杭州:浙江大学,2016.
[15] Guo YX,Zhang DJ,Wang H,et al.Hydrolytic kinetics of lithospermic acid B extracted from roots of Salvia miltiorrhiza[J].J Pharm Biomed Anal,2007,43(2):435-439.
[16] 毕凤兰,张力.中药注射剂安全性问题探讨[J].中国药物警戒,2012,9(2):89-92.
(编辑:张元媛)
Compatibility Stability of Salvianolic Acid for Injection Combined with 8 Kinds of Common Solvents
ZHOU Yan1,2,3,LI Dekun2,3,ZHOU Dazheng2,3,YANG Yuewu2,3,JU Aichun2,3,WANG Xiaoyi4,YE Zhengliang2,3(1.School of Pharmacy,Tianjin Medical University,Tianjin 300070,China;2.Tianjin Tasly Pride Pharmaceutical Co.,Ltd.,Tianjin 300402,China;3.Tianjin Key Laboratory of Safety Evaluation Enterprise of TCM Injections,Tianjin 300402,China;4.Tianjin Tasly Academy Innovative Center,Tianjin 300402,China)
OBJECTIVE:To investigate the compatibility stability of Salvianolic acid for injection(SAFI)combined with 8 kinds of common solvents.METHODS:Referring to package inserts,SAFI was collected and combined with 0.9%Sodium chloride injection,5%Glucose injection,10%Glucose injection,Compound sodium chloride injection,Mannitol injection,Glycerol fructose and sodium chloride injection,Sodium lactate Ringer’s injection,Glucose and sodium chloride injection,250 mL each respectively,and then sealed in the dark at the room temperature.The appearance of mixtures were observed,pH value,the number of insoluble particles,maximal absorption wavelength and maximal absorbance were detected,and the contents of salvianolic acid B,rosmarinic acid,lithospermic acid and salvianolic acid Y in mixtures were determined by HPLC at 0,1,2,4,8 h after mixing.RESULTS:Under above condition,no obvious change was found in appearance or pH values of the mixtures within 8 h.Maximal absorption wavelength ranged 284.5-286.0 nm.After mixed with Mannitol injection,the number of particles≥10 μm(1-8 h after mixing)and particles≥25 μm(4-8 h after mixing)exceeded the scope of Chinese Pharmacopoeia(2015 edition);the maximal absorbance changed significantly(RSD=9.17%,n=5);the relative content of salvianolic acid B,rosmarinic acid,lithospermic acid and salvianolic acid Y decreased by more than 10%(RSD=14.65%,6.45%,8.97%,12.49%,n=5);after mixed with Sodium lactate Ringer’s injection,the relative content of rosmarinic acid and lithospermic acid changed greatly(RSD=14.57%,7.28%,n=5);after mixed with 5%Glucose injection(4-8 h after mixing)and Glycerol fructose and sodium chloride injection(8 h after mixing),the relative content of rosmarinic acid were less than 90%(RSD=6.30%,4.86%,n=5);and the number of particles≥25 μm exceeded the scope of phamcopoeia after mixing with Glycerol fructose and sodium injection(0 h).The number of insoluble particles in other mixtures were in line with the standard of pharmacopoeia;maximal absorbance had no significant change(RSD<5%,n=5),and the relative content change of analytes were all less than 10%.CONCLUSIONS:Clinical application of SAFI combined with Mannitol injection,Sodium lactate Ringe’s injection and Glycerol fructose and sodium injecrion should be avoided.After mixed with 5%Glucose injection,SAFI should be used within 4 h.SAFI can be compatible with 0.9% Sodium chloride injection,10%Glucose injection,Compound sodium chloride injection and Glucose and sodium chloride injection.
Salvianolic acid for injection;Compatibility stability;HPLC;Salvianolic acid B;Rosmarinic acid;Lithospermic acid;Salvianolic acid Y
R969.3
A
1001-0408(2017)17-2350-07
2016-11-06
2017-03-31)
*硕士研究生。研究方向:中药注射剂质量控制。电话:022-84498198。E-mail:zhouyantjmu@163.com
#通信作者:研究员,硕士生导师,博士。研究方向:中药注射剂工艺及质量控制。电话:022-86342066。E-mail:yezl@tasly.com
DOI10.6039/j.issn.1001-0408.2017.17.13

