微粒在脂代谢紊乱介导的靶器官损害中作用的研究进展
芦琛琛,马坤岭
(东南大学附属中大医院 肾内科,江苏 南京 210009)
·综 述·
微粒在脂代谢紊乱介导的靶器官损害中作用的研究进展
芦琛琛,马坤岭
(东南大学附属中大医院 肾内科,江苏 南京 210009)
脂代谢紊乱对动脉粥样硬化、冠心病、脂肪肝、糖尿病及其并发症等常见疾病的发生、发展有重要的影响。微粒是在细胞活化、凋亡过程中以出芽方式从细胞膜上脱落的微小囊泡,与脂代谢紊乱有着密切联系。作者就微粒在脂代谢紊乱介导的靶器官损害中作用的研究进展进行综述。
微粒; 脂代谢紊乱; 靶器官损害; 文献综述
脂代谢紊乱是许多重大疾病的关键性致病因素之一,严重威胁公众健康。有调查显示,存在脂代谢紊乱的患者发生靶器官损害的风险更大。因此,积极探索针对脂代谢紊乱的更加有效的治疗方法和预防措施,已成为目前代谢性疾病研究领域的重大课题。
近年来,对微粒(microparticle,MP)的研究逐渐成为热点。MP是在细胞活化、凋亡过程中形成的直径0.1~1 μm的微小囊泡,其内包含多种活性成分,在多方面发挥着重要的生物学功能。针对MP和脂代谢紊乱的研究有助于阐明二者之间的联系,加深人们对脂代谢紊乱性疾病的理解。MP的研究为脂代谢紊乱及其所介导的靶器官损害开辟了新的研究靶点,也为该类疾病的发生、发展提供了新的视角。
1 MP
MP(也称微颗粒或微泡)的概念在1967年被Wolf以“platelet dust”的形式首次提出[1]。经过数十年的深入研究,MP不再被认为是无功能的细胞代谢产物,而是被定义为自细胞膜脱落的、包含多种生物活性成分的无核微小囊泡。几乎所有的真核细胞都能够释放MP,而血循环中的MP绝大部分来源于血小板。即使形状和大小相似,由不同细胞释放的MP也具备不同的生物活性和功能。MP可存在于健康人的外周血中,但在许多疾病情况下,MP的水平明显升高,反映出它潜在的研究价值。
1.1 MP的产生
多种因素(如细胞因子、凝血酶、内毒素、低氧和切应力等)能够刺激MP的产生,但具体的机制尚不清楚。MP的产生主要有细胞的活化和凋亡两条途径。即使来源于同种类型的细胞,经这两条途径分别生成的MP在表型和数量上都存在差异。
在正常静息的真核细胞中,细胞膜的双分子层有其特定的脂质结构,即磷脂酰丝氨酸(phosphatidylserine,PS)主要存在于膜内层。细胞对活化刺激作出反应而生成MP的过程,最开始表现为细胞质内的钙离子浓度经刺激因素调节而升高,随即移位酶和混杂酶被激活、翻转酶的活性被抑制,这3种蛋白酶可控制PS的移动和转运,使得PS由细胞膜内层移动到外层;同时,钙调蛋白酶被激活,细胞骨架蛋白降解,细胞膜囊泡化、脱落而产生MP[2]。
当前研究多着重于探索由血循环中的血小板、内皮细胞、淋巴细胞等产生的MP,实际上非循环细胞如肿瘤细胞、间充质干细胞等也可产生MP。除此以外,在特定的病理条件下,脂肪细胞、成纤维细胞等也可成为MP的来源。
1.2 MP的组成

1.3 MP的摄取与清除
MP的释放可看作是一种清除应激信号的细胞保护性机制,这种机制在机体存在血管性疾病时被观测到有明显的减弱。Jansen等[6]指出,内皮细胞凋亡过程中的MP释放,可作为避免邻近内皮细胞受到更多损伤的一种反馈性保护机制。被释放的MP一般停留在其母本细胞附近的胞外间隙,或进入体液循环而被不同细胞摄取来发挥其生物学作用。内皮细胞就可通过膜联蛋白I/PS受体依赖途径摄取MP,抑制p38的激活来减弱靶细胞的凋亡。每种来源的MP都会在其表面表达黏附分子,这些黏附分子也可能会影响到靶细胞对MP的摄取[7]。
1.4 MP的检测手段
现阶段用于检测MP的技术有很多种,但MP的大小差异、低折射率、动态测量范围的限定以及样品处理方法等诸多因素都限制了检测结果的准确性。
目前最常用的检测方法是流式细胞术。流式细胞术可利用动态光散射(dynamic light scattering, DLS)对MP进行按直径分布的定量分析,也可通过针对细胞表面抗原的荧光标记抗体来确定MP的母本细胞种类并进行计数[11]。
另外,电阻脉冲法(resistive pulse sensing, RPS)、电子显微镜(electron microscope, EM)、纳米粒子跟踪分析(nanoparticle tracking analysis, NTA)以及免疫印迹法和蛋白质组学分析等技术在MP的研究中亦有广泛应用。篇幅有限,在此不作赘述。
2 MP的生物学作用
2.1 MP与炎症

2.2 MP与凝血过程
2.3 MP与血管生成
另一方面,早期即有体外实验证实,病理状态下的高浓度EMP可诱导内皮细胞的凋亡,影响毛细血管网的形成,这一作用可能与增强的氧化应激相关。研究表明,EMP不仅可通过抑制心脏内皮NO合酶(endothelial NO synthase,eNOS)来抑制血管生成,且可加强高胆固醇血症抑制血管生成的作用[20]。
2.4 MP在靶细胞间的交流作用
目前对MP的研究大多得出的是观察性结论,对其具体的作用机制尚无确切的说法。然而,近年来越来越多的关注集中于MP在细胞间的crosstalk中所发挥的作用,这很可能成为我们阐明MP作用机制的一个切入点。
2.4.2 MP通过受体与靶细胞表面结合 存在于MP与靶细胞之间的紧密相互作用会引起一种近分泌形式的信号传导,而MP能够将这种信号传送至较远的靶细胞,或是去激活对这种信号传导起到调节作用的生物活性物质。MP对膜受体的转运可改变靶细胞的表型,提高靶细胞对不同活化刺激的敏感性[2]。
3 MP在脂代谢紊乱介导的靶器官损害中的作用

3.1 MP在脂代谢紊乱介导的心血管疾病发生中的作用
血脂异常是心血管疾病(cardiovascular diseases,CVD)的主要危险因素之一。动脉粥样硬化及其不稳定斑块破裂以及在此基础上血栓的形成,是发生心血管事件的重要原因。

3.2 MP在脂代谢紊乱介导的肝损伤中的作用

3.3 MP在脂代谢紊乱介导的肾损伤中的作用
慢性肾脏疾病(chronic kidney disease, CKD)如糖尿病肾病(diabetic nephropathy, DN)、肾病综合征等都伴有脂代谢紊乱的表现,而血脂异常亦可加速肾脏疾病的发生与发展。研究表明,处于CKD 3~4期的DN患者在接受降脂治疗后,其体内促凝性MP的数量明显减少,有利于降低其动脉粥样硬化并发症的发生率。
有研究指出,DN患者所存在的脂代谢紊乱与肾脏病变和糖代谢紊乱均相关,相比于单纯的肾病患者有更强的危害性。有研究观测到,肾脏足细胞在机械牵拉和高糖应激的情况下可产生MP,这些MP可早于蛋白尿作为糖尿病肾脏损害的早期标志物。此外,氧化应激在糖尿病及其并发症的发展过程中有重要地位,高糖状态下机体可由多种通路产生ROS,引起细胞和组织的损伤。近来也有文献报道,内皮细胞MP含有NADPH氧化酶的多个亚单位,能够产生ROS来引发内皮细胞损伤和血管炎症[30]。
4 结 语
作为机体内细胞活化和凋亡过程的产物,MP所具备的多种重要生物学功能毋庸置疑,在未来的临床工作中有着广阔的应用前景。然而目前我们对MP的认识和了解有限,因此,对其作用机制的深入研究,有助于我们进一步理解MP与疾病间的密切联系,从而探索更加有效的病情监测方法和治疗措施。


[8] LITVACK M L,POST M,PALANIYAR N.IgM promotes the clearance of small particles and apoptotic microparticles by macrophages[J].PLoS One,2011,6(3):e17223.
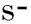
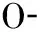










国家自然科学基金资助项目(81470957);江苏省自然科学基金资助项目(BK20141343)
R589.2
A



