外源性硫化氢对高糖诱导的肾小管上皮细胞凋亡的影响
刘爱东,王 箐,田 琳,刘晓红,曾俊伟
(1.遵义医学院 生理学教研室,贵州 遵义 563099;2.遵义医学院 机能学实验室,贵州 遵义 563099)
基础医学研究
外源性硫化氢对高糖诱导的肾小管上皮细胞凋亡的影响
刘爱东1,王 箐2,田 琳2,刘晓红1,曾俊伟1
(1.遵义医学院 生理学教研室,贵州 遵义 563099;2.遵义医学院 机能学实验室,贵州 遵义 563099)
目的 观察硫氢化钠(NaHS,外源性的H2S供体)对低糖和高糖环境下的人肾小管上皮细胞(HK-2)凋亡的影响。方法 传代培养人近曲肾小管上皮细胞,细胞用无血清培养基同步化24 h后,将细胞分为8组:低糖对照组(5.5 mmol/L D-葡萄糖、低糖+不同剂量NaHS组(50、100、200 μmol/L)、高糖组(40 mmol/L D-葡萄糖)、高糖+不同剂量NaHS组(50、100、200 μmol/L)。将细胞置于37 ℃,5%CO2培养箱中刺激培养24、48 h,收集细胞。用流式细胞仪测定细胞凋亡率。结果 ①刺激培养24、48 h,低糖+不同剂量NaHS组HK-2细胞凋亡率明显低于低糖对照组(P<0.05),以NaHS中剂量组降低明显。②高糖刺激培养24、48 h,高糖组细胞HK-2细胞凋亡率明显高于低糖对照组(P<0.01)。③高糖+不同剂量NaHS组HK-2细胞凋亡率明显低于高糖组(P<0.05),以NaHS中剂量组降低明显。结论 NaHS能抑制低糖条件下肾小管上皮细胞的凋亡以及高糖诱导的肾小管上皮细胞的凋亡,有助于糖尿病肾病的治疗。
硫化氢;肾小管上皮细胞;细胞凋亡;高剂量葡萄糖;糖尿病肾病
糖尿病患者中约30%以上会出现糖尿病肾病(diabetic nephropathy,DN),DN是导致终末期肾病的重要原因。其发病机制复杂,至今仍未完全明确,有研究表明细胞凋亡参与DN发生机制[1]。细胞凋亡是机体内细胞死亡的重要途径,当细胞凋亡调控失衡时,可促进糖尿病肾病的发生和发展[2]。H2S作为一种新型的气体信号分子,具有较强的抗炎症、抗氧化应激和抗细胞凋亡等生理功能[3]。研究表明,外源性NaHS给予糖尿病大鼠能够改善肾功能指标和病理结构损伤及细胞凋亡[4-5]。因此,我们在体外培养肾小管上皮细胞,观察NaHS在低糖条件下和高糖诱导下对肾小管上皮细胞凋亡的影响。
1 材料与方法
1.1 材料与仪器 人近曲肾小管上皮细胞株(HK-2)购于上海生命科学院;NaHS购于Sigma公司;DMEM培养基和FBS购于Hyclone公司;青链双抗购于上海生工生物工程有限公司;D-葡萄糖购于阿拉丁试剂(上海)有限公司,DMSO(二甲基亚砜)购于Sigma公司;Annexin V-FITC/PI试剂盒购于上海贝博生物公司。
细胞培养箱(美国Thermo,型号:Labserv CO-150);超净工作台(苏州安泰科技有限公司);离心机(1.德国Eppendorf公司,型号:5418);流式细胞仪(美国BD Biosciences,型号:BD FACSVerseTM)。
1.2 方法
1.2.1 细胞培养 取冻存的HK-2细胞,37 ℃快速解冻后,161.0g离心5 min,用DMEM培养基清洗2次后用DMEM基础培养基重悬后再离心;加入完全培养基进行培养,每天换1次培养基;待细胞长满后调整细胞浓度为2×105个/mL,接种于6孔培养板,每孔1 mL,37 ℃,5% CO2培养箱内培养24 h。
1.2.2 实验分组与处理 待同步化培养24 h后,将细胞分为8 组:①低糖对照组(5.5 mmol/L D-葡萄糖);②低糖+NaHS低剂量组(5.5 mmol/L D-葡萄糖+50 μmol/L NaHS);③低糖+NaHS中剂量组(5.5 mmol/L D-葡萄糖+100 μmol/L NaHS);④低糖+NaHS高剂量组(5.5 mmol/L D-葡萄糖+200 μmol/L NaHS);⑤高糖组(40mmol/L D-葡萄糖);⑥高糖+NaHS低剂量组(40 mmol/L D-葡萄糖+50 μmol/L NaHS);⑦高糖+NaHS中剂量组(40 mmol/L D-葡萄糖+100 μmol/L NaHS);⑧高糖+NaHS高剂量组(40 mmol/L D-葡萄糖+200 μmol/L NaHS);每组设3个复孔。放置37 ℃,5% CO2培养箱内培养24、48 h后,收集细胞用于后续实验。
1.2.3 流式细胞术测定HK-2细胞凋亡率 用不含EDTA的胰酶消化收集后,室温下251.6g离心5 min,收集细胞;用4 ℃预冷1×PBS溶液重悬细胞1次,251.6g离心5 min,洗涤细胞。加入300 μL 1×Binding Buffer悬浮细胞。在重悬液中加入5 μL Annexin V-FITC混匀后,避光,室温孵育15 min;再加入10 μL PI染色,轻轻混匀细胞,于避光条件下室温孵育10 min。上流式细胞仪进行检测,CELL Quest软件分析。
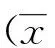
2 结果
2.1 NaHS对低糖条件下HK-2细胞凋亡的影响 细胞培养24和48 h均表现为低糖+NaHS低、中、高剂量组HK-2细胞凋亡率明显低于低糖对照组(P<0.05),以低糖+NaHS中剂量组凋亡率降低明显(P<0.01和P<0.05,见表1、图1~2)。


组别细胞培养时间(h)2448低糖对照22.19±0.3522.31±0.56低糖+NaHS低剂量15.91±0.85*18.19±0.63*低糖+NaHS中剂量7.98±0.64#12.74±0.49*低糖+NaHS高剂量10.35±0.71*15.74±0.84*
与低糖对照组比较,*P<0.05,#P<0.01。

A:低糖对照组;B:低糖+NaHS低剂量组;C:低糖+NaHS中剂量组;D:低糖+NaHS高剂量组。图1 在低糖培养下24 h各组HK-2细胞凋亡情况

A:低糖对照组;B:低糖+NaHS低剂量组;C:低糖+NaHS中剂量组;D:低糖+NaHS高剂量组。图2 在低糖培养下48 h各组HK-2细胞凋亡情况
2.2 NaHS对高糖诱导下HK-2细胞凋亡的影响 细胞培养24和48 h均表现为高糖组HK-2细胞凋亡率明显高于低糖对照组(P<0.01),高糖+NaHS低、中、高剂量组HK-2细胞凋亡率明显低于高糖组(P<0.05),以高糖+NaHS中剂量组凋亡率降低明显(P<0.01,见表2、图3~4)。


组别细胞培养时间(h)2448低糖对照22.19±0.3522.31±0.56高糖50.26±0.83**57.59±0.68**高糖+NaHS低剂量40.57±0.65#45.72±0.75#高糖+NaHS中剂量23.12±0.79##35.08±0.47##高糖+NaHS高剂量36.19±0.56#39.41±0.48#
与低糖对照组比较,**P<0.01;与高糖组比较,#P<0.05,##P<0.01。

A:低糖对照组;B:高糖组;C:高糖+NaHS低剂量组;D:高糖+NaH中剂量组;E:高糖+NaHS高剂量组。图3 高糖诱导下24 h各组HK-2细胞凋亡情况

A:低糖对照组;B:高糖组;C:高糖+NaHS低剂量组;D:高糖+NaH中剂量组;E:高糖+NaHS高剂量组。图4 高糖诱导下48 h各组HK-2细胞凋亡情况
3 讨论
H2S作为一种新型的气体信号分子,具有较强的抗炎症、抗氧化应激和抗细胞凋亡等生理功能[3]。NaHS是外源性H2S供体硫化盐的一种,在溶液中可分离出Na+和HS-,随后HS-和H+生成H2S。NaHS作为H2S供体已经广泛应用于H2S的研究当中。
DN是糖尿病严重的微血管并发症,也是导致慢性肾功能衰竭的主要原因。高血糖是公认的在DN中起关键作用的因子,在DN发展过程中,既往研究表明,肾小球损伤是DN的主要发病机制。近来的研究表明,肾小管结构或功能的损伤在早期糖尿病肾病的形成中具有重要作用[6],肾小管损伤可能早于肾小球损伤[7]。有研究表明,内源性H2S产生过少与糖尿病的发生有关[8-9],在糖尿病患者以及糖尿病大鼠血液中,H2S的含量显著降低[10-11],高糖导致糖尿病大鼠和HK-2细胞凋亡,给予外源性H2S能够减轻糖尿病大鼠肾脏的损伤和抑制细胞的凋亡[4-5],换言之,高糖环境可引起内源性H2S产生减少,导致细胞发生病理改变,补充外源性H2S或(和)内源性H2S的增多有效抑制了DN的病理改变,抑制细胞凋亡。
本研究显示,高糖环境下培养24、48 h,HK-2细胞的细胞凋亡率明显高于低糖对照组,提示细胞凋亡参与了高糖对肾小管上皮细胞的病理过程,这与以往的研究相一致,而给予NaHS干预高糖下HK-2 24、48 h,通过流式细胞术再次证明H2S可以减轻高糖诱导下的细胞凋亡。在本实验研究中,还发现外源性H2S可抑制低糖环境中的HK-2凋亡,此结果,进一步说明H2S具有抗细胞凋亡的功能。至于高糖环境如何引起内源性H2S的减少,H2S在病理条件下的生物学功能,以及相关信号转导通路的影响有待深入探究。
[1] 李敏,林俊.细胞凋亡途径及其机制[J].国际妇产科学杂志,2014,41(2):103-107.
[2] Park K S,Kim J H,Kim M S,et al .Effects of insulin and antioxidant on plasma8-hydroxyguanine and tissue 8- hydroxydeoxyguanosine in streptozotocin-induced diabetic rats[J].Diabetes,2001,50(12):2837-2841.
[3] Predmore B L,Lefer D J,Gojon G.Hydrogen sulfide in biochemistry and medicine[J].Antioxid Redox Signal,2012,17(1):119-140.
[4] Zhou X,Feng Y,Zhan Z,et al.Hydrogen sulfide alleviates diabetic nephropathy in a streptozotocin-induced diabetic rat model[J].Journal of Biological Chemistry,2014,289(42):28827-28834.
[5] 杨锐,刘小粉,马善峰,等.硫化氢对1型糖尿病大鼠肾脏的保护作用[J].中国应用生理学杂志,2016,32(2):181-184.
[6] Habib,Samy L.Alterations in tubular epithelial cells in diabetic nephropathy[J].J Nephrol,2013,26(5):865-869.
[7] Yamamoto J,Sato W,Kosugi T,et al.Distribution of hydrogen sulfide(H2S)-producing enzymes and the roles of the H2S donor sodium hydrosuifide in diabetic nephropathy[J].Clin Exp Nephrol,2013,17(1):32-40.
[8] Riyaz M,Calpurnia J,Punithavathi V,et al.Kidney proximal tubular epithelial-specific overexpression of netrin-1 suppresses inflammation and albuminuria through suppression of COX-2-mediated PGE2 production in streptozotocin-induced diabetic mice[J].Am J Pathol,2012,181(6):1991-2002.
[9] Zhang J N,Chen S,Liu H B,et al.Hydren sulfide prevents hydrogen peroxide-induced activation of epithelial sodium channel through aPTEN/PI(3,4,5)dependent pathway[J].Plos One,2013,8(5):e64304.
[10] Liu Y H,Lu M,Hu L F,et al.Hydrogen sulfide in the mammalian cardiovascular system[J].Antioxid Redox Signal,2012,17(1):141-185.
[11] Jain S K,Bull R,Rains J L,et al.Low levels of hydrogen sulfide in the blood of diabetes patients and streptozotocintreated rats causes vascular inflammation[J].Antioxid Redox Signal,2010,12(11):1333-1337.
[收稿2017-03-21;修回2017-04-24]
(编辑:王静)
Influence of exogenous hydrogen sulfide on cell apoptosis induced by high glucose in human proximal renal tubular epithelial cells
LiuAidong1,WangQing2,TianLin2,LiuXiaohong1,ZengJunwei1
(1.Department of Physiology, Zunyi Medical University,Zunyi Guizhou 563099,China;2.Function Laboratory of Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To investigate the influence of sodium hydrosulfide(NaHS,was taken as a donor of H2S)on cell apoptosis induced by high glucose in human proximal renal tubular epithelial cells(HK-2).Methods Human renal proximal tubular cells were cultured and divided into eight groups:low glucose as control group(5.5 mmol/L D-Glucose),low glucose + NaHS pretreatment group with dose of 50,100 and 200 μmol/L,high glucose group(40 mmol/L D-Glucose),high glucose + NaHS pretreatment group with dose of 50,100 and 200 μmol/L.Each group has three samples,cultured in 37 ℃ and 5%CO2incubator for 24 and 48 h,collected cells and cell supernatant fluid.Apoptosis rate was measured by flow cytometry.Results When cells were cultured 24 and 48 h,the apoptosis rate of low glucose + NaHS pretreatment groups were significantly lower than low glucose group (P<0.05),and decreased significantly in low glucose + NaHS (100μmol/L) dose group.The apoptosis rate of high glucose group was significantly higher than low glucose group(P<0.05),high glucose + NaHS pretreatment groups were significantly lower than high glucose group(P<0.05),and decreased significantly in high glucose + NaHS(100 μmol/L)dose group.Conclusion NaHS can suppress cell apoptosis induced by low glucose and high glucose in human proximal renal tubular epithelial cells,which could be a novel approach of treating diabetic nephropathy.
hydrogen sulfide;renal tubular epithelial cell;cell apoptosis;high glucose;diabetic nephropathy
贵州省科学技术基金资助项目(NO:黔科合J字[2011]2259);遵义医学院重点学科建设项目(NO:XZXK-20120702)。
R334.1
A
1000-2715(2017)03-0264-04

