胆碱和蛋氨酸缺乏饲料诱导大、小鼠非酒精脂肪性肝炎动物模型的比较研究
崔国祯,余汉濠,黄天养,王文栋,徐义祥,程自刚,吴彩燕,李铭源
(1.遵义医学院珠海校区 生物工程系暨珠海市中药基础及应用研究重点实验室,广东 珠海 519041;2.澳门大学 中华医药研究院暨中药质量研究国家重点实验室,澳门 999078;3.澳门镜湖医院 消化内科,澳门 999078)
基础医学研究
胆碱和蛋氨酸缺乏饲料诱导大、小鼠非酒精脂肪性肝炎动物模型的比较研究
崔国祯1,2,余汉濠3,黄天养1,王文栋3,徐义祥3,程自刚3,吴彩燕2,李铭源2
(1.遵义医学院珠海校区 生物工程系暨珠海市中药基础及应用研究重点实验室,广东 珠海 519041;2.澳门大学 中华医药研究院暨中药质量研究国家重点实验室,澳门 999078;3.澳门镜湖医院 消化内科,澳门 999078)
目的 为防治非酒精脂肪性肝炎(NASH)的研究提供理想的动物模型。方法 将C57BL/6雄性小鼠和SD大鼠分别随机分成2组,分别喂养蛋氨酸-胆碱充足(MCS)饲料(正常组)和蛋氨酸-胆碱缺乏(MCD)饲料(模型组)。分别在各组中饲养3、5、8周后,取动物血清和肝脏。测定血清的谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和胆固醇(TC)的含量;肝脏切片后经HE染色,观察肝脏的病理形态学变化并对其病变程度进行评分。结果 饲喂MCD饲料5周后,SD大鼠血清AST含量无显著变化(P>0.05),但是C57BL/6小鼠AST水平显著升高(P<0.05)。同时,SD大鼠和C57BL/6小鼠模型的血清ALT水平均显著升高(P<0.05),此外,SD大鼠和C57BL/6小鼠血清中TG和TC的水平均显著下降(P<0.05),肝组织的病理评分均出现显著升高(P<0.05)。但是C57BL/6小鼠血清AST、ALT的变化幅度及肝组织病理评分明显高于SD大鼠。结论 C57BL/6小鼠NASH模型优于SD大鼠NASH模型。C57BL/6小鼠NASH模型相对SD大鼠,更适合NASH的分子机制和防治药物的评价。
非酒精脂肪性肝炎;胆碱蛋氨酸缺乏饮食;非酒精性脂肪肝病;C57BL/6小鼠;SD大鼠
非酒精脂肪性肝炎(Nonalcoholic steatosisheptitis,NASH)是一种无过量饮酒,以肝脏细胞脂肪变性、气球样变、弥散性肝小叶炎症为主要临床病理特征的综合征。它是非酒精脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)发展为肝硬化和肝癌的一个重要阶段,据报道NAFLD在发达国家的发病率表现为成人30%,儿童13%,其中大约有10%的NAFLD患者发展成为NASH,而这些NASH患者中的10%会发展成为肝硬化,甚至肝癌。目前非酒精脂肪性肝炎已经成为研究的焦点[1-3],然而NASH的发病机制尚未明确,研究发现其与胰岛素抵抗、氧化应激、瘦素、Kupffer细胞等多种因素相关[4-6]。目前临床上的药物普遍存在毒副作用较大、价格昂贵等问题,而被证实的有效且无副作用治疗方法仅有适当的渐进性减肥运动这一项。因此探索新型无毒副作用药物对其NASH临床治疗具有重要意义,而可靠的动物模型对探索NASH的发病机制及防治发挥着关键性作用。
目前国内外的NASH模型主要包括3类[7]:①营养失调性脂肪肝动物模型,它包括了高脂饮食脂肪肝动物模型、高糖饮食脂肪肝动物模型和蛋氨酸-胆碱缺乏(MCD)脂肪肝动物模型。②复合因素诱导的NASH模型,主要是以高脂肪饮食加化学药物来进行造模,包括四氯化碳脂肪肝动物模型、四环素脂肪肝动物模型、乙硫氨酸脂肪肝动物模型。③特殊品系脂肪肝动物模型,主要有瘦素缺乏和抵抗小鼠模型、PTEN基因敲除小鼠模型。其中,MCD饲料饮食诱导的NASH模型是目前国际上被广泛认可的模型。该模型最早由Shinozuka等[8]提出,最初是用于探讨饮食因素对肝脏肿瘤形成的影响,后来发现在短期内可以引起脂肪性肝炎。该模型的脂肪性肝炎发展速度快,其病理病变与人类的NASH类似,因此成为近年来国内外学者研究NASH的热点模型。但未见关于在大小鼠体内用MCD饮食诱导NASH模型差异比较的报道。本研究旨在大、小鼠体内,通过MCD饮食分别建立NASH模型,通过比较其生化和病理指标,探讨两种动物模型的差异,以选择理想的动物模型,为NASH的基础研究和防治药物的开发提供可靠的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级C57BL/6雄性小鼠18只,8~9周龄,体重为22~25 g;SPF级SD雄性大鼠18只,8~9周龄,体重为300~350 g。均购于广东省医学实验动物中心,生产许可证号[SCXK(粤)2013-0002],饲养于遵义医学院实验动物中心[SCXK(黔)2011-003],饲养于遵义医学院实验动物中心,屏障环境动物房[室温(22±1)℃,相对湿度30%~60%,12 h光照/12 h黑暗],动物自由采食和饮水。
1.1.2 实验试剂 检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和胆固醇(TC)含量的试剂盒,批号分别为0764757、0764949、0767107和0767263,均购自德国罗氏诊断公司,按说明书和文献[9]报道的方法进行检测。
1.1.3 实验仪器 COBAS6000型全自动生化仪(德国罗氏诊断公司);TB-718E型生物组织自动包埋机(泰维科技有限公司);TK-218型恒温摊片烤片机(泰维科技有限公司);RM2255生物组织自动切片机(上海徐卡显微系统有限公司);5415R台式离心机(德国Eppendorf公司)。
1.1.4 动物饲料 蛋氨酸-胆碱缺乏(MCD)饲料(货号:TP3006R)和蛋氨酸-胆碱充足(MCS)饲料(货号:TP3006S2)购于南通特洛菲饲料科技有限公司;两种饲料均按照南通特洛菲饲料科技有限公司技术部的饲养操作说明进行喂养。
1.2 方法
1.2.1 动物分组与处理 将18只C57BL/6雄性小鼠和18只SD大鼠分别随机分成正常组(饲喂MCS饲料)和模型组(饲喂MCD饲料)。模型组需要1周过渡性饲料的喂养,第1~3天将MCS和MCD饲料按2∶1混合后喂养,第4~5天按1∶1混合喂养,第6~7天按1∶2混合喂养,1周后完全喂MCD饲料。过渡性饲养后的第3、5、8周在各组中分别随机选取6只动物样本,进行肝功能生化指标和肝脏病理的检测。从过渡饲喂开始且每周称量动物体质量(g),并记录。
1.2.2 血清样本的采集与生化检测 实验动物禁食12 h后,用水合氯醛腹腔注射麻醉动物,采血液,4 ℃冰箱静置过夜后,于4 ℃离心机1 000g离心10 min,收集上清,用电化学发光法(德国罗氏诊断公司COBAS6000型全自动生化仪,德国罗氏诊断公司)测定ALT、AST、TG和TC的含量。
1.2.3 肝组织样本的采集与病理学检测 取相同部位的肝组织50 mg置于4%多聚甲醛(PFA)中,固定24 h,然后脱水12 h,包埋,切片,HE染色后进行肝组织光镜病理学检测和等级评分。NASH的病理评分标准根据NASH病理诊断标准采用“亚太地区非酒精脂肪性肝病诊断与治疗共识”推荐的美国国立卫生研究院NASH临床研究网络病理委员会2005年制定的NAFLD活动度积分指南进行评价[10]。
对脂肪变性、肝小叶炎症和细胞气球样变进行评分。①对于肝脂肪变性,小于5%的肝脂肪变性,为0分;5%~33%,1分;33%~66%,2分;超过66%,3分。②对于肝小叶炎症(随机计数20个视野),无炎症,0分;<2个,1分;2~4个,2分;>4个,3分。③肝细胞气球样变:无,0分;少见,1分;2分,多见。计算肝脂肪变性、肝小叶炎症和肝细胞气球样变的平均分,得到综合得分。

2 结果
2.1 体质量变化 正常对照组实验动物的体质量持续增长,模型组实验动物体质量逐渐减轻;从第3周开始,相比于正常组,模型组的实验动物体质量都显著降低(P<0.05,见表1)。


组别动物0周(n=18)3周(n=18)5周(n=12)8周(n=6)正常SD大鼠330.83±12.23426.15±9.33483.06±10.43513.90±14.32模型SD大鼠333.22±11.45293.05±15.74*281.14±13.45*254.54±12.89*正常C57BL/6小鼠22.45±1.0323.06±1.5524.10±1.2226.17±1.45模型C57BL/6小鼠22.48±1.2320.07±1.45*18.14±1.36*16.71±0.89*
与同一时相点正常组相比,*P<0.05。
2.2 动物血清中ALT、AST、TC和TG的含量 从第3周开始,模型组小鼠肝酶AST和ALT水平与正常组相比,均已显著升高(P<0.05)。相比之下,大鼠模型组在检测的3个时间点,肝酶AST水平无显著变化,而ALT水平从第3周开始显著升高(P<0.05)。在检测的造模后第3周、5周、8周,大、小鼠血清中TG和TC含量均显著降低(P<0.05,见表2)。
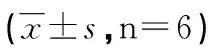

时间组别动物天冬酸氨基转移酶AST(U/L)丙氨酸氨基转移酶ALT(U/L)甘油三酯TG(mmol/L)总胆固醇TC(mmol/L)3周正常SD大鼠149.15±26.8439.03±3.350.79±0.321.65±0.21模型SD大鼠158.85±21.7563.67±4.16*0.30±0.06*0.89±0.71* 正常C57BL/6小鼠90.95±2.8018.55±5.870.95±0.072.5±0.69模型C57BL/6小鼠135.20±5.80*43.50±14.42*0.64±0.01*1.46±0.07*5周正常SD大鼠89.55±7.2827.47±3.091.39±0.161.54±0.99模型SD大鼠124.37±18.56153.37±26.18*0.37±0.08*0.92±0.24*正常C57BL/6小鼠232.20±8.4975.70±15.801.13±0.072.69±0.16模型C57BL/6小鼠289.33±10.55*205.60±18.92*0.62±0.16*1.07±0.21*8周正常SD大鼠95.77±6.7248.93±5.621.44±0.112.22±0.12模型SD大鼠132.43±8.59108.37±14.17*0.25±0.03*0.76±0.11*正常C57BL/6小鼠104.75±14.6416.97±0.930.74±0.042.49±0.16模型C57BL/6小鼠399.09±25.80*309.86±14.96*0.47±0.04*0.71±0.13*
与同一时相点正常组相比,*P<0.05。
2.3 肝组织HE染色 正常对照组肝小叶结构清晰、完整,肝细胞以中央静脉为中心,呈放射状排列,无肝细胞气球样变或炎症细胞浸润(见图1A、1C)。MCD饲料饲喂8周后,模型组的大鼠肝组织小叶结构已被破坏,大泡性气球样变细胞占了总细胞的2/3以上,以肝小叶周边脂肪变性最为严重,局部可见大泡性气球样变和以单个核细胞浸润为主炎症反应(见图1B)。8周时模型组小鼠肝组织光镜下见肝小叶结构紊乱,细胞出现严重的脂肪变性,中央静脉周围出现严重、以浸润为主的局灶坏死性炎症(见图1D)。具体NAFLD活动度积分见表3,SD大鼠和C57BL/6小鼠综合评分均表现为模型组与正常组之间差异具有统计学意义(P<0.05)。
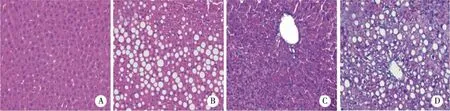
A:SD大鼠8周正常饮食组;B:SD大鼠8周MCD饮食组;C:C57BL/6小鼠8周正常饮食组;D:C57BL/6小鼠8周MCD饮食组。 图1 MCD饲料诱导的C57BL/6小鼠和SD大鼠NASH模型肝组织病理形态变化(HE,×400)
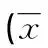

组别动物肝脂肪变性肝小叶内炎症肝细胞气球样变综合得分正常SD大鼠0.67±0.330.67±0.3300.45±0.22模型SD大鼠2.00±0.00*2.33±0.67*1.67±0.67*2.00±0.44*正常C57BL/6小鼠0.67±0.331.00±0.0000.56±0.23模型C57BL/6小鼠3.00±0.002.67±0.67*1.33±0.33*2.33±0.44*
与同一时相点正常组相比,*P<0.05。
3 讨论
MCD饲料诱导的NASH模型的主要发病机制是由于饲料缺乏胆碱而引起机体卵磷脂合成不足。蛋氨酸为合成载脂蛋白所必需的氨基酸,缺乏蛋氨酸会导致低密度脂蛋白胆固醇合成减少,因此无法将三酰甘油运出肝外而累积形成脂肪肝[11]。另一方面,缺乏胆碱还会引起肝脏线粒体内部活性氧增加,最终导致氧应激增加而肝脏发生损伤[12-13]。氧应激不但导致细胞多种功能和结构损伤,而且活化TNFα及其他促炎症细胞因子[14-15]。该模型自1978年Shinozuka等[8]提出以来,被国内外的学者广泛应用于药物筛选,但是缺少文献对该模型在C57BL/6小鼠和SD大鼠的系统性报道。于是本实验饲喂MCD饲料建立大、小鼠NASH模型,对其血液的生化指标和肝脏的病理指标进行了比较,旨在探讨两种动物模型的生化和病理差异,以选择理想的动物模型,为NASH的基础研究和防治药物的开发提供可靠的动物模型。
本研究的结果显示,在肝损伤指数方面,饲喂MCD饲料的第3周开始,模型组小鼠的肝酶AST、ALT水平与正常组相比已经显著升高,但模型大鼠AST水平从实验开始至结束仍无显著差异,而AST和ALT的水平在临床研究中通常作为肝脏功能评价重要指标,反映脂肪肝的早期损害[16],因此表明C57BL/6小鼠对MCD饲料的反应在早期比SD大鼠更敏感,更容易引起肝损伤;且在肝组织病理结果显示,饲喂MCD饲料8周模型组C57BL/6小鼠小鼠肝组织比SD大鼠出现的脂肪变性更严重,小区域出现小泡为主的细胞气球样变及轻微的炎症反应;同时通过肝组织病例评分结果表明8周后模型组C57BL/6小鼠肝组织炎症反应及脂肪变性等病理特征的得分明显大于SD大鼠。另外,小鼠具有采食量少、成本低及操作方便等优点。因此,综合生化指标及病理特征等因素,MCD饲料诱导的NASH的小鼠模型比SD大鼠模型更适用于进一步研究NASH。
理想的动物模型对NASH发病机制及防治的研究起着至关重要的作用,因此其应该具有与人类病理特征相似,动物死亡率低,模型重复率好,造模时间短,造模成本低等优点。高脂饮食模型虽然稳定性好,但是其造模的动物易厌食或腹泻且至少12周才会逐渐出现NASH的病理学表现,而本次实验完全建立模型的时间为8周,相比之更简单、高效;此外,本实验为无毒、不涉及化学试剂的过程,相比药物中毒性脂肪肝动物模型和特殊品系脂肪肝动物模型而言,此模型具有动物死亡率低、肝细胞坏死少、重复性好,而且造模成本相对低廉等优点。然而值得我们注意的是MCD模型组小鼠的体质量和肝脏湿重均低于正常组的现象,这与相关文献所述的人类NASH患者存在中心性肥胖的情况不同[17]。但同时也有相关研究指出,并非所有的NASH患者都并发有肥胖情况,仍有10%~20%的NASH患者体质量是下降,且无胰岛素抵抗的症状[18]。因此,MCD饮食诱导的模型还将有可能为非肥胖性脂肪性肝炎的研究提供新思路。
本实验利用胆碱和蛋氨酸缺乏饮食诱导大、小鼠非酒精脂肪性肝炎动物模型,并对其进行了比较研究,发现MCD饮食8周可以完全建立NASH模型,且以小鼠的NASH模型更符合研究人类临床非酒精脂肪性肝病的发病过程。希望这一研究将有利于广大学者进一步充实和完善对MCD模型发展机制的认识,为NASH防治提供新的思路和实验依据。
[1] Chalasani N,Younossi Z,Lavine J E,et al.The diagnosis and management of non-alcoholic fatty liver disease:practice guideline by the American Gastroenterological Association,American Association for the Study of Liver Diseases,and American College of Gastroenterology[J].Gastroenterology,2012,142(7):1592-1609.
[2] Vernon G,Baranova A,Younossi Z M.Systematic review:the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J].Alimentary Pharmacology & Therapeutics,2011,34(3):274-285.
[3] Borena W,Strohmaier S,Lukanova A,et al.Metabolic risk factors and primary liver cancer in a prospective study of 578 700 adults[J].International Journal of Cancer,2012,131(1):193-200.
[4] Polimeni L,Del Ben M,Baratta F,et al.Oxidative stress:New insights on the association of non-alcoholic fatty liver disease and atherosclerosis[J].World Journal of Hepatology,2015,7(10):1325-1336.
[5] Polyzos S A,Aronis K N,Kountouras J,et al.Circulating leptin in non-alcoholic fatty liver disease:a systematic review and meta-analysis[J].Diabetologia,2016,59(1):30-43.
[6] Marietti M,Rosso C,Gaggini M,et al.Adipose tissue insulin resistance is associated with macrophage activation in non-diabetic patients with non-alcoholic fatty liver disease[J].Digestive and Liver Disease,2016,48(S1):12.
[7] Ibrahim S H,Hirsova P,Malhi H,et al.Animal models of nonalcoholic steatohepatitis:eat,delete,and inflame[J].Digestive Diseases and Sciences,2016,61(5):1325-1336.
[8] Shinozuka H,Lombardi B,Sell S,et al.Early histological and functional alterations of ethionine liver carcinogenesis in rats fed a choline-deficient diet[J].Cancer Research,1978,38(4):1092-1098.
[9] 廖鑫,张安星,高琳,等.二甲双胍对糖尿病非酒精性脂肪性肝病大鼠肝脏内脏脂肪素表达的作用[J].遵义医学院学报,2015,38(2):125-128.
[10] Kleiner D E,Brunt E M,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J].Hepatology,2005,41(6):1313-1321.
[11] Anstee Q M,Goldin R D.Mouse models in non-alcoholic fatty liver disease and steatohepatitis research[J].International Journal of Experimental Pathology,2006,87(1):1-16.
[12] Hensley K,Kotake Y,Sang H,et al.Dietary choline restriction causes complex I dysfunction and increased H(2)O(2)generation in liver mitochondria[J].Carcinogenesis,2000,21(5):983-989.
[13] 贾红梅,王丽凤,张海峰.Nrf2对小鼠非酒精性脂肪性肝炎保护作用机制的研究[J].内蒙古农业大学学报:自然科学版,2015,1:14-17.
[14] Marí M,Morales A,Colell A,et al.Oxidative stress in nonalcoholic fatty liver disease//Studies on Hepatic Disorders[M].Springer,2015:279-308.
[15] Santos J C F,de Araújo O R,Valentim I B,et al.Choline and cystine deficient diets in animal models with hepatocellular injury:Evaluation of oxidative stress and expression of RAGE,TNF-α,and IL-1β[J].Oxidative Medicine and Cellular Longevity,2015,doi:10.1155/2015/121925.
[16] Kayadibi H,Gultepe M,Yasar B,et al.Diagnostic value of serum prolidase enzyme activity to predict the liver histological lesions in non-alcoholic fatty liver disease:a surrogate marker to distinguish steatohepatitis from simple steatosis[J].Digestive diseases and sciences,2009,54(8):1764-1771.
[17] Wolfs M G,Gruben N,Rensen S S,et al.Determining the association between adipokine expression in multiple tissues and phenotypic features of non-alcoholic fatty liver disease in obesity[J].Nutrition & diabetes,2015,5(2):146.
[18] Pagano C,Soardo G,Esposito W,et al.Plasma adiponectin is decreased in nonalcoholic fatty liver disease[J].European Journal of Endocrinology/European Federation of Endocrine Societies,2005,152(1):113-118.
[收稿2017-03-12;修回2017-05-12]
(编辑:王静)
Comparison of NASH models-induced by methionine and choline deficient diets between rat and mouse
CuiGuozhen1,2,YuHanhao3,HuangTianyang1,WangWendong3,XuYixiang3,ChengZigang3,WuCaiyan2,LiMingyuan2
(1.Department of Bioengineering,Zhuhai Key Laboratory of Fundamental and Applied Research in Traditional Chinese Medicine,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China;2.State Key Laboratory of Quality Research in Chinese Medicine and Institute of Chinese Medical Sciences,University of Macau,Macao 999078,China;3.Department of Gastroenterology,Kiang Wu Hospital,Macau 999078,China)
Objective To establish an ideal animal model for preventing and treating nonalcoholic steatohepatitis (NASH).Methods Rats and mice were randomly divided into 2 groups:control group fed with methionine-choline-sufficient (MCS) diet while model group fed with methionine-choline-deficient (MCD) diet.Blood was collected after 3,5,and 8 weeks of treatment,respectively.Serum levels of AST,ALT,TG and TC were measured.In addition,livers were removed to make hematoxylin-eosin (HE) staining.Liver pathology was semi-quantified according to nonalcoholic fatty liver disease (NAFLD) activity score.Results After 5 weeks of treatment,there is no significant difference in serum AST levels of rats between control group and model group(P>0.05),in contrast,the AST levels in mice were significantly increased(P<0.05).However,the serum ALT levels in both animal models were increased significantly compared with control group(P<0.05).Additionally,the concentration of serum TC and TG decreased significantly in both rat model groups and mouse model group(P<0.05).NAFLD activity scores in both animal models were obviously increased compared with control group,which indicated that the animals have gradually developed into NASH(P<0.05).More importantly,the changes of serum AST,ALT,TG,and TC levels and histological score of NASH in mice were more severe than those in rats.Conclusion C57BL/6 mouse NASH model is superior to that of SD rat model,and is more suitable for studying molecular mechanism and drug screening in the prevention and therapy of NASH.
nonalcoholic steatohepatitis;methionine-choline-deficient diet;nonalcoholic fatty liver disease;C57BL/6 mice;SD rats
遵义医学院博士启动基金资助项目(NO:F-693);珠海市优势学科建设项目(NO:306015)。
李铭源,男,博士,教授,博士生导师,研究方向:药理学,E-mail:simonlee@umac.mo。
R575.5
A
1000-2715(2017)03-0229-05

