绞股蓝总苷对大鼠脑缺血再灌注损伤及NF-κB p65信号通路的影响
陈文明,钱民章
(1.遵义医学院附属医院 心血管内科,贵州 遵义 563099;2.遵义医学院 生物化学教研室,贵州 遵义 563099)
基础医学研究
绞股蓝总苷对大鼠脑缺血再灌注损伤及NF-κB p65信号通路的影响
陈文明1,钱民章2
(1.遵义医学院附属医院 心血管内科,贵州 遵义 563099;2.遵义医学院 生物化学教研室,贵州 遵义 563099)
目的 研究绞股蓝总苷(GPs)对大鼠脑缺血再灌注损伤的保护作用及可能机制。方法 将65只SD大鼠随机分为假手术组、模型组、尼莫地平组(20 mg/kg/d)、GPs低剂量组(100 mg/kg/d)和高剂量组(200 mg/kg/d)。建立大鼠脑缺血2 h-再灌注模型,待大鼠麻醉清醒后,根据神经功能评分筛选出模型成功的实验动物,按各组剂量连续灌胃7 d后,2,3,5-三苯基四唑化氯(TTC)染色法观察各组脑组织梗死体积;HE染色观察脑组织病理学变化;免疫组织化学法观察大鼠大脑皮层白细胞介素-1β(IL-1β)、单核细胞趋化蛋白-1(MCP-1)的表达及核因子-κB p65(NF-κB p65)核转位情况。结果 与模型组比较,GPs低、高剂量组梗死体积小于模型组(P<0.01),且IL-1β和MCP-1表达降低(P<0.01),NF-κB p65核转位减少(P<0.01)。结论 GPs对脑缺血2 h-再灌注损伤大鼠具有保护作用,其机制与抑制NF-κB p65的激活,降低炎性因子IL-1β及MCP-1的表达有关。
绞股蓝总苷;脑缺血再灌注;核因子-κB p65;白介素-1β;单核细胞趋化蛋白-1;大鼠
绞股蓝系葫芦科绞股蓝属植物绞股蓝[Gynoacemmapentaphyllum(Thunb)Mak],为多年生草质藤本植物,药用干燥全草。《本草纲目》中记载,绞股蓝以“乌蔹莓”之名入药,具有清热解毒、止咳化痰、补气生津、健脾安神之功效,为我国常用中药。绞股蓝总苷(Gypenosides,GPs)是从绞股蓝中提取分离的有效成分。近年来研究发现,GPs具有抗肿瘤、抗衰老、抗脑缺氧、抗动脉粥样硬化和免疫调节等多种药理作用[1]。
脑缺血后再灌注损伤是一种严重的脑血管病变,危害极大。已有报道GPs通过抗氧化、减轻大鼠神经元DNA/RNA损伤等对脑缺血再灌注损伤有保护作用[2-3]。脑缺血再灌注损伤时存在炎症病理改变,炎性分子的表达量增加[4],GPs能否抑制调控多种炎性分子表达的转录因子核因子-κB p65(NF-κB p65)的激活,进而减少炎性分子的表达量而减轻组织损伤,未见报道。本研究旨在更全面地认识GPs的药理作用机制,为其用于脑缺血再灌注损伤的防治提供更充分的实验依据。
1 材料与方法
1.1 药品、试剂与仪器 绞股蓝总苷(GPs),纯度99.7%(西安飞达生物技术有限公司);尼莫地平片(规格:每片20 mg,批号:130443,亚宝药业集团股份有限公司);大脑中动脉阻塞(Middle Cerebral Artery Occlusion,MCAO)栓线(北京沙东生物技术公司);白细胞介素-1β(IL-1β)、单核细胞趋化蛋白-1(MCP-1)及NF-κB p65抗体(北京博奥森生物技术有限公司);SABC免疫组化染色试剂盒(武汉博士德生物工程有限公司);2,3,5-三苯基四唑化氯(TTC,上海山浦化工有限公司);中性树胶(上海标本模型厂);冰箱(海尔股份有限公司);微波炉(美的集团有限公司);恒温箱(广东中野精科仪器设备有限公司);Leica光学显微镜(德国,Leica Microsystems Ltd)。
1.2 实验动物、分组及处理 清洁级SD大鼠,65只,雄性,体重(300±20)g,购自第三军医大学大坪医院实验动物中心,合格证号:SCXK(渝)2007-0005。待动物适应环境1周,随机分为5组:假手术组(n=11)、模型组(n=15)、尼莫地平组(20 mg/kg/d,n=13)、GPs低剂量组(100 mg/kg/d,n=13)和高剂量组(200 mg/kg/d,n=13)。动物造模成功后,开始按剂量灌胃给药,假手术组和模型组大鼠给予生理盐水(1 mL/kg/d),连续7 d。
1.3 模型制备根据改进的Zea Longa方法[5-6]动物用10%水合氯醛腹腔注射麻醉,仰卧位固定,经颈正中切口,然后分离右侧颈总动脉和颈内、外动脉。将MCAO栓线圆头端栓线经颈总动脉插入颈内动脉,阻断大脑中动脉的所有血供来源。栓塞2 h后抽出栓线,继之再灌注。待大鼠麻醉清醒后,根据神经功能评分筛选出模型成功动物,按各组剂量连续灌胃7 d。假手术组只分离血管,不结扎。
1.4 脑组织梗死部分体积比计算方法 将脑组织冠状切成5片,厚度约2 mm/片,置于1%TTC溶液中,37 ℃水浴30 min。染色后用10%中性甲醛溶液避光固定。根据公式:梗塞百分比(%)=苍白区重量/(苍白区重量+非苍白区重量)×100%,计算脑梗死体积。
1.5 病理学观察 脑组织经石蜡包埋,切片行HE染色,采用Leica光学显微镜观察病理学的变化。
1.6 免疫组织化学方法检测大鼠缺血周边区IL-1β、MCP-1的表达和NF-κB p65转位 石蜡切片厚度约4 μm,脱蜡至水合,3%H2O2室温孵育后进行抗原修复,根据SABC免疫组化染色试剂盒说明书操作,滴加一抗(IL-1β1:200、MCP-1 1:200、NF-κB p65 1:200),37 ℃孵育2 h,PBS冲洗,滴加二抗(生物素化山羊抗兔IgG)37 ℃孵育1 h,PBS冲洗,用DAB显色,阳性结果为棕色,返蓝,脱水封片。用Leica光学显微镜观察免疫组化结果,每张切片随机选取5个视野(400倍)进行拍照。利用Image-Pro Plus 6.0图像分析软件对切片中免疫组化染色的阳性细胞(细胞浆和核内含棕黄和/或褐色颗粒的细胞)进行定量分析,计算阳性染色的积分光密度(Integrated Optical Density,IOD)值。
2 结果
2.1 GPs对脑缺血-再灌注损伤大鼠模型脑梗死体积的影响 TTC染色发现假手术组大鼠未见梗死灶形成,模型组大鼠缺血范围较大,梗死体积百分比达(16.28±2.49)%;与模型组比较,GPs高低剂量组梗死范围明显缩小(P<0.01),分别为(8.89±1.55)%和(9.58±3.73)%,与尼莫地平组相比差异无统计学意义(P>0.05,见图1)。
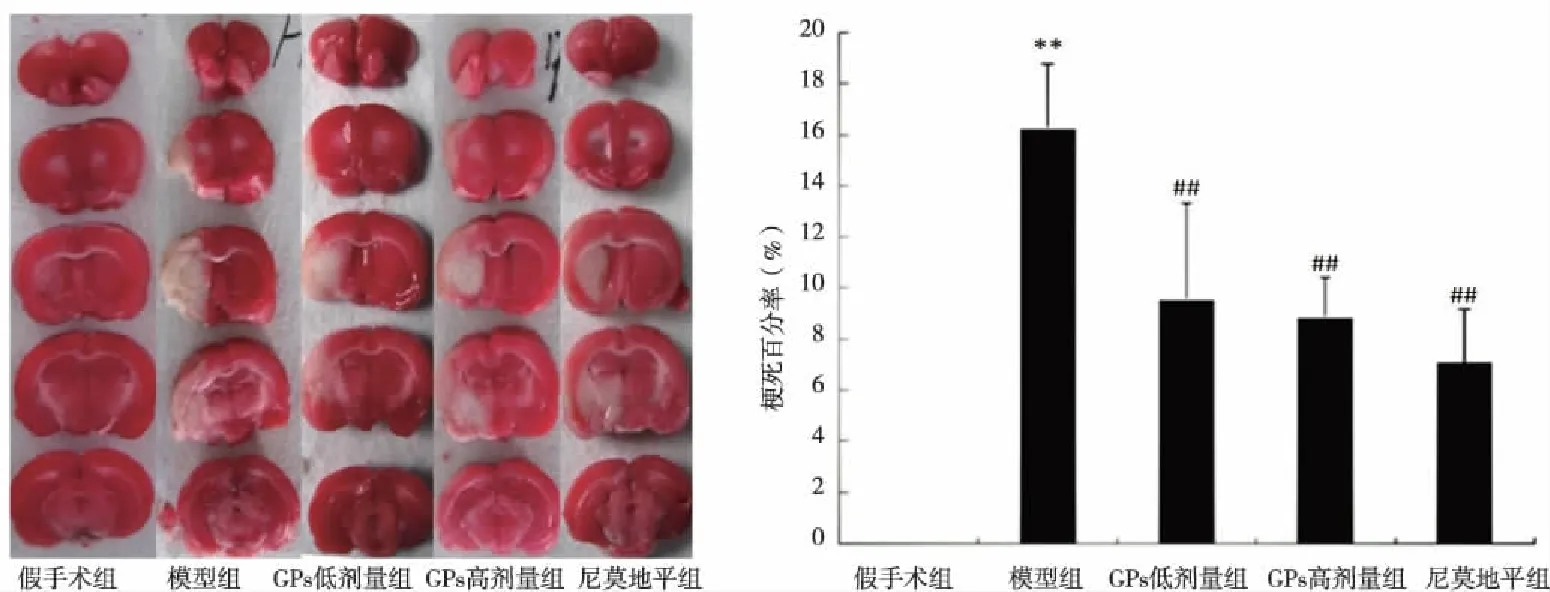
与假手术组比较,**P<0.01;与模型组比较,##P<0.01。图1 绞股蓝总苷对脑缺血-再灌注模型大鼠脑梗死体积的影响±s)
2.2 GPs对脑缺血再灌注损伤大鼠模型脑组织形态的影响 HE染色可见假手术组脑组织结构致密,神经细胞形态结构清晰,细胞排列规整,核膜完整,核仁清晰(见图2A)。模型大鼠缺血区脑组织大部分神经细胞萎缩、变性、甚至坏死,胞质呈空泡变性、胞核出现不同固缩、溶解,神经胶质细胞水肿明显(见图2B)。给药7 d后与模型大鼠比较,GPs各剂量组大鼠脑组织神经细胞核固缩、核溶解、细胞肿胀有不同程度的减轻(见图2C、D),与尼莫地平组作用相近(见图2E)。

A:假手术组;B:模型组;C:GPs低剂量组;D:GPs高剂量组;E:尼莫地平组。图2 绞股蓝总苷(GPs)对脑缺血再灌注损伤大鼠脑组织病理组织学的影响(n=5,HE×400)
2.3 GPs对脑缺血再灌注损伤大鼠模型IL-1β表达的影响 免疫组织化学发现假手术组大鼠脑组织IL-1β阳性表达稀少,模型组脑组织胞核IL-1β阳性表达较假手术组明显增强(P<0.01)。给药7 d后与模型组比较,GPs低、高剂量组的IL-1β阳性表达明显下降(P<0.01,见表1、图3)。

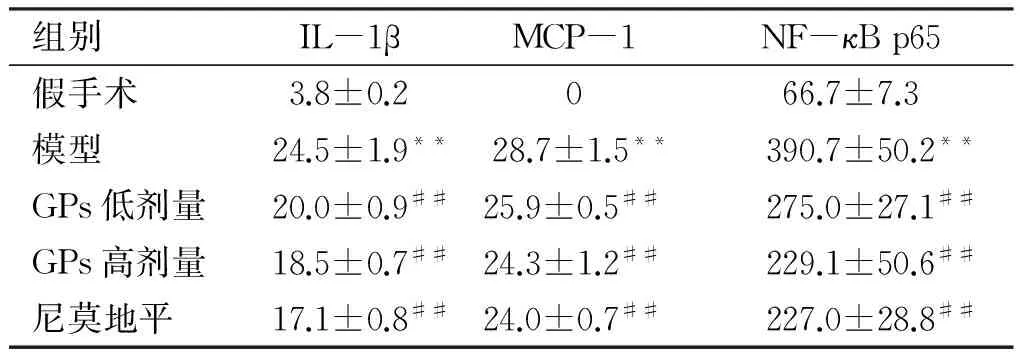
组别IL-1βMCP-1NF-κBp65假手术3.8±0.2066.7±7.3模型24.5±1.9**28.7±1.5**390.7±50.2**GPs低剂量20.0±0.9##25.9±0.5##275.0±27.1##GPs高剂量18.5±0.7##24.3±1.2##229.1±50.6##尼莫地平17.1±0.8##24.0±0.7##227.0±28.8##
与假手术组比较,**P<0.01;与模型组比较,##P<0.01。

A:假手术组;B:模型组;C:GPs低剂量组;D:GPs高剂量组;E:尼莫地平组。图3 绞股蓝总苷(GPs)对大鼠脑缺血再灌注损伤脑组织IL-1β表达的影响(×400)
2.4 GPs对大鼠脑缺血再灌注损伤脑组织MCP-1表达的影响 免疫组织化学发现假手术组脑组织皮层未见MCP-1阳性表达,模型组胞浆的MCP-1阳性表达显著增强(P<0.01);给药7 d后与模型组比较,GPs低、高剂量组和尼莫地平组MCP-1阳性表达明显下降(P<0.01,见表1、图4)。

A:假手术组;B:模型组;C:GPs低剂量组;D:GPs高剂量组;E:尼莫地平组。图4 绞股蓝总苷(GPs)对大鼠脑缺血再灌注损伤脑脑组织MCP-1表达的影响(×400)
2.5 GPs对大鼠脑缺血再灌注损伤脑组织NF-κB p65激活的影响 免疫组织化学结果可见,假手术组大鼠脑组织胞核颜色浅淡,提示NF-κB p65核移位少。与假手术组比较,模型组缺血区脑组织胞核NF-κB p65阳性表达显著增强(P<0.01),表明NF-κB p65核移位明显增强。与模型组比较,GPs低、高剂量组NF-κB p65阳性表达明显下降(P<0.01,见表1、图5)。

A:假手术组;B:模型组;C:GPs低剂量组;D:GPs高剂量组;E:尼莫地平组。图5 绞股蓝总苷(GPs)对大鼠脑缺血再灌注损伤脑组织NF-κB p65激活的影响(×400)
3 讨论
脑缺血-再灌注损伤的病理过程极为复杂,其中炎症反应在这一过程中起重要作用。大量炎症介质在脑缺血早期即可产生,在白细胞聚集、游出血管发挥细胞毒过程中起重要作用。促炎细胞因子IL-1β在正常生理状态下,内皮细胞和神经胶质细胞见有少量表达。在脑缺血或缺血性脑损伤等病理状态下,IL-1β主要在脑损伤区域及周边区域的单核细胞、小胶质细胞和巨噬细胞大量表达。IL-1β的致损作用与其诱导和加强再灌注过程中的炎症反应有着密切关系[4]。MCP-1对单核细胞有很强的趋化活性,对活化的T细胞、NK细胞等也有趋化募聚作用。正常脑组织中MCP-1表达水平极低,但已发现在缺血再灌注脑组织中MCP-1表达量增加[7],过度表达的MCP-1诱导炎性细胞向脑组织浸润,可加重缺血性脑损伤。本研究发现GPs能抑制脑缺血-再灌注损伤诱导IL-1β和MCP-1蛋白的表达,表明GPs治疗脑缺血再灌注损伤的机制与IL-1β和MCP-1等炎性因子有关,是否影响这些炎性分子的释放尚需进一步研究。NF-κB参与多种炎症介质及细胞因子的基因调控,与脑缺血后炎症反应密切相关[8]。在正常情况下,无活性的NF-κB大多以p65-p50-IκB三聚体形式存在于细胞浆中,其中IκB为抑制性亚单位,在刺激作用下,IκB磷酸化降解,活化的NF-κB迅速移入细胞核,与靶基因上启动子区域的κB序列发生特异性结合,从而启动相应基因转录和蛋白质表达[9]。本研究发现GPs能减少NF-κB p65核移位,说明其激活受到抑制,且NF-κB是调控IL-1β、MCP-1等炎性分子表达的转录因子,故二者的表达下调与GPs抑制NF-κB p65激活有密切关系。
总之,GPs对脑缺血再灌注损伤具有治疗作用,本研究揭示了GPs抑制炎症相关因子的表达与其防治大鼠脑缺血再灌注损伤密切相关。
[1] 李金青,杨洪军.绞股蓝的药理作用研究进展[J].中国现代药物应用,2009,3(7):189-190.
[2] 齐刚,张莉,谢文莉,等.绞股蓝总苷对全脑缺血再灌注损伤大鼠神经元DNA和RNA的保护作用[J].中国药理学报,2000,21(12):1193-1195.
[3] Loh K P,Qi J,Tan B K,et al.Leonurine protects middle cerebral artery occluded rats through antioxidant effect and regulation of mitochondrial function[J].Stroke,2010,41(11):2661-2668.
[4] 王志菲,唐希灿.脑缺血损伤的炎症反应及治疗策略展望[J].中国新药与临床杂志,2007,26(6):454-461.
[5] Longa E Z,Weinstein P R,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6] 刘波,丁利静,李菲,等.天麻素对脑缺血再灌注损伤大鼠相关基因mRNA表达的影响[J].遵义医学院学报,2016,39(2):139-142.
[7] 陈施艳,杨朝东,杨晓苏,等.单核细胞趋化蛋白-1在大鼠脑缺血再灌注损伤中的表达变化[J].中国神经免疫学和神经病学杂志,2006,13(3):160-165.
[8] Wang Q,Tang X N,Yenari M A.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1-2):53-68.
[9] Diane S,Tinggui Y,Smalsin E B,et a1.Transcription factor nuclear factor-kappa B is activated in neurons after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2000,20(3):592-603.
[收稿2017-03-23;修回2017-04-17]
(编辑:王静)
Influence of gypenosides on the injury induced by ischemia-reperfusion and NF-κB p65 signaling pathway in rat brain
ChenWenming1,QianMinzhang2
(1.Department of Cardiology,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China;2.Department of Biochemistry,Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To investigate the protective effects and potential mechanism of gypenosides(GPs)on brain ischemia-reperfusion injury in rats.Methods Sixty-five SD rats were randomly divided into the sham group,ischemia-reperfusion model group,GPs low-dose(100 mg/kg/d)and high-dose(200 mg/kg/d)groups and nimodipine group(20 mg/kg/d).Ischemia-reperfusion injury model was performed according to Zea Longa method and scored according to the neurological function standard.GPs were orally administrated for 7 days after ensuring the success in ischemia-reperfusion model.Brain sections were stained by TTC to evaluate the area of infarct lesion.The pathological changes of rat brain were observed by HE staining.The immunohistochemistry was performed to detect the expressions of interleukin-1β(IL-1β),monocyte chemotactic protein 1(MCP-1)and the nuclear translocation of NF-κB in the cerebral cortex of rats.Results The areas of infarct lesions in GPs low-dose and high-dose groups were significantly smaller than those in the model group(P<0.01).Compared with the model group,the expressions levels of IL-1β and MCP-1 were decreased and the nuclear translocation of NF-κB p65 were reduced significantly in the GPs low-dose and high-dose groups(P<0.01).Conclusion GPs may improve the brain ischemia-reperfusion injury through inhibiting the activation of NF-κB signaling pathway and decreasing the expressions of inflammatory factors,such as IL-1β and MCP-1.
gypenosides;cerebral ischemia-reperfusion;NF-κB p65;IL-1β;MCP-1;rats
贵州省科技厅基金资助项目(NO:黔科合丁字[2009]2-178)。
钱民章,女,硕士,教授,博士生导师,研究方向:天然产物防治心脑血管疾病的作用及机理,E-mail:qian_mzh@hotmail.com。
R285.5
A
1000-2715(2017)03-0273-05

