基于四氮唑的Cu(Ⅰ)/Cu(Ⅱ)配合物及其可见光催化降解有机污染物
侯不唯 李恺
(1郑州外国语学校国际部中美班,郑州450001) (2郑州大学化学与分子工程学院,郑州450001)
基于四氮唑的Cu(Ⅰ)/Cu(Ⅱ)配合物及其可见光催化降解有机污染物
侯不唯1李恺*,2
(1郑州外国语学校国际部中美班,郑州450001) (2郑州大学化学与分子工程学院,郑州450001)
利用1,2,4,5-四(2H-四氮唑)苯配体(H4TTB)和三苯基磷(PPh3)与氰化亚铜在水热/溶剂热条件下的反应得到一价铜配合物[Cu2(TTB)0.5(PPh3)]n(1)和二价铜配合物{[Cu(TTB)0.5(H2O)2]·H2O}n(2),并通过红外光谱、热稳定性分析和X射线粉末衍射对它们进行了表征。X射线单晶结构解析表明,1中的每个TTB4-配体都有12个N原子参与配位,进而使得配合物1拥有了二维的骨架结构,而配合物2则呈现出一维双Cu2+链结构。这两个配合物在可见光照射下对罗丹明B(RhB)和亚甲基蓝(MB)都表现出很好的催化降解性能:氙灯照射1 h,一价铜配合物1和二价铜配合物2对RhB的降解率分别达到了88%和78%;而这两个配合物对MB的降解效果更好,在40 min后都达到了93%,这也说明一价铜配合物和二价铜配合物都能有效的光催化降解有机染料。
Cu(Ⅰ)/Cu(Ⅱ)配合物;有机染料降解;可见光催化
0 引言
在世界经济快速增长的同时,人类面临着日益严重的环境污染问题,尤其是直接危害着人们身体健康的水资源污染更加受到人们的关注[1-2]。有机染料是一类常见的水污染物,在水中溶解度较高,而且性质稳定、不易分解、存留时间长,对人类危害更大。早期使用的吸附和分离、与其他化合物反应生成沉淀、微生物降解等方法除去有机染料已经不能满足人们对绿色生活的强烈愿望。因此,不会产生二次污染、降解程度高的光催化降解法被普遍认为是最有前景的污染物处理方法,该方法可以使有机染料在常温常压下发生氧化分解,最终被降解为无污染的小分子物质[3-6]。
配合物是金属离子与有机配体连接形成的无机-有机杂化材料,它结合了无机金属和有机物二者的优点,自身又具有晶态、比表面积大、作用力强的金属-配体键等特点,使得其在催化、特别是在光催化方面表现出其它化合物不可比拟的优势[7-10]。另外,配合物结构易于调控、光谱响应范围宽以及较窄的带隙,使得配合物能够吸收太阳光中较多的紫外光部分,很大程度上促进光催化的活性,其不溶于水和重复利用的优点也在发展新型高效绿色可见光光催化材料方面有广阔的应用前景[11-18]。例如,Cu(Ⅰ)配合物[Cu(dm-bim)]n和Cu(Ⅰ)-Cu(Ⅱ)席夫碱配合物{[CuⅡ(SalImCy)](CuⅠI)2·DMF}n在氙灯模拟的可见光照射下,对甲基橙(MO)、罗丹明B(RhB)和亚甲基蓝(MB)等有机染料的降解表现出很好的催化活性[19-20]。本文中,我们通过1,2,4,5-四(2H-四氮唑)苯配体(H4TTB)与氰化亚铜反应得到了一价铜配合物[Cu2(TTB)0.5(PPh3)]n(1)和二价铜配合物{[Cu(TTB)0.5(H2O)2]·H2O}n(2)。一价铜配合物1对RhB和MB的降解率分别达到了88%和93%,而二价铜配合物2对RhB和MB的降解率分别为78%和93%。这两个配合物对MB的降解效果更好,并且都能够多次循环利用,另外,这也说明一价铜配合物和二价铜配合物都能有效的光催化降解有机染料。
1 实验部分
1.1 试剂与仪器
配体H4TTB根据文献的报道合成[21],其他的试剂和溶剂都是商业购买,不需要进一步提纯。FTIR光谱在Bruker-ALPHA分光光谱仪中依靠KBr压片在400~4 000 cm-1范围内测定;元素分析(C、H、N)在FLASH EA 1112仪器上测试;X射线粉末衍射(PXRD)是在常温下利用Cu Kα1射线(λ=0.154 06 nm)于PANalytical XPert PRO衍射仪上测得(电压; 40 kV,电流:45 mA,扫描范围:5°~50°);热重是在Netzsch STA 449C分析仪上样品从室温以10℃· min-1的升温速率加热测得;紫外光谱和固体紫外漫反射光谱通过JASCO V-750紫外可见光谱仪得到;离子色谱在美国戴安公司ICS-90型和ICS-900型离子色谱仪上测试。
1.2 配合物的合成
1.2.1 配合物[Cu2(TTB)0.5(PPh3)]n(1)的合成及表征
将CuCN(18.0 mg,0.2 mmol)、H4TTB(17.5 mg, 0.05 mmol)、PPh3(26.2 mg,0.1 mmol)、DMF(2 mL)、EtOH(2 mL)、25%~28%NH3·H2O(2 mL)和乙腈(2 mL)混合放入25 mL带聚四氟乙烯内衬的不锈钢反应釜中,在烘箱中加热到160℃保持3 d。然后以5℃·h-1的速度降至室温,得到淡黄色的晶体1,产率为67%(基于Cu计算)。元素分析按C23H16Cu2N8P计算,理论值(%):C,49.11;H,2.87;N,19.92;实验值(%):C,48.82;H,2.96;N,19.36。红外光谱(KBr压片,cm-1):3 441(w),3 048(w),1 642(m),1 478(s),1 432(s),1 413(s),1 384(m),1 356(w),1 176(w),1 158 (m),1 094(s),1 014(m),998(w),903(w),754(s),746 (s),707(s),693(s),529(s),507(s),491(s),434(w)。
1.2.2 配合物{[Cu(TTB)0.5(H2O)2]·H2O}n(2)的合成及表征
将CuCN(18.0 mg,0.2 mmol)、H4TTB(17.5 mg, 0.05 mmol)、EtOH(4 mL)和25%~28%NH3·H2O (4 mL)混合放入25 mL带聚四氟乙烯内衬的不锈钢反应釜中,在烘箱中加热到120℃并保持3 d。然后以5℃·h-1的速度降至室温,得到蓝色的晶体2,产率为72%(基于Cu计算)。元素分析按C5H7CuN8O3计算,理论值(%):C,20.66;H,2.43;N,38.54;实验值(%):C,20.79;H,2.29;N,38.96。红外光谱(KBr压片,cm-1):3 367(s),3 253(m),3 157(m),1 608(s),1 409(s),1 376(s),1 208(s),1 151(m),1 041(w),1 016(w),935 (m),763(m),727(m),663(m),589(m),503(m)。
1.3 配合物的单晶结构解析
配合物1和2的晶体学数据均是Rigaku Saturn 724 CCD单晶衍射仪在(20±1)℃下收集的(Mo Kα,λ=0.071 073 nm),晶体数据均经过Lp效应校正,吸收校正由CrystalClear(Rigaku/MSC Inc.,2006)程序完成。晶体结构是采用直接法解出,并且利用SHELXTL程序包进行全矩阵最小二乘法进行精修[22]。所有非氢原子均采用各向异性位移参数法进行精修,氢原子采用骑士模型进行各项同性的精修。配合物1和2的晶体学数据和主要的键长、键角列于表1和2中。
CCDC:1524651,1;1524653,2。
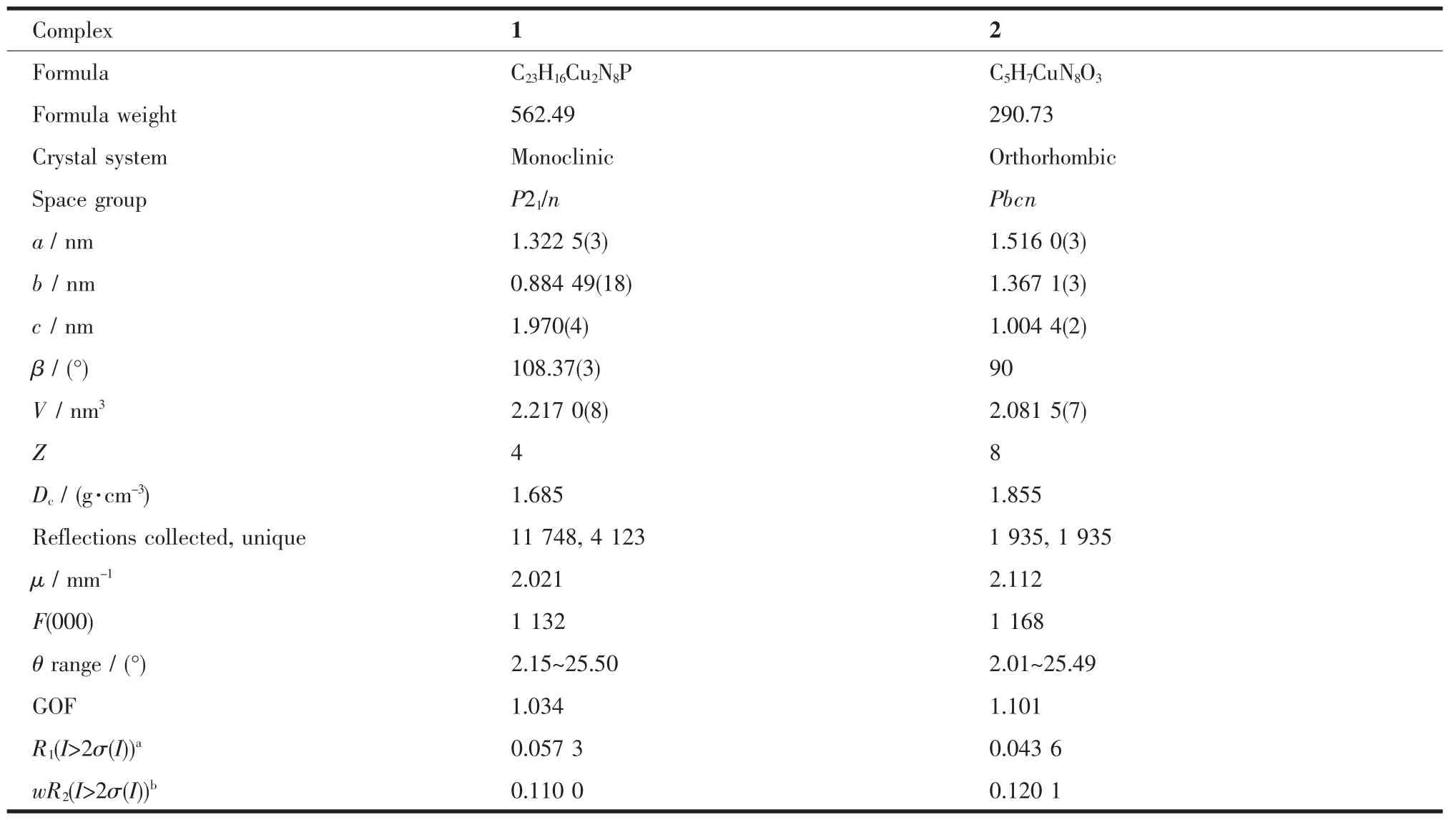
表1 配合物1和2的晶体学数据Table 1Crystallographic data and structure refinement details for complexes 1 and 2
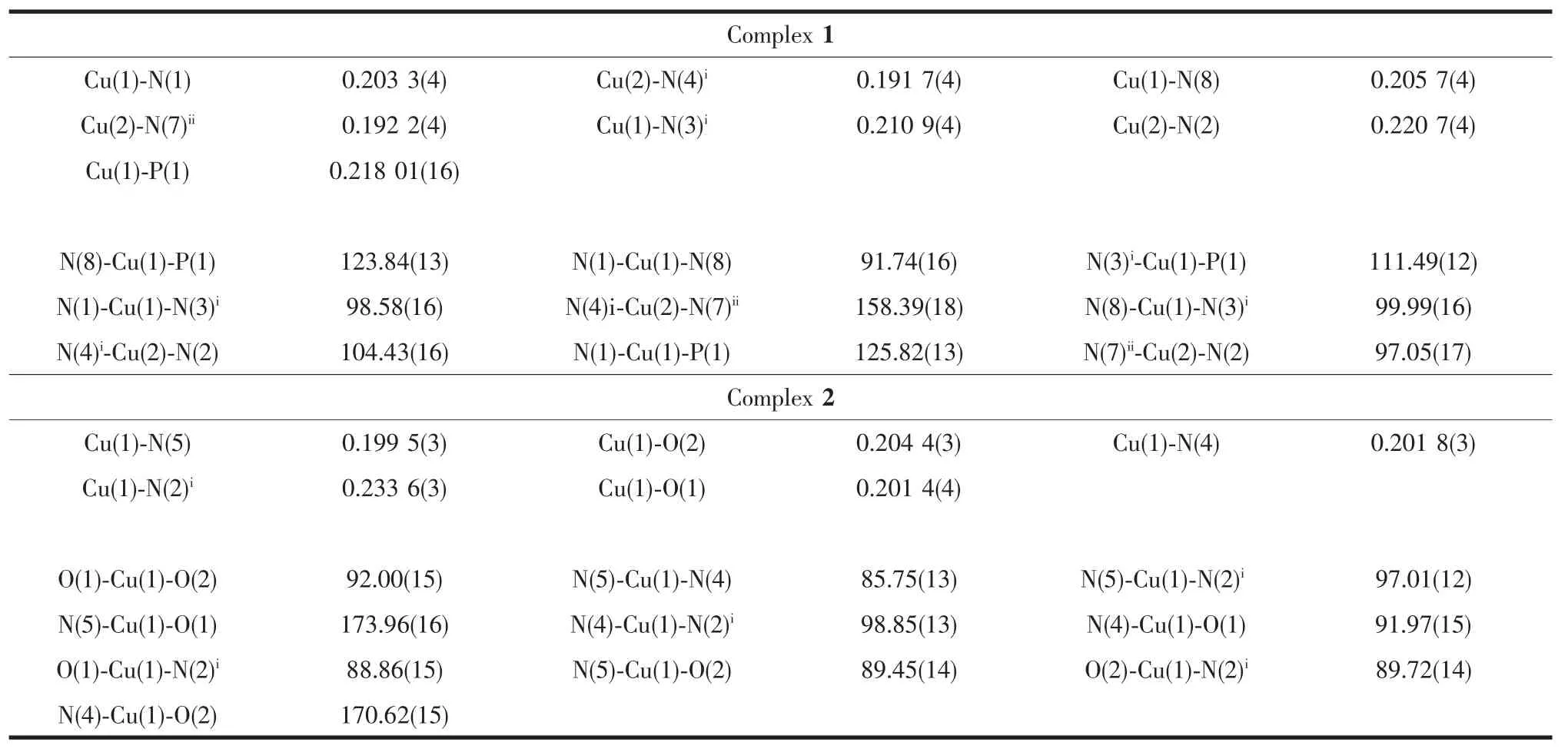
表2 配合物1和2的主要键长和键角Table 2Selected bond lengths(nm)and bond angles(°)for complexes 1 and 2
1.4 配合物的光催化实验
将配合物1或2的20 mg样品(溶剂热合成出配合物以后,取出自然晾干,直接拿来作为催化剂使用,配合物晶体颗粒大小不均(200 μm左右))和30%过氧化氢(0.05 mL)添加到6 mL RhB或MB(2×10-5mol·L-1)的水溶液中。在避光条件下磁力搅拌1 h,确保吸附/解吸附的平衡。然后,把溶液放在氙灯(500 W)下照射,并不断搅拌。每隔10 min取反应体系中0.5 mL的上层液体并加入到1 cm石英样品池中,采用JASCO V-750紫外可见光谱仪测试。在同样条件下,也进行了不加催化剂和只加过氧化氢的对照性光降解实验。选择RhB或MB的特征吸收峰(554或664 nm)来监测整个催化过程。
2 结果与讨论
2.1 晶体结构的描述
2.1.1 配合物[Cu2(TTB)0.5(PPh3)]n(1)的结构
单晶X射线衍射分析表明配合物1属于单斜晶系的P21/n空间群。1的不对称单元包含了2个晶体学独立的Cu+离子、半个完全去质子的TTB4-配体、1个配位的PPh3配体。如图1(a)所示,Cu1采取具有类似沸石结构中Si(Al)O4四面体的配位构型,Cu2采取三配位的稍微扭曲的T-型配位构型。Cu1与来自于2个TTB4-配体的3个氮原子(N1,N3,N8)和1个顶端PPh3基团的磷原子配位,而Cu2与来自3个TTB4-配体的3个氮原子(N2,N4,N7)配位,其中,Cu-N键长在0.191 7~0.220 7 nm之间。在TTB4-配体中,4个四氮唑可以分为两类:一类是四氮唑中的4个氮全部参与配位,即与2个Cu1和2个Cu2配位;另一类是四氮唑中的2个相邻的氮原子参与配位,分别与1个Cu1和1个Cu2配位。每1个TTB4-配体同时与10个Cu配位,因此,在1中,理论上TTB4-配体的16个能够配位的N原子中有12个都参与了配位(图1(b))。
值得注意的是,如果忽略配体TTB4-的中心苯环,配合物1依靠多齿的四氮唑环连接形成一维链状结构;如果忽略PPh3配体,四齿的TTB4-配体连接Cu+离子,形成二维(2D)骨架结构,因此,基于中心苯环与四氮唑环之间的二面角(44.08°和60.45°),形成了致密的2D骨架,PPh3配体在这个2D平面的上下两端。
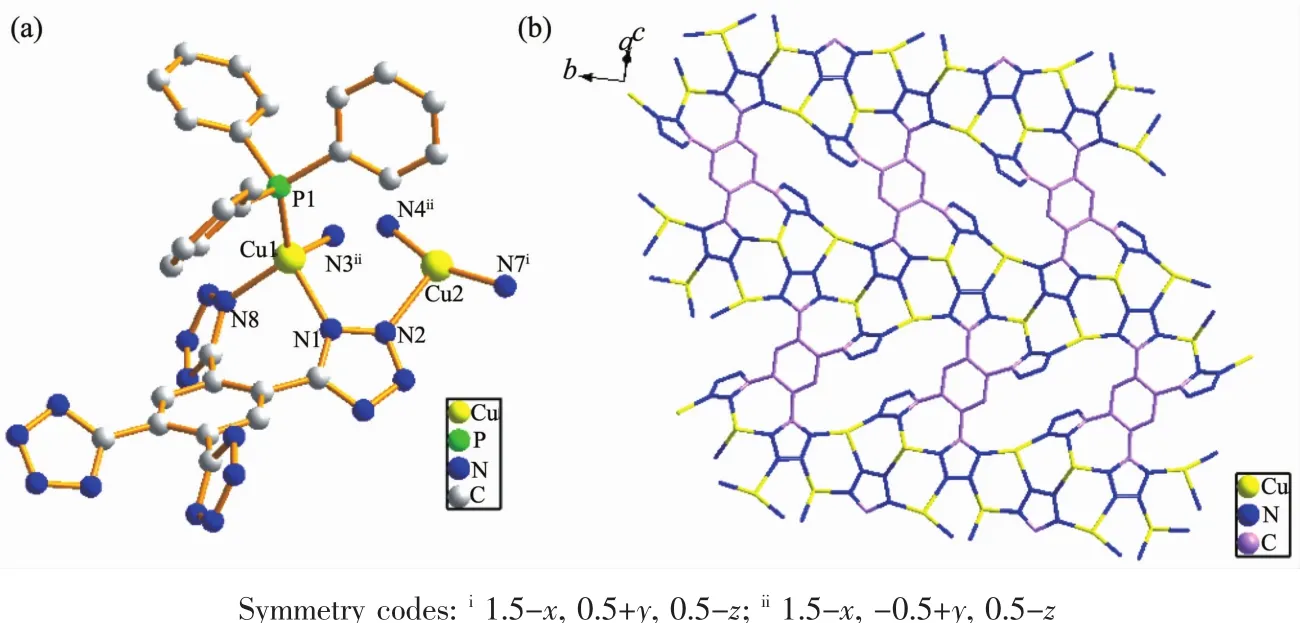
图1 (a)配合物1的中心金属Cu和TTB4-配体的配位环境;(b)Cu和TTB4-形成二维层状结Fig.1(a)View of the coordination environments of Cu ions and TTB4-in complex 1;(b)View of the 2D network structure formed by Cu ions and TTB4-
2.1.2 配合物{[Cu(TTB)0.5(H2O)2]·H2O}n(2)的结构
单晶X射线衍射分析表明配合物2属于正交晶系的Pbcn空间群。2的不对称单元包含了1个晶体学独立的Cu2+离子、半个完全去质子的TTB4-配体、2个配位的水分子H2O及1个晶格水分子H2O。如图2(a)所示,Cu1采取五配位的扭曲四方锥配位构型,Cu1与来自2个TTB4-配体的3个氮原子(N2i,N4,N5)和2个来自H2O分子的氧原子配位。其中,Cu-N键长在0.199 5~0.233 6 nm之间,Cu-O键长分别为0.201 4和0.204 4 nm。在2中,中心苯环与四氮唑环之间的二面角分别是39.55°和41.21°,这与配合物1中的二面角(44.08°和60.45°)相差较大。如果忽略配体TTB4-的中心苯环,依靠多齿的四氮唑环连接形成一维链状结构。四齿的TTB4-配体分别与4个Cu2+离子连接,这些Cu2+离子形成了两条链,这两条链又通过TTB4-配体的4个四氮唑连起来最终使得2成为了一维双链结构(图2(b))。
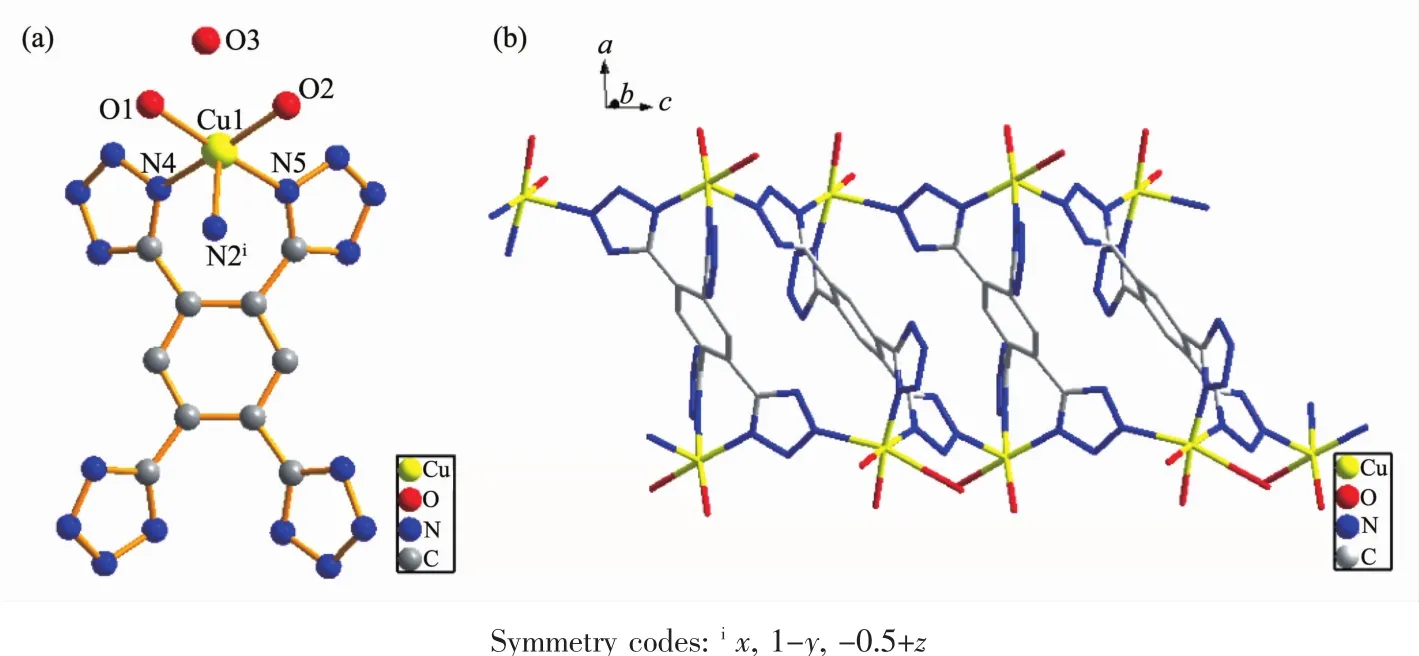
图2 (a)配合物2的中心金属Cu的配位环境;(b)Cu形成一维双链结构Fig.2(a)View of the coordination environments of Cu ions;(b)1D double chain structure formed by Cu ions
在TTB4-配体中,4个四氮唑也可以分为两类:一类是四氮唑中的2个氮参与配位,即与2个Cu1配位;另一类是四氮唑中的1个氮参与配位,即与1个Cu1配位。总体来说,每个TTB4-配体有6个氮原子与4个Cu配位。与1相比,2中TTB4-配体的配位氮原子数远远低于1中的12个配位N原子。
2.2 配合物1和2的粉末X射线衍射(PXRD)与热重分析(TG)
我们测定了配合物1和2的PXRD(补充材料附图1),通过单晶数据模拟的PXRD曲线与实验获得的PXRD曲线对比,可以看出2θ角的位置都是基本相同的,因此确定1和2的样品是纯的、并且在空气中是非常稳定的。
同时,在25~800℃的温度范围内,我们对1和2进行了TG分析(补充材料附图2)。对1来说,随着温度的升高,1的TG曲线是平滑的、不存在失重显现。当温度升至370℃时急剧失重,表明配合物1的骨架开始坍塌,直到700℃不再失重。从370到700℃的失重,对应于配位的四氮唑配体和三苯基磷配体的分解,最后残余的是金属氧化物。配合物2从40到130℃是第一步失重,对应晶格水的失去,失重6.8%(理论值6.2%)。随着温度增加,TG曲线平滑,在270℃之后,有一个突然失重,这是配位水的失去和四氮唑的分解,表明配合物在270℃时骨架开始坍塌,这个失重过程持续到400℃。400℃以后TG曲线是平滑的、不再失重,表明配合物2在400℃就形成了稳定的金属氧化物。
2.3 配合物1和2光催化降解RhB和MB的研究
RhB和MB是典型的有机染料,对环境的危害较大。为了探究配合物1和2的光催化的可能性,我们首先在室温下对1和2的固体紫外漫反射光谱进行了测试(补充材料附图3),得出它们的光学带隙分别为2.35和1.10 eV(补充材料附图4)。光学带隙在1~3 eV的范围之间,说明1和2是潜在的光催化降解材料。1和2在可见光区600 nm处有吸收,而且2在600 nm处的吸收很强,这表明它们有可能在可见光下光催化降解RhB和MB。
在RhB和MB的水溶液中分别加入1和2以及双氧水,氙灯照射。随着光照时间的增加,特征吸收峰的强度逐渐降低,这说明RhB和MB不断的被分解。RhB的特征吸收峰波长为554 nm,而MB的特征吸收峰波长为664 nm。根据朗伯-比尔定律,溶液的吸光度与物质的浓度呈正比,因此随着光反应的进行,不断被分解的RhB和MB在溶液中的浓度越来越低,RhB在554 nm以及MB在664 nm处的最大吸收峰逐渐降低。1做催化剂,光照10 min,RhB在554 nm处的最大吸收峰从0.85降到了0.55,MB在664 nm处的最大吸收峰从0.95降到了0.35;光照60 min,RhB的最大吸收峰降到了0.12,MB已经没有吸收峰了(图3)。2做催化剂时,光照10 min,RhB的最大吸收峰从0.88降到了0.60,MB的最大吸收峰从0.91降到了0.38;光照60 min,RhB的最大吸收峰降到了0.20,MB也已经没有吸收峰了(图4)。作为对比,我们在RhB和MB的水溶液中只加入双氧水、不加配合物1或2,在氙灯照射60 min后,不管是RhB还是MB,它们的最大吸收峰都没有很明显的降低。
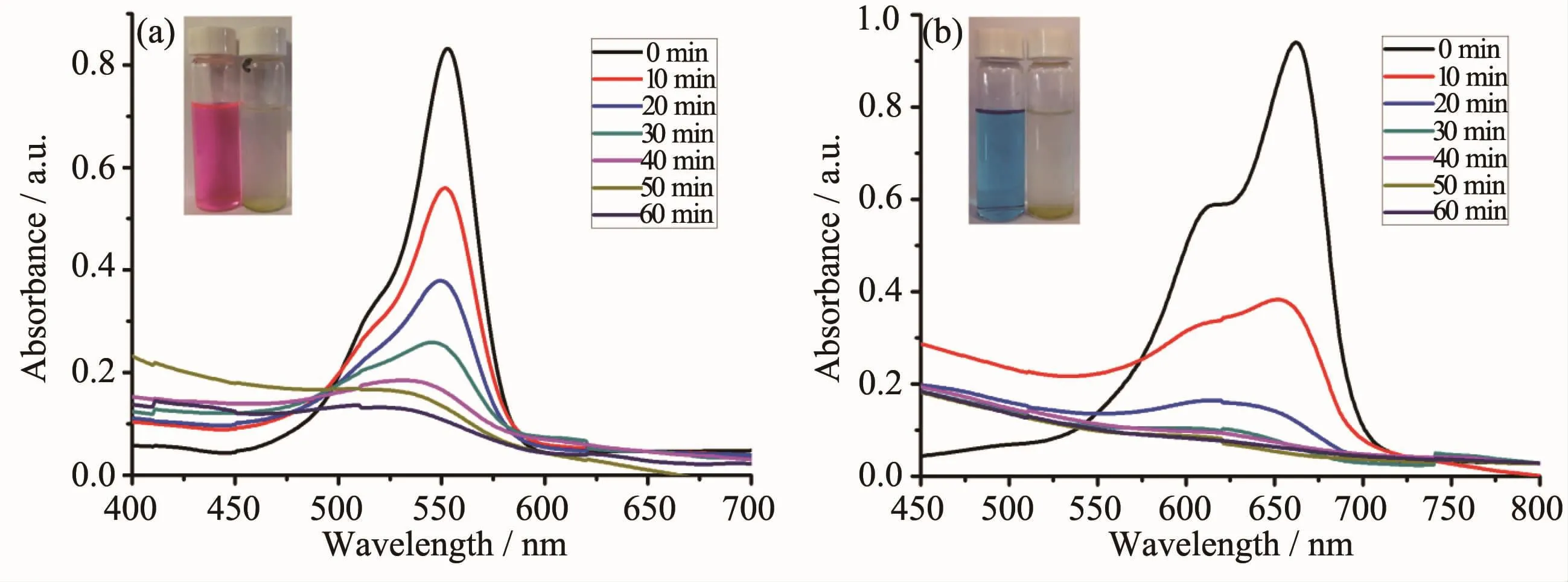
图3 配合物1对(a)RhB和(b)MB降解的紫外吸收光谱Fig.3UV-Vis absorption spectra of(a)RhB and(a)MB photocatalytic degradation in the presence of complex 1
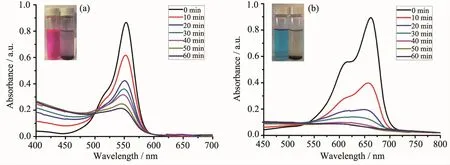
图4 配合物2对(a)RhB和(b)MB降解的紫外吸收光谱Fig.4UV-Vis absorption spectra of(a)RhB and(b)MB photocatalytic degradation in the presence of complex 2
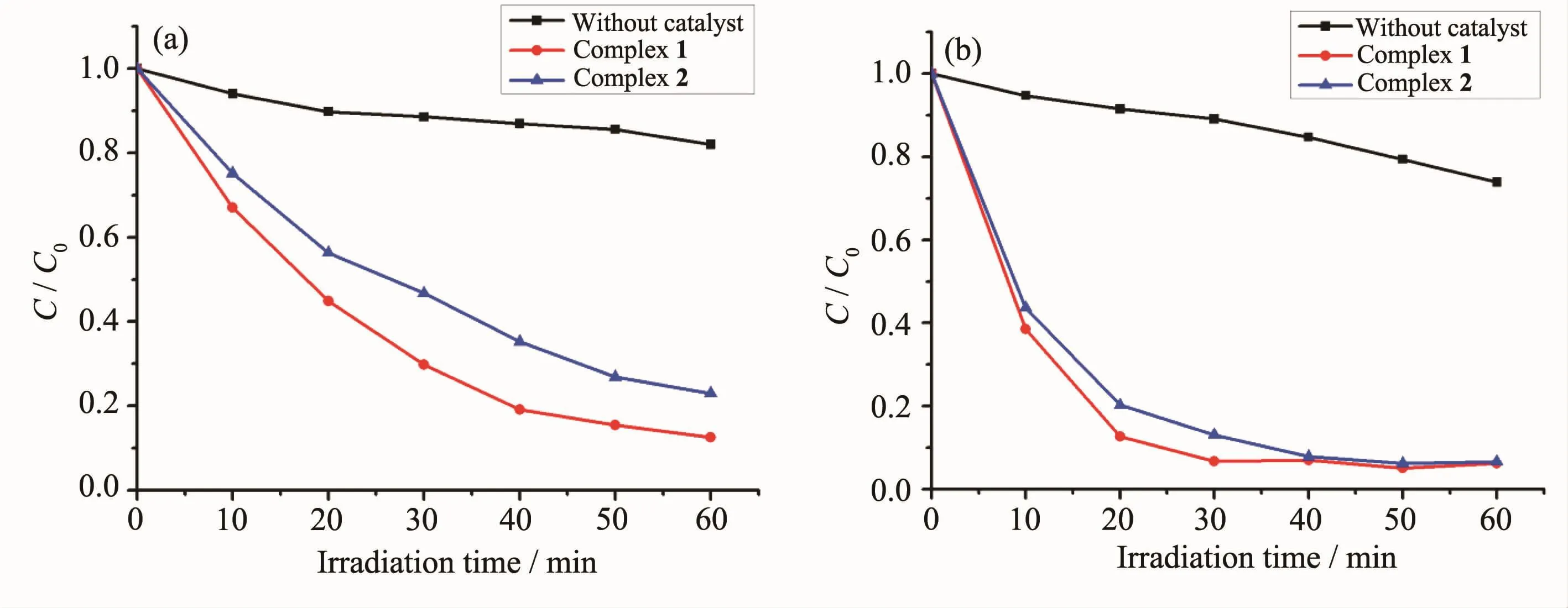
图5 配合物1和2以及无催化剂对(a)RhB和(b)MB的降解速率比较Fig.5Changes in the C/C0of(a)RhB and(b)MB solutions vs irradiation time in the presence of complexes 1 and 2,and the control experiment without any catalyst
我们以氙灯照射时间(t)为横坐标、以含催化剂1和2以及不含催化剂的RhB和MB水溶液浓度的变化(C/C0)为纵坐标,绘制了更直观的催化光降解效果曲线(图5),其中C0是初始浓度,C为照射t min后RhB或MB的浓度。氙灯照射60 min,只加入双氧水、没有催化剂情况下RhB降解率仅为18%;当1作为催化剂并加入双氧水时,氙灯照射60 min RhB降解率高达88%;2作催化剂时,照射60 min RhB降解率为78%。照射60 min,只加入双氧水、没有催化剂情况下MB降解率是23%;1作为催化剂并加入双氧水,光照30 min,MB的降解率就达到了93%;2作催化剂时,光照射40 min MB的降解率也达到93%。因此,配合物1和2都显示了很好的光催化降解效率。
那么,配合物1和2是如何对光降解反应起催化作用呢?在RhB和MB溶液中只加入双氧水、不加1或2,RhB和MB的降解率很慢,这说明双氧水仅仅起的是氧化作用,把RhB和MB氧化了,这不是一个光降解反应。在RhB和MB溶液中只加入1或2、而不加入双氧水,RhB和MB溶液的紫外吸收光谱在氙灯照射60 min后基本不发生变化的,这说明双氧水在催化光降解反应中起了很重要的作用。1和2的光学带隙分别为2.35和1.10 eV,因此在氙灯的照射下,这两个配合物的价电子很容易就被可见光激发到它们的空轨道上。被激发到空轨道上的电子与配合物表面吸附的O2结合,产生超氧负离子自由基(·O2-),·O2-再与体系中的H+反应产生了羟基自由基(·OH)。H2O2自身可以分解产生氧气(O2)和氢氧根(OH-),产生的O2以及溶液中存在的O2和OH-就吸附在配合物的表面上。吸附在配合物表面的OH-与配合物价电子被激发后的正电空穴作用,也可以生成·OH。双氧水提供了吸附在配合物表面的O2和OH-,加速了·O2-和·OH的生成,而·OH是最有效的催化降解有机染料的基团,最终把有机染料降解为无机离子等[23]。因此,1和2与双氧水的协同催化作用,提高了1和2光降解反应的效率。我们通过离子色谱对1和2光催化降解40 min后的MB溶液进行了测试,检测出了浓度很高的NH4+、NO3-、SO42-等无机离子(补充材料附表1)。
叔丁醇是一种高效的羟基自由基阻断剂[24],为了验证·OH的作用,我们将0.5 mL的叔丁醇加入到上述1和2光降解MB的反应体系中,其它的实验条件不变,催化光降解的速率明显降低了,在40 min后,催化光降解率仅仅为40%(补充材料附图5),远远低于不加叔丁醇时的93%,这表明没有·OH就极大的减慢了催化光降解反应。
另外,在光催化RhB和MB降解反应后,过滤出配合物1和2,再次测试PXRD,我们发现反应后的1和2的PXRD图与反应前2θ角的位置几乎没有变化(附图1),这说明1和2的结构在反应过程中是保持不变的,它们具有很好的稳定性。同时,也说明1和2作为非均相催化剂,可以被循环再次使用,事实也证明了循环使用的1和2对光催化降解MB的降解率依然保持93%(补充材料附图6)。
为了研究催化剂用量对光催化降解有机染料的影响,我们把催化剂从20 mg降到1 mg,其它实验条件不变,观察光催化效果。以配合物1和2光催化降解MB实验为例,在40 min后,降解率分别为80%和87%,比20倍的催化剂用量稍微有所降低(补充材料附图7)。
3 结论
合成了可见光下能够催化降解有机染料的配合物[Cu2(TTB)0.5(PPh3)]n(1)和{[Cu(TTB)0.5(H2O)2]·H2O}n(2),通过Cu+与TTB4+的配位1显示出二维网状结构,2则呈现出一维双Cu2+链。这两个Cu的配合物对罗丹明B(RhB)和亚甲基蓝(MB)都表现出较好的催化降解性能,而且在降解MB时具有很好的重复使用性。1对RhB和MB的降解率分别达到了88%和93%,2对它们的降解率也达到了78%和93%,这说明此类铜配合物是一类新型高效的可见光催化材料。
Supporting information is available at http://www.wjhxxb.cn
[1]Waranusantigul P,Pokethitiyook P,Kruatrachue M.et al. Environ.Pollut.,2003,125:385-392
[2]Dias E M,Petit C.J.Mater.Chem.A,2015,45:22484-22506 [3]Mahata P,Madras G,Natarajan S.J.Phys.Chem.B,2006, 110:13759-13768
[4]Tang J,Liu Y,Li H,et al.Chem.Commun.,2013,49:5498-5500
[5]Mills A,Davies R H,Worsley D.Chem.Soc.Rev.,1993,22: 417
[6]Feigelson L,Muszkat L,Bit L.et al.Water Sci.Technol., 2000,42:275-279
[7]YAN Ting-Ting(樊婷婷),QU Xiang-Long(屈相龙),LI Jia-Jia (李佳佳),et al.Chinese J.Inorg.Chem.(无机化学学报), 2016,32(11):1911-1918
[8]CHENG Qing-Rong(程清蓉),ZHANG Ming(张鸣),LI Ping (李萍),et al.Chinese J.Inorg.Chem.(无机化学学报), 2016,32(8):1434-1440
[9]Zhang S,Han L,Li L,et al.Cryst.Growth Des.,2013,13: 5466-5472
[10]Wang J,Wang C,Lin W.ACS Catal.,2012,2:2630-2640
[11]Cui G H,He C H,Jiao C H.et al.CrystEngComm,2012,14: 4210-4216
[12]Sha J Q,Sun J W,Li M T,et al.Dalton Trans.,2013,42: 1667-1677
[13]LI Hui-Jun(李慧军),YAN Ling-Ling(闫玲玲),WANG Yuan (王元),et al.Chinese J.Inorg.Chem.(无机化学学报), 2016,32(10):1831-1838
[14]Meng W,Xu Z Q,Ding J,et al.Cryst.Growth Des.,2014, 14:730-738
[15]Hou Y N,Wang Z N,Bai F Y,et al.RSC Adv.,2014,4: 21180-21189
[16]Kan W Q,Liu B,Yang J,et al.Cryst.Growth Des.,2012, 12:2288-2298
[17]YE Dan-Dan(叶丹丹),WANG Lei(王蕾),GU Xiao-Min(顾晓敏),et al.Chinese J.Inorg.Chem.(无机化学学报), 2016,32(9):1629-1636
[18]Liu L,Wu D Q,Zhao B,et al.Dalton Trans.,2015,44:1406-1411
[19]Wen T,Zhang D X,Liu J,et al.Chem.Commun.,2013,49: 5660-5662
[20]Hou Y,Sun R W,Zhou X,et al.Chem.Commun.,2014,50: 2295-2297
[21]Lee H,Kang S,Lee J Y,et al.Soft Matter,2012,8:2950-2955
[22]Sheldrick G M.SHELXS 97,Program for the Refinement of Crystal Structures,University of Göttingen,Germany,1997.
[23]Barrasa A,Dasb M R,Devarapallic R R,et al.Appl.Catal. B:Environ.,2013,130:270-276
[24]Zheng S,Jiang W J,Cai Y,et al.Catal.Today,2014,224: 83-88
Cu(Ⅰ)/Cu(Ⅱ)Complexes Based on Tetrazole Derivative:Degradation of Organic Dye under Visible Light Irradiation
HOU Bu-Wei1LI Kai*,2
(1Zhengzhou Foreign Language School,Zhengzhou 450001,China) (2College of Chemistry and Molecular Engineering,Zhengzhou University,Zhengzhou 450001,China)
Two Cu(Ⅰ)/Cu(Ⅱ)complexes,formulated as[Cu2(TTB)0.5(PPh3)]n(1)and{[Cu(TTB)0.5(H2O)2]·H2O}n(2) (H4TTB=1,2,4,5-tetra-(2H-tetrazole-5-yl)-benzene,PPh3=triphenyl phosphine)have been obtained by solvothermal/ hydrothermal reactions for the exploration of efficient photocatalytic degradation of organic dye pollutants.The two complexes were characterized by IR,TG,PXRD and X-ray single crystal determination.Complex 1 exhibits a novel 2D structure with 12 coordination atoms in a TTB4-,and complex 2 features an irregular 1D double chain structure.Moreover,under visible light,both complexes 1 and 2 display higher activation for the photocatalytic decomposition of rhodamine B(RhB)and methylene blue(MB).The degradation efficiency can reach 88%(RhB) and 93%(MB)for 1,and 78%(RhB)and 93%(MB)for 2.Clearly,the photocatalytic degradation efficiency of complex 1 is similar to that of complex 2.
Cu(Ⅰ)/Cu(Ⅱ)complexes;degradation of organic dye;visible light irradiation
O614.121
A
1001-4861(2017)06-1007-08
10.11862/CJIC.2017.110
2017-01-06。收修改稿日期:2017-02-16。
国家自然科学基金(No.21501150)和郑州大学优秀青年教师发展基金(No.1521316005)资助项目。
*通信联系人。E-mail:likai@zzu.edu.cn
- 无机化学学报的其它文章
- CoAl2O4/蜂窝陶瓷催化剂的制备及其催化臭氧化性能
- Photocatalytic Hydrogen Production Based on Cobalt-Thiosemicarbazone Complex with the Xanthene Dye Moiety
- 两种金属-有机钙钛矿材料的负热膨胀性质
- Pyrazolate-Based Dipalladium(Ⅱ,Ⅱ)Complexes:Syntheses,Characterization and Catalytical Performance in Suzuki-Coupling Reaction
- 以滤纸为模板合成新型介孔生物活性玻璃微管材料
- Br-掺杂Bi2WO6的水热法合成及其可见光催化性能

