以滤纸为模板合成新型介孔生物活性玻璃微管材料
吕卓 刁梦雪 高雅雯 王虹苏
(吉林大学食品科学与工程学院,长春130062)
以滤纸为模板合成新型介孔生物活性玻璃微管材料
吕卓 刁梦雪 高雅雯 王虹苏*
(吉林大学食品科学与工程学院,长春130062)
用快速滤纸为生物模板,通过先浸渍后焙烧的方法合成了介孔生物活性玻璃微管材料。快速滤纸的管状结构被完美复制,其管壁为生成的介孔生物玻璃材料。通过在合成过程中引入铁元素可以使材料具有一定的磁性。材料的形貌、结构和磁性通过扫描电镜、粉末X射线衍射、透射电镜、氮气吸附-脱附曲线,红外光谱和磁滞回线进行了表征。并且通过模拟体液浸泡方法考察了其矿化能力,以地塞米松为模型药物考察其释药能力和生物相容性。合成的介孔生物活性玻璃微管材料具有复杂的管状多级结构、快速的矿化能力和良好的生物相容性,并具备一定的磁性,是一种不可多得的药物缓释材料。
滤纸;介孔的;生物活性玻璃微管;磁性;药物缓释
0 引言
介孔生物活性玻璃(MBG)与传统溶胶-凝胶生物活性玻璃相比,具有高度有序的介孔结构,更大的比表面积,在药物输送领域有着更广阔的应用前景[1-2]。但其孔径只有几个纳米,不利于大分子药物担载、细胞附着和营养物质输送,如何实现药物的控制释放也是亟需解决的问题。近年来,已有相当数量的模板诱导合成微纳结构材料的文献报道[3-5]。以生物模板为硬模板合成的不同结构的介孔生物活性玻璃材料的制备和应用引起很大关注[6-8]。在过去的几年里,不同形态和结构的生物活性玻璃被合成出来。采用不同的人工或是天然的硬模板可以赋予多孔生物活性玻璃不同的3D结构,而形态和结构的多样性又赋予了多孔生物活性玻璃不同的功能[9-14]。其中,纤维状结构优点很多,比如甘蔗的茎中有很多纤维状结构,能够上下传输水分和养分。翡翠、和田玉中的纤维交织结构赋予材料硬度高、韧性强等特点。牛奶纤维拥有亲肤特性,木纤维的透气性和排汗效果尤为出色,竹纤维的透气除臭效果好。在众多的天然或人工模板中,以天然纤维素底物为模板,例如滤纸和蛋壳膜,可以使合成的纳米材料拥有纤维状的纳米结构。例如,黄等[15]合成的二氧化硅纳米管就是使用滤纸和十六烷基三甲基溴化铵为双模板,制备出纤维状结构的纳米材料。董等[16]制备的多级孔二氧化钛材料是采用蛋壳膜为生物模板,通过溶胶-凝胶法经煅烧制备而成的材料拥有精细的网状交联结构。我们使用纤维交联结构的快速滤纸为硬模板合成介孔生物活性玻璃微管材料,以期其拥有良好的营养输送和药物释放能力。在合成介孔生物活性玻璃微管材料的过程中,适量引入铁元素,使材料具备一定的磁性,能够实现材料的快速分离和靶向性。
本研究以快速滤纸和聚乙二醇-聚丙三醇-聚乙二醇(P123)介孔模板作为合成介孔生物活性玻璃微管材料的双模板,采用水热法合成介孔生物活性玻璃微管,并在合成过程中加入三氯化铁,焙烧后生成磁性介孔生物活性玻璃微管,进而担载地塞米松,研制一种具有药物缓释功能的磁性介孔微管材料。该材料与我们采用天然海绵为模板合成的多级孔生物活性玻璃相比[17-18],该材料除可具有一定磁性外,与天然海绵为模板合成的多级孔生物活性玻璃22天的释药时间相比,该材料一维中空微米级管状的结构使地塞米松的释药时间更短,3天的释药时间使得该材料也可作为口服药物的载体。
1 实验部分
1.1 合成介孔MBG微管材料
首先,介孔生物活性玻璃(MBG)母液按照文献方法合成[1]。以P123为介孔模板剂,取4 g P123加入60 mL乙醇(C2H5OH)和1 mL 0.5 mol·L-1HCl水溶液,搅拌至完全溶解。然后,加入6.7 g正硅酸乙酯(TEOS),0.73 g磷酸三乙酯(TEP)和1.4 g四水合硝酸钙(Ca(NO3)2·4H2O),混合液室温搅拌24 h。即得到了∶nCa∶nP∶nSi=15∶5∶80的MBG母液。通过在母液合成过程中加入FeCl3来引入铁元素,分别按nFe∶nCa∶nP∶nSi=5∶10∶5∶80和nFe∶nCa∶nP∶nSi=10∶5∶5∶80的比例来决定铁的加入。选取市售快速滤纸为大孔模板,剪成2 cm×2 cm见方,浸入含有介孔模板剂(P123)和硅源(TEOS)的MBG母液中,多余的母液用胶头吸管吸走。滤纸材料干燥后,重复浸渍,共10次。得到的材料在空气条件下600℃焙烧6 h以除去P123模板剂。得到的产品按照引入铁的量分别命名为0Fe-MBG,5Fe-MBG和10Fe-MBG。将MBG母液在空气中晾干,再焙烧即得介孔生物活性玻璃(MBG)材料。
1.2 体外矿化实验
我们所制备的模拟体液(SBF)的离子组成与人体体液相似,其中Na+、K+、Ca2+、Mg2+、Cl-、HCO3-、HPO42-和SO42-的物质的量之比为142∶5∶2.5∶1.5∶147.8∶4.2∶1∶0.5,模拟体液的pH值为7.4[19]。将上面合成的介孔生物活性玻璃微管分别浸泡在50 mL的模拟体液中,用恒温气浴震荡器在37℃震荡6、24、72和168 h,用于观察矿化情况。
1.3 药物的负载和释放
将0.2 g煅烧后的10Fe-MBG一直悬浮在浓度为10 mg·mL-1的20 mL DEX溶液中,在室温条件下搅拌24 h,搅拌完成后分离除去滤液,过滤后的样品在37℃干燥待用,记为D-10Fe-MBG。取滤液1 mL并适当进行稀释,以确定药物的负载量,高效液相色谱法(HPLC)测定并计算滤液中剩余的药品量,以计算出药品负载在载体上的药量。药物缓慢释放实验是将0.2 g负载地塞米松药物的介孔生物活性玻璃微管在37℃温度条件下浸入到250 mL体液中,分别在6、24、72、120 h取样并用HPLC测定药物释放量,并绘制释放曲线。
1.4 细胞毒性实验
使用含有10%血清的(PAA)MEM(Sigma-Aldrich)培养小鼠成骨细胞MC3T3-E1细胞,在96孔板内铺板,使得每孔的细胞数为1.0×104。将细胞培养板置于含有5%CO2(V/V)的37℃培养箱中培养12 h后,使用不同浓度的材料与细胞共孵育,用MTT法[20],并使用酶标仪在570 nm读数以检测细胞的存活率。
2 结果与讨论
2.1 表征合成的介孔生物活性玻璃微管材料
图1为合成的0Fe-MBG,5Fe-MBG和10Fe-MBG材料的粉末XRD图,可以看到样品均在2θ= 1.02°存在一个强衍射峰,为介孔生物活性玻璃材料的二维六方结构的(110)晶相峰。
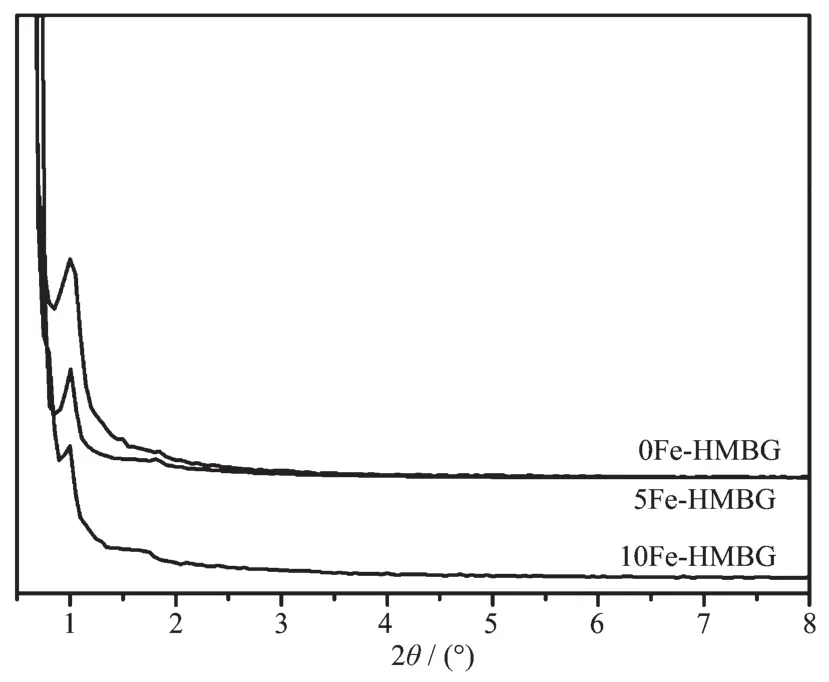
图1合成的0Fe-MBG,5Fe-MBG和10Fe-MBG材料的小角粉末XRD图Fig.1Small-angle powder XRD patterns of the synthesized 0Fe-MBG,5Fe-MBG and 10Fe-MBG
图2 为滤纸模板和合成的0Fe-MBG材料的扫描电镜表征。图2a,2b是滤纸模板的原始形貌,从图2a可清晰看见滤纸纤维素的管状形貌,图2b可看到滤纸片为纤维交联的形貌,上面布满小管。图2c为采用滤纸为模板通过浸渍法制备介孔生物活性玻璃微管材料0Fe-MBG的照片,可以看出煅烧后的材料完整的保持了滤纸材料的片状,表明煅烧后的介孔生物活性玻璃微管材料具有一定的韧性,这与滤纸模板的纤维素网状交联结构有很大的关系。图2d扫描电镜图为0Fe-MBG的整体形貌图,与图2b形貌相似,表明合成的0Fe-MBG材料复制了大孔模板快速滤纸的纤维素网络状形貌。图2e可以看出合成的0Fe-MBG复制了滤纸模板的纤维管状结构,宽度约为3 μm。图2f可以看到0Fe-MBG纤维管状结构内部为复杂的空心结构。
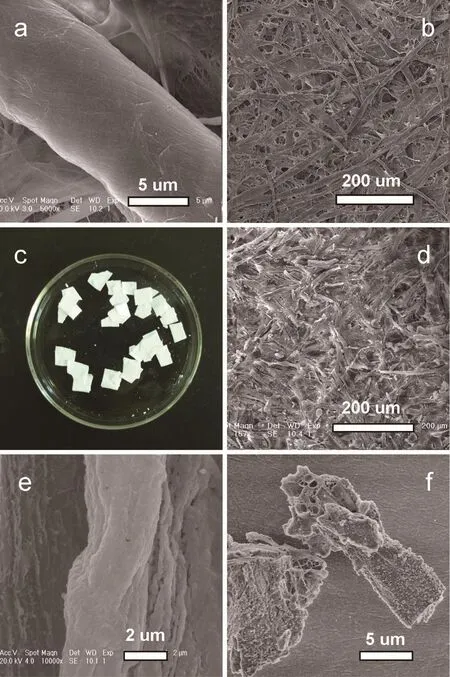
图2滤纸扫描电镜图(a,b)和焙烧后的以滤纸为模板的介孔生物活性玻璃微管(0Fe-MBG)的照片(c)和其扫描电镜图(d,e,f)Fig.2SEM images of filter paper(a,b),image of the after burning mesoporous bioactive glass microtubes(0Fe-MBG)using filter paper as the biotemplate(c)and SEM images of the after burning mesoporous bioactive glass microtubes (0Fe-MBG)(d,e,f)
图3 为合成的5Fe-MBG和10Fe-MBG材料的扫描电镜表征。图3a可以看到5Fe-MBG材料也呈现纤维管状结构,图3b可观察到材料表面有一些球形粒子,此为铁磁粒子。图3c可见10Fe-MBG材料仍然保持纤维管状形貌,并可以看见其为空心管。图3d可以看到10Fe-MBG材料与5Fe-MBG材料一样表面有一些小的球形粒子。

图3 焙烧后的以滤纸为模板的介孔生物活性玻璃微管的扫描电镜图5Fe-MBG(a,b)和10Fe-MBG(c,d)Fig.3SEM images of the after burning mesoporous bioactive glass microtubes 5Fe-MBG(a,b)and 10Fe-MBG(c,d)
在以氯化铁为铁氧化物的前驱体时,铁离子会发生水解反应,先生成铁的含氧氢氧化物(FeOOH),再经过加热和相变,会进一步生成Fe2O3[21]。为了进一步明确生成的铁磁粒子的形式和晶型,我们进行了广角XRD衍射分析。从图4中可以看出,随着铁含量的增加,特征峰的峰高有明显变化。其中2θ= 21.10°和36.55°的衍射峰为FeOOH的特征衍射峰[22]。样品最高峰出现在2θ=26.80°,为γ-Fe2O3晶型的特征衍射峰[23],由此说明样品中的铁为FeOOH和γ-Fe2O3的混合相。
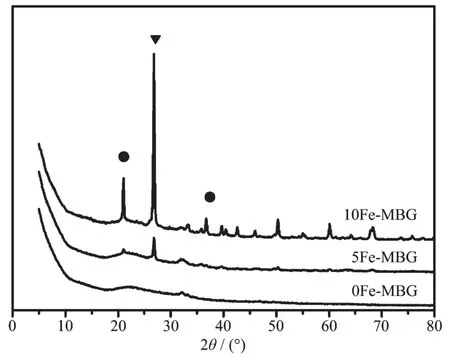
图40Fe-MBG,5Fe-MBG和10Fe-MBG的XRD图Fig.4XRD patterns of 0Fe-MBG,5Fe-MBG and 10Fe-MBG
图5 为引入铁元素的介孔生物活性玻璃微管10Fe-MBG材料的磁滞回线图,材料经过焙烧处理后,得到的磁滞回线为矩形滞回线,呈现铁磁性特征。内插图照片可以看到10Fe-MBG具有一定的磁性,能够被磁铁吸引。
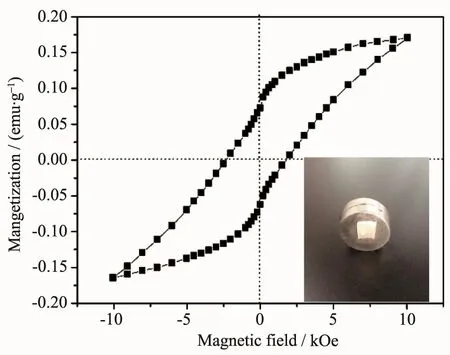
图510 Fe-MBG的磁滞回线图和照片(内插图)Fig.5Magnetization curves and image(inset)of 10Fe-MBG

图6 焙烧后的介孔生物活性玻璃微管的透射电镜图0Fe-MBG(a,b),5Fe-MBG(c,d)和10Fe-MBG(e,f)Fig.6TEM images of the after burning mesoporous bioactive glass microtubes 0Fe-MBG(a,b), 5Fe-MBG(c,d)and 10Fe-MBG(e,f)
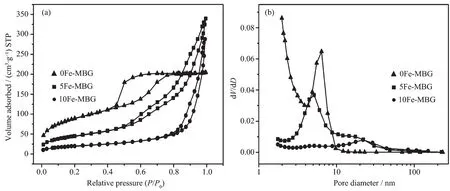
图7介孔生物活性玻璃微管材料0Fe-MBG,5Fe-MBG,10Fe-MBG的氮气吸附-脱附等温线(a)及相应的孔径分布(b)Fig.7Nitrogen adsorption-desorption isotherms of the MBG materials 0Fe-MBG,5Fe-MBG,10Fe-MBG(a)and the corresponding pore size distribution(b)
图6 为样品的透射电镜表征,从图6a中可见样品0Fe-MBG内部的形貌,从图6b可以清晰观察到介孔的孔径在6 nm左右[1,24]。图6c,6d为5Fe-MBG样品的透射电镜图,图6e,6f为10Fe-MBG样品的透射电镜图。从6c,6e图可见材料中铁磁粒子为球形结构,粒径分布较均匀。图6d,6f图可以进一步看清楚粒径在5纳米左右,并可见明显的晶格线,说明铁磁粒子为晶体结构。
图7a为介孔生物活性玻璃微管材料的N2吸附-脱附等温曲线,根据吸附-脱附曲线可以看出0Fe-MBG材料在相对压力比为0.45处存在一个拐点,其为Ⅳ型吸附脱附等温线,存在H3型滞后环,表明样品具有良好的介孔结构。5Fe-MBG的吸附脱附曲线与0Fe-MBG的相比有了一定的变化,也为Ⅳ型吸附脱附等温线。在相对压力为0.5处存在拐点,滞后环到相对压力比为1.0左右才闭合,形状也有较大改变。存在两次明显的毛细管凝聚,相对低压部分为介孔管壁引起的,相对高压部分的毛细管凝聚现象表明样品存在相对较大的孔。10Fe-MBG的吸附脱附曲线看出拐点右移更为明显,在相对压强为0.8处存在拐点,大孔部分孔吸附非常明显。图7b为3种材料的孔径分布图,从图中看出0Fe-MBG材料的介孔的孔径在6 nm左右,与其透射电镜结果十分吻合。5Fe-MBG材料存在2种大小的介孔,孔径分别为5 nm左右和20多纳米。10Fe-MBG的孔径分布图显示在20多纳米处有非常明显的大的介孔,说明样品为介孔结构。材料中小的介孔为合成的材料的介孔生物活性玻璃微管管壁上的介孔,大些的介孔为焙烧滤纸模板后产生的介孔。
2.2 体外矿化实验
图8a为0Fe-MBG材料浸泡在模拟体液后的扫描电镜照片。从照片中可以看到,浸泡后,在支架的表面由于矿化先出现一些椭圆状颗粒沉积,这些颗粒状物质为羟基磷灰石颗粒。沉积24 h和72 h后从图8b和8c看到羟基磷灰石的形貌并无明显变化,但羟基磷灰石颗粒体积明显增大。5Fe-MBG和10Fe-MBG材料浸泡在模拟体液后的扫描电镜照片与0Fe-MBG材料并无明显变化。为了进一步考察0Fe-MBG,5Fe-MBG和10Fe-MBG材料的矿化程度,我们又做了3种材料浸泡在模拟体液中不同时间后的红外表征。在图9所示的红外谱图中,605和566 cm-1的出现的振动峰为羟基磷灰石的P-O特征振动峰,可以看出随浸泡时间的延长,上述3种材料在605和566 cm-1的P-O振动峰均有所增强。说明随着矿化时间的延长,羟基磷灰石的矿化程度逐渐增大。

图80 Fe-HMBG被浸泡在SBF中6 h(a),24 h(b)和72 h(c)后的扫描电镜图Fig.8SEM images of 0Fe-HMBG soaked in SBF for 6 h (a),24 h(b)and 72 h(c)
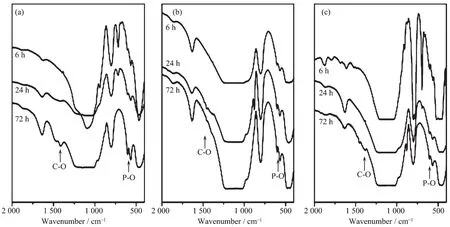
图9 (a)0Fe-MBG,(b)5Fe-MBG,(c)10Fe-MBG分别浸泡在SBF中6、24和72 h的傅里叶红外光谱图Fig.9FT-IR spectra of(a)0Fe-MBG,(b)5Fe-MBG,(c)10Fe-MBG soaked in SBF for 6,24 and 72 h,respectively
2.3 体外释药实验
我们选择抗炎、抗过敏药物地塞米松(DEX)为模型药物,通过HPLC测试可以计算出1 g的10Fe-MBG材料可以负载756.3 mg的DEX。药物缓释结果可以从图10的HPLC结果看出,随着释药时间的逐渐延长,地塞米松缓慢释放,在72 h基本全部释放。这一结果与我们以前以天然海绵为模板合成的多级孔生物活性玻璃支架相比[17-18],地塞米松的释放要快的多。我们认为这与合成材料的微管结构有很大关系。以快速滤纸为模板合成的介孔生物活性玻璃微管,存在一维中空微米管道结构,这种结构使药物进入和溶出经过的路径较短,因此所需时间也较短,药物只需要3 d就能全部释放出来。3 d的时间恰恰与人的消化周期相吻合,因此,这种介孔生物活性玻璃微管材料也可用作一种很好的口服药物缓释载体。
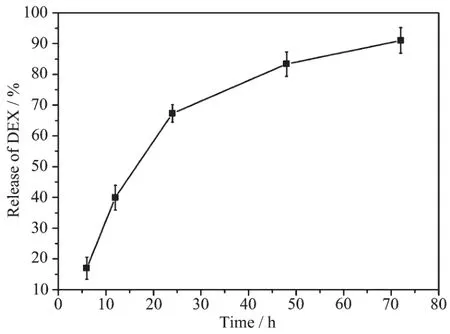
图10 DEX从D-10Fe-MBG中随时间变化图Fig.10Release profile of DEX as a function of time from D-10Fe-MBG
2.4 细胞毒性实验
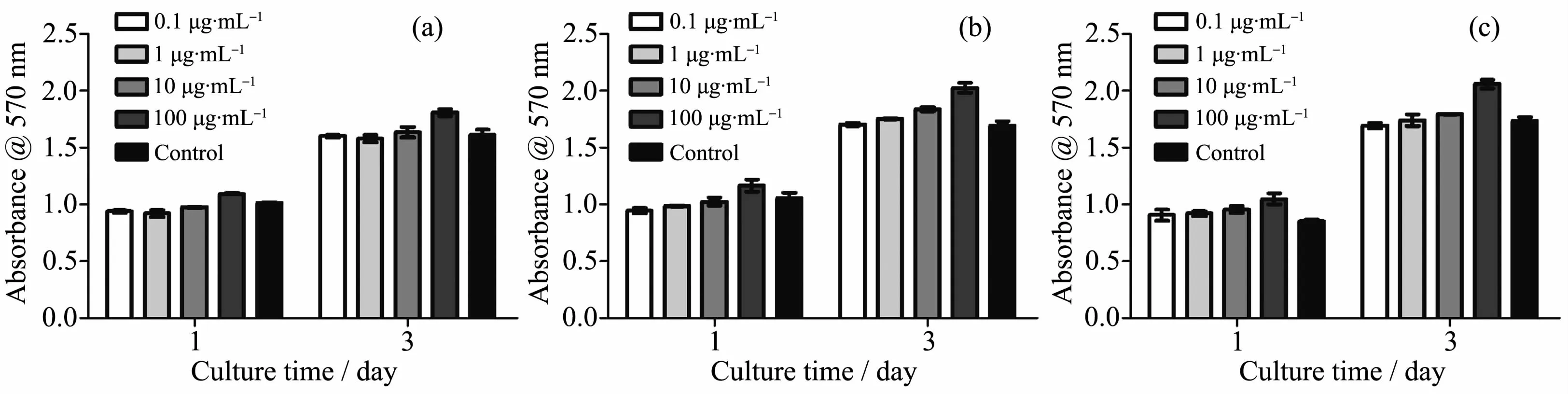
图11 将M3T3-E1细胞分别与不同浓度的(0.1~100 μg·mL-1)的MBG(a)、10Fe-MBG(b)和D-10Fe-MBG(c)共同培养,在第一天和第三天检测MTT值Fig.11MTT assay of MC3T3-E1 cells cultured on different concentrations of MBG(a),10Fe-MBG(b)and D-10Fe-MBG(c) ranging from 0.1 to 100 μg·mL-1in 1st day and 3rd day,respectively,Data are displayed as the means from three independent experiments
为了考察材料10Fe-MBG和D-10Fe-MBG对细胞的毒性,我们选取介孔生物活性玻璃(MBG)为对照,通过细胞毒性实验进行了表征。如图11所示,上述3种材料均对细胞无毒害作用,不影响细胞活性,安全性好,在0.1~100 μg·mL-1浓度的范围内,随着材料浓度的增高,显示出促进细胞生长的作用。其中载药介孔材料D-10Fe-MBG促进细胞生长的作用最好。
3 结论
将快速滤纸和P123作为制备介孔生物活性玻璃微管的双模板制备了新型介孔生物活性玻璃微管材料。该材料能够复制滤纸模板的纤维状交联结构,生成中空微米管。通过在合成中加入三氯化铁,焙烧后生成铁氧化物,使材料能具有一定的磁性。通过药物释放和细胞毒性实验,证明该材料能对药物起到缓释作用并且无细胞毒性、安全性好,有望开发新型具有抗炎功效的口服缓释药物系统。
[1]Yan X,Yu C,Zhou X,et al.Angew.Chem.Int.Ed.,2004, 43:5980-5984
[2]Yun H,Kim S,Hyeon Y.Mater.Lett.,2007,61:4569-4572
[3]Deng Y,Wang W,Zhang L,et al.J.Biomed.Nanotechnol., 2013,9:318-321
[4]Wang W,Deng Y,Li S,et al.J.Biomed.Nanotechnol.,2013, 9:736-740
[5]Deng Y,Wang W,Ma C,et al.J.Biomed.Nanotechnol.,2013, 9:1378-1382
[6]Love J C,Gates B D,Wolfe D B,et al.Nano Lett.,2002,2: 891-894
[7]Li D,Xia Y N.Nano Lett.,2003,3:555-560
[8]Chai J,Buriak J M.ACS Nano,2008,2:489-501
[9]Blin J L,Léonard A,Yuan Z Y,et al.Angew.Chem.,2003, 115:2978-2981
[10]Hang Q,Maschmann M R,Fisher T S,et al.Small,2007,3: 1266-1271
[11]Dickey M D,Weiss E A,Smythe E J,et al.ACS Nano,2008, 2:800-808
[12]Zampieri A,Schwieger W,Zollfrank C,et al.Handbook of Biomineralization:Biological Aspects and Structure Formation.Weinheim:Wiley,2007:255-288
[13]Huang J,Kunitake T.J.Am.Chem.Soc.,2003,125:11834-11835
[14]Zhao Y,Wei M,Lu J,et al.ACS Nano,2009,3:4009-4016
[15]Huang J,Ichinose I,Kunitake T.Chem.Commun.,2005,13: 1717-1719
[16]Dong Q,Su H,Zhang D,et al.Microporous Mesoporous Mater.,2007,98:344-351
[17]Wang H,Gao X,Wang Y,et al.Mater.Lett.,2012,76:237-239
[18]Li W,Wang X,Gao X,et al.Ceram.Inter.,2013,39:8521-8526
[19]KokuboT,TakadamaH.Biomaterials,2006,27:2907-2915
[20]Serrano M C,Pagani R,Vallet-Regi M,et al.Biomaterials, 2004,25:5603-5611
[21]HUANG Xiang-Hui(黄祥卉).Thesis for the Doctorate of Hunan University(湖南大学博士论文).2005.
[22]Sultan S,Kareem K,He L.Surf.Coat.Technol.,2016,300: 42-49
[23]Hua N,Wang H,Du Y,et al.Catal.Commun.,2005,6:491-496
[24]Yan X,Wei G,Zhao L,et al.Microporous Mesoporous Mater.,2010,132:282-289
Synthesis of New Mesoporous Bioactive Glass Microtubes by Biotemplate of Filter Paper
LÜ ZhuoDIAO Meng-XueGAO Ya-WenWANG Hong-Su*
(College of Food Science and Engineering,Jilin University,Changchun 130062,China)
Mesoporous bioactive glass microtubes were successfully prepared through a surface sol-gel process followed by a calcination treatment and using filter paper as the biotemplate.The tubular structures of rapid filter paper were replicated with the walls containing highly ordered mesoporous bioactive glasses as well.This simple biotemplate method provided a cost-effective and eco-friendly route to obtain advanced self-assembling mesoporous bioactive glass microtubes.By introducing FeCl3,mesoporous bioactive glass microtubes had not only delicate multichannel tubular structures,but also magnetic properties.As-synthesized mesoporous bioactive glass microtubes were characterized by scanning electron microscope(SEM),powder X-ray diffraction(XRD), transmissionelectronmicroscope(TEM)andnitrogenadsorption/desorption,fourier transform IR(FTIR) spectroscopy,and magnetization curves.The in vitro mineralization ability of mesoporous bioactive glass microtubes was tested in SBF to monitor the formation of hydroxycarbonate apatite(HCA).Dexamethasone(DEX) was employed as a model drug and the release profiles showed that the porous materials had a sustained drug delivery capability.The one-dimensional hollow tubular structure of the materials allowed the shorter release time of the DEX.The materials of three-day release time could also be used as carriers for oral drug.The biocompatibilities were also evaluated by culturing the MC3T3-E1 cells on mesoporous bioactive glass microtubes.The results showed that the materials had excellent potential applications in the field of sustained drug delivery.
filter papers;mesoporous;bioactive glass microtubes;magnetic properties;drug delivery
O61
A
1001-4861(2017)06-0947-07
10.11862/CJIC.2017.092
2016-09-01。收修改稿日期:2017-03-22。
国家自然科学基金(No.31402251)和教育部高等学校博士学科点专项科研基金(No.20130061120116)资助项目。
*通信联系人。E-mail:wanghs@jlu.edu.cn
——水芹主要害虫识别与为害症状
- 无机化学学报的其它文章
- CoAl2O4/蜂窝陶瓷催化剂的制备及其催化臭氧化性能
- Photocatalytic Hydrogen Production Based on Cobalt-Thiosemicarbazone Complex with the Xanthene Dye Moiety
- 两种金属-有机钙钛矿材料的负热膨胀性质
- Pyrazolate-Based Dipalladium(Ⅱ,Ⅱ)Complexes:Syntheses,Characterization and Catalytical Performance in Suzuki-Coupling Reaction
- Br-掺杂Bi2WO6的水热法合成及其可见光催化性能
- 添加NaBF4对阳极氧化法制备TiO2纳米管光催化剂的影响

