Br-掺杂Bi2WO6的水热法合成及其可见光催化性能
张田 邹正光,2 何金云,2 龙飞*,,2 王吉林,2 莫淑一,2
(1桂林理工大学材料科学与工程学院,桂林541004) (2有色金属及材料加工新技术教育部重点实验室,桂林541004)
Br-掺杂Bi2WO6的水热法合成及其可见光催化性能
张田1邹正光1,2何金云1,2龙飞*,1,2王吉林1,2莫淑一1,2
(1桂林理工大学材料科学与工程学院,桂林541004) (2有色金属及材料加工新技术教育部重点实验室,桂林541004)
以Bi(NO3)3·5H2O和Na2WO4·2H2O为主要原料,采用水热法合成了纯相Bi2WO6,并对其进行非金属离子Br-掺杂改性。采用XRD、SEM、TEM、XPS、Raman、PL和DRS研究了Br-掺杂对Bi2WO6的物相结构、形貌和可见光催化性能的影响。结果表明,Br-掺杂可有效提高Bi2WO6的可见光催化性能,当掺杂量(物质的量百分数)为8%时,溴掺杂Bi2WO6的光催化性能最好,可见光照射40 min后,可降解96.73%的罗丹明-B,与未掺杂Bi2WO6相比,其降解率提高了36.32%。
钨酸铋;水热法合成;Br掺杂;可见光催化
0 引言
随着现代生产技术的进步,日益严重的能源短缺和环境污染问题成为世界各国社会发展中不可忽视的问题。因此,自上世纪70年代,Fujishim等[1]发表了利用n型半导体TiO2单晶光解水制H2和 O2的研究论文后,光催化技术因可以利用太阳能降解有机污染物,在环境污染治理方面拥有重要的应用前景,引起了科研工作者的广泛关注和迅速发展。TiO2以其优异的抗化学和光腐蚀性能、价格低廉等优点成为光催化材料的研究热点[2-3],但其禁带宽度在3.2 eV左右[4],无法被可见光激发,因而极大地限制了TiO2的实际应用。因此,具有可优良见光催化活性材料的研究成为近几年光催化材料的研究热点。钨酸铋Bi2WO6(BWO)是最简单的Aurivillius氧化物之一,1999年Kudo等[5]首次报道了Bi2WO6光催化产O2的性能,作为光电材料具有良好应用前景[6-8]。类钙钛矿型Bi2WO6具有由八面体WO66-层和[Bi2O2]2+层相互交替排列的层状结构,WO66-八面体通过角共享彼此连接,这有利于光生电子和空穴的迁移[9]。Bi2WO6具有良好的可见光光催化活性,例如,纳米晶Bi2WO6对染料的光降解率是TiO2(P-25)的8倍[10]。但Bi2WO6(2.7 eV)的带隙相对较大,只能吸收450 nm以下的光,光生载流子的复合率较高[11-12]。这些问题极大地限制了其作为光电材料的进一步应用。
近年来,研究人员尝试了多种方法来改善Bi2WO6的光催化活性。例如在Bi2WO6表面负载贵金属Ag、Au或Pt纳米颗粒,利用它们的表面等离子体共振(SPR)效应来增强Bi2WO6的光催化活性[13-15]。一些研究人员尝试将Bi2WO6与具有离域共轭结构的碳材料结合,减少空穴电子对的复合,从而提高其光催化效率[16]。但这两种方法并不能改变Bi2WO6的能带结构,增强其固有的光催化活性。离子掺杂已被证明是改善Bi2WO6光催化活性的另一种有效的方法。非金属元素可以取代Bi2WO6中的O原子,减小带隙宽度,从而提高光催化性能。特别是卤族元素,可有效提高半导体的光电性能[17]。例如,Shi等[18]采用两步法合成了高活性的F离子掺杂的Bi2WO6,研究了F取代对Bi2WO6晶体结构和光催化活性的影响,其光催化降解甲基蓝的性能得到了极大提高。Zhang等[19]以碘化钾为碘源制备了碘掺杂的Bi2WO6光催化剂,发现掺杂碘离子后,减小了晶粒尺寸,带隙变窄并产生了大量的氧空位,因而其光催化性能得到了很大的提高。
本文采用水热法合成了Br离子掺杂的Bi2WO6,通过XRD、SEM、TEM和XPS等测试方法对产品的化学组成、晶型结构、形貌及光物理性能进行了表征。比较了不同Br离子掺杂浓度对Bi2WO6光催化性能的影响,以获得具有优异光催化性能的Bi2WO6产品。
1 实验部分
1.1 样品的合成
本研究中使用的试剂全部为分析纯,均购自国药集团化学试剂有限公司。合成Br离子掺杂Bi2WO6的具体方法如下:称取2.5 mmol Na2WO4· 2H2O室温溶解于20 mL去离子水中,5 mmol Bi(NO3)3·5H2O溶液80℃溶解于25 mL乙酸中,将2种溶液磁力搅拌混合2 h,再将不同质量的KBr (KBr相对于Bi2WO6的物质的量百分数分别为0、4%、8%、12%、16%)加入到混合溶液中,得到白色悬浊液,将其注入到100 mL水热高压釜中,于180℃下水热反应15 h,然后自然冷却至室温。得到的沉淀物分别用去离子水和无水乙醇离心洗涤3次,在80℃干燥12 h,最后得到淡黄色的样品。随着KBr添加量的增加,产品分别标记为BWO-x(x= 0,1,2,3,4)。
1.2 样品的表征
采用X射线粉末衍射仪(XRD,Panalytical,X′pert PRO型)以10°·min-1的扫描速率对样品的组成进行分析(Cu Kα,λ=0.154 06 nm,U=40 kV,I=40 mA, 2θ=20°~80°);采用场发射扫描电子显微镜(FESEM,Hitachi,S-4800,30 kV)和透射电子显微镜(TEM,JEOL,JEM-2100F)对样品的微观形貌和显微结构进行表征(200 kV);采用X射线能谱仪(EDS,Oxford,INCA IE 350)和X射线光电子能谱仪(XPS,Thermo Electron Corporation,ESCALAB 250Xi)对样品的元素组成及存在形态进行分析;采用UV-Vis分光光度计(DSR,Shimadzu,UV-3600)测试样品的光吸收性能(以高纯BaSO4为参比);采用氮气吸附比表面积仪(Quantachrome,NOVA 1200e)测试样品的吸附-脱附性质;采用荧光分光光度计(PL,Agilent,VARIAN)和激光拉曼光谱仪(Raman,Thermo Fisher Scientific,DXR)分别测试样品的荧光光谱和拉曼光谱。
1.3 光催化性能测试
光催化反应在BL-GHX-V型(上海Bilon)光化学反应仪中进行。光源为500 W的氙灯(氙灯与反应器之间加入滤波片,λ>420 nm)。配置50 mL初始浓度为20 mg·L-1的罗丹明B[20-21]溶液于石英试管中,加入50 mg催化剂。在光催化反应前,将含有催化剂的罗丹明B悬浊液置于光化学反应器内避光磁力搅拌60 min,使催化剂达到吸附-脱附平衡。然后打开光源,边照射边搅拌,每隔10 min取出约5 mL悬浊液,进行高速离心(10 000 r·min-1),以除去悬浊液中的催化剂颗粒,得到上层清液。采用UVVis光谱仪(Shimadzu UV-3600)测试553 nm波长(罗丹明B的最大吸收波长)处上层清液的吸光度。罗丹明B的降解率R按照公式(1)计算:

式中:C0为罗丹明B溶液的初始浓度(mg·L-1);Ct为光催化反应不同时间后罗丹明B溶液的浓度(mg·L-1)。
2 结果与讨论
2.1 样品的物相分析
图1为不同Br掺杂量Bi2WO6样品的XRD图。所有样品的主要衍射峰均与正交结构的Bi2WO6(PDF No.39-0256)相一致,其中未掺杂Bi2WO6样品的衍射峰强度较强,说明样品具有较高的结晶度。在Br离子掺杂样品的衍射图中没有发现与Br相关的衍射峰,说明Br离子掺杂并没有改变Bi2WO6的正交结构(图1a)。从放大的XRD图(图1b),我们发现在掺杂之后衍射峰向高角度有微弱偏移,这可能是因为微量Br离子取代O2-后发生了较小的晶格畸变。
2.2 样品的化学组成分析
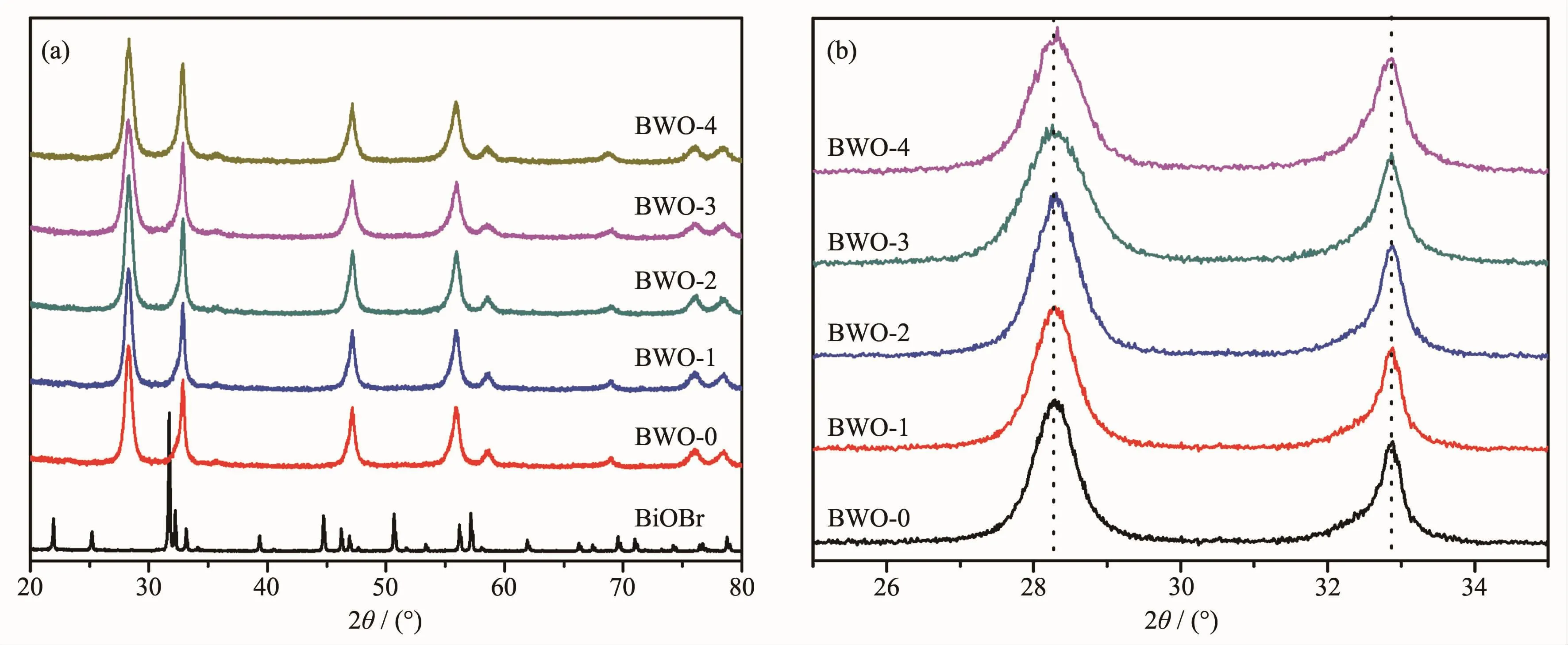
图1 不同掺杂量BWO-x(x=0,1,2,3,4)样品的XRD图Fig.1X-ray diffraction patterns of the BWO-x(x=0,1,2,3,4)samples
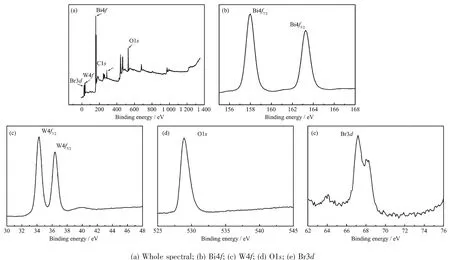
图2BWO-2样品的XPS谱图Fig.2XPS spectra from the surface of 8%Br-Bi2WO6samples
图2 为Br离子掺杂量为8%时样品的XPS图谱。从样品的全谱扫描图(图2a)可以看出,样品主要含有Bi、W、O、Br和C元素(其中的C元素是由于在样品制备和测量过程中有机物的污染造成的)。图2b、2c、2d分别是Bi4f、W4f和O1s的电子结合能特征峰。Bi4f显示出2个特征峰,分别对应于Bi4f7/2(157.9 eV)和Bi4f5/2(163.2 eV),与标准数值比较后,可以定性为Bi3+;根据W4f显示的2个特征峰W4f7/2(34.2 eV)、W4f5/2(36.1 eV)和O1s的特征峰(528.9 eV)的结合能位置确定W和O元素分别是以W6+和O2-的形式存在。由图2e可以清晰地看见样品的Br3d特征峰(67.3 eV),结合XRD分析得出样品Br离子的有效掺入[22-23]。
2.3 样品的形貌分析
图3为不同Br离子掺杂量的Bi2WO6样品的FESEM图及Br离子掺杂量为8%样品EDS图。从图中可以看出,纯相的Bi2WO6样品(图3a)由不规则的片状结构组成,其颗粒大小为0.2~1 μm。这种片状结构的形成与Bi2WO6晶体具有的各向异性生长特性有关。随着Br离子掺杂量的增加,产品的颗粒减小,当Br离子的掺杂量为8%时(图3b~e),产品主要由大小为100 nm~0.5 μm的颗粒组成,说明Br离子的掺杂抑制了Bi2WO6晶体的生长。图3f为Br离子的掺杂量为8%时,样品的X射线能谱分析(EDS)。从图3f可以看出,EDS的主峰分别对应Bi、W、O和Br元素,没有检测到其他杂质元素的峰,说明样品中有Br的存在。图4为未掺杂Bi2WO6与Br离子的掺杂量为8%时样品的透射电镜(TEM)和高分辨率透射电镜(HRTEM)照片。从TEM图可以看出,样品中的部份颗粒大小为100~200 nm。样品(200)晶面和(260)晶面的晶格间距分别为0.25和0.19 nm。不同Br离子掺杂量的Bi2WO6样品的能谱数据如表1。从表1可知样品中Br离子的存在,并且随着Br-掺杂量的增加,样品中Br-的含量也随之增加,与未掺杂的样品相比,掺杂后的样品O2-含量降低,实际掺杂量与理论投料量相当。说明Br离子已经掺杂进样品。

图3 不同Br掺杂量Bi2WO6样品的SEM图像Fig.3FE-SEM images of the Br-doped Bi2WO6samples

图48 %Br-Bi2WO6样品的TEM图像Fig.4TEM image of the 8%Br-Bi2WO6samples
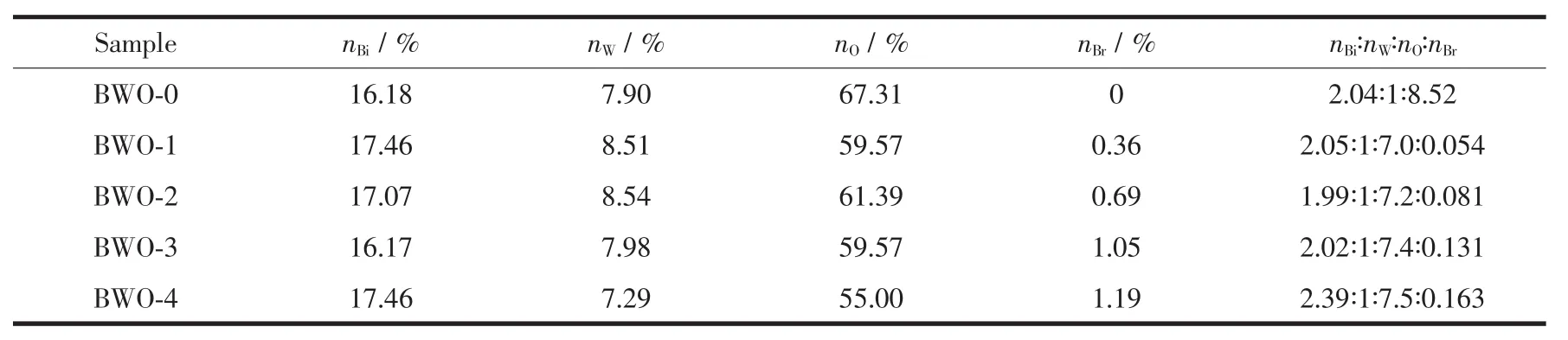
表1 不同Br离子掺杂量的Bi2WO6样品的元素组成Table 1Elements composition of the Br-doped Bi2WO6samples
2.4 样品的拉曼光谱分析
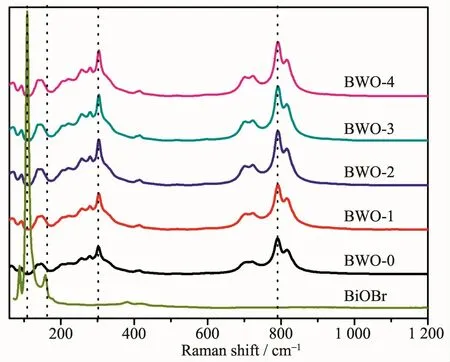
图5不同掺杂量BWO-x(x=0,1,2,3,4)样品的拉曼光谱Fig.5Raman spectra of the BWO-x(x=0,1,2,3,4) samples
图5 为未掺杂Bi2WO6和不同Br离子掺杂量的Bi2WO6样品的拉曼光谱图。从图中可以看出:未掺杂的Bi2WO6样品的拉曼光谱图中,分别位于820、790、723和302 cm-1处的峰是Bi2WO6的特征振动模式引起的,与文献所报道的一致[24-25]。790和820 cm-1处的振动峰归因于O-W-O的对称和反对称Ag模式,且723 cm-1处的振动峰与钨酸盐相关。在302 cm-1处的峰归因于Bi3+和WO66-的谐振模式[26]。而BiOBr的特征峰分别在110和158 cm-1处[27],Bi2WO6样品并没有产生与Br相关的伸缩振动峰,其峰的位置也几乎没有偏移,说明掺入Br离子后,样品为纯Bi2WO6,且掺杂Br离子后,Bi2WO6的晶格畸变较小,这与XRD的结果相一致。
2.5 样品的比表面积分析
图6为未掺杂Bi2WO6与Br离子掺杂量为8%时样品的氮气吸附等温线和孔径分布曲线。与未掺杂Bi2WO6相比,Br离子掺杂样品在相对高的压力下显示出较高的吸收,说明在该样品中存在介孔。未掺杂Bi2WO6和Br离子掺杂样品分别在1.72和1.77 nm的区域中呈现出它们最大的孔径分数。未掺杂Bi2WO6和Br离子掺杂样品的比表面积分别为25 m2·g-1和40 m2·g-1,这说明掺杂Br离子后,抑制了Bi2WO6的晶体生长,从而增加了比表面积。具有高比表面积的样品能促进活性位点与降解物的接触进而提高产品的光催化效率。
2.6 样品的紫外-可见漫反射光谱分析
图7a为未掺杂Bi2WO6与不同Br离子掺杂量样品的紫外-可见吸收光谱。从图中可以看出,所有样品在可见光区域(λ>420 nm)均有明显吸收。且掺入Br离子后,样品的吸收边发生红移,说明Br离子的掺杂扩大了Bi2WO6对可见光的响应范围,提高了对可见光的利用率。通过公式(2)可计算样品的带隙:

其中α、Eg和h分别表示吸收光的频率、带隙和普朗克常数。n值与不同类型的跃迁相关,n=4,1,分别对应于间接和直接带隙。Bi2WO6是直接带隙型半导体,因此n=1[28]。如图7b所示,未掺杂Bi2WO6的带隙约为2.68 eV,Br离子掺杂量为8%时样品的带隙约为2.60 eV。因此,掺入Br离子后,降低了Bi2WO6产品的带隙,而带隙的降低有利于光催化活性的提高。
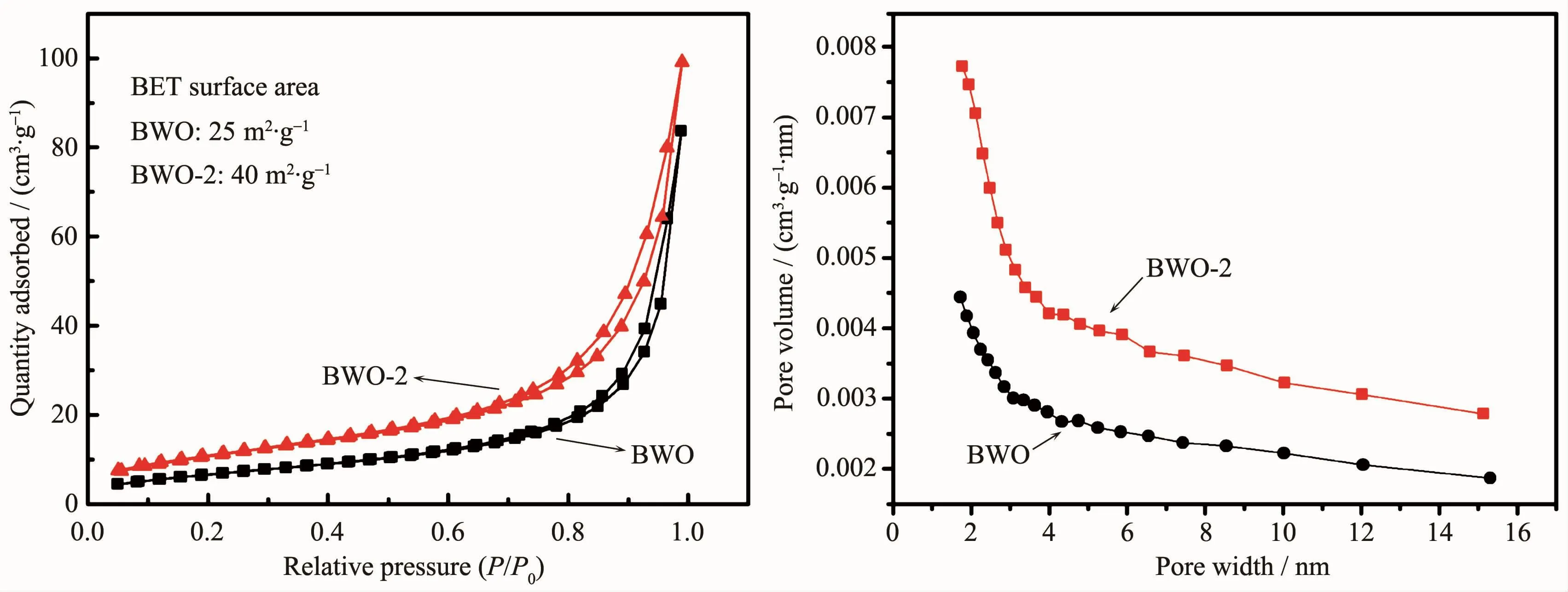
图6 Bi2WO6和8%Br-Bi2WO6样品的吸附/脱附等温线及孔径分布曲线Fig.6Adsorption/desorption isotherms and pore volume distribution curve of Bi2WO6and 8%Br-Bi2WO6samples
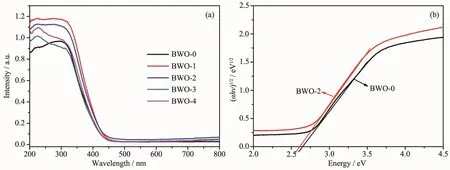
图7 (a)不同掺杂量BWO-x(x=0,1,2,3,4)样品的紫外-可见吸收光谱,(b)Bi2WO6和8%Br-Bi2WO6样品的带隙Fig.7(a)UV-Vis diffuse reectance spectra of the pristine Bi2WO6and BWO-x(x=0,1,2,3,4)samples; (b)Band gap evaluation of the pristine Bi2WO6andthe 8%Br-Bi2WO6samples
2.7 样品的荧光光谱分析
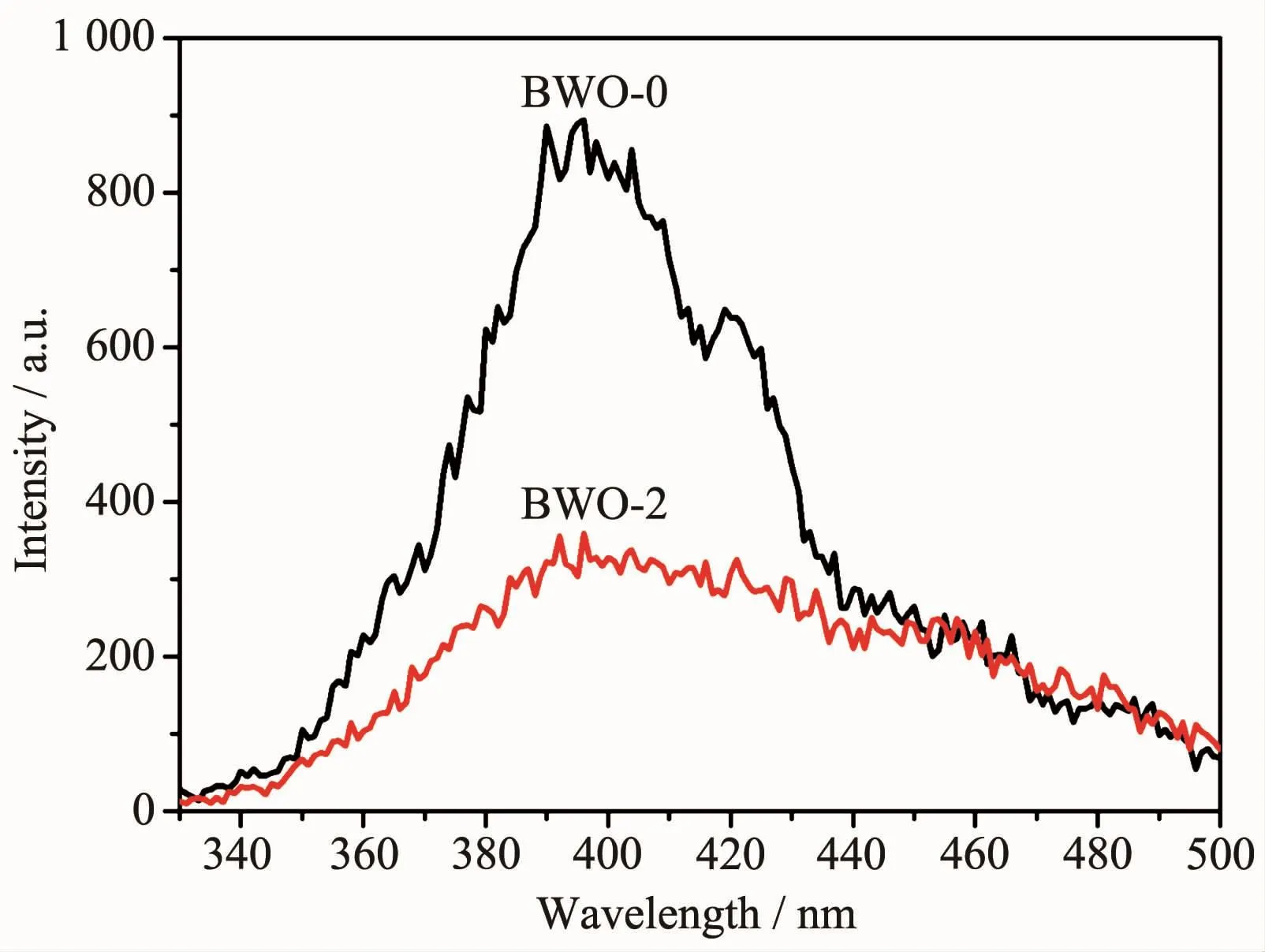
图8Bi2WO6和8%Br-Bi2WO6样品的荧光光谱Fig.8PL spectra of Bi2WO6and 8%Br-Bi2WO6samples
图8 为未掺杂Bi2WO6与Br离子掺杂量为8%时样品的荧光光谱。荧光光谱主要由半导体中自由电荷载流子的复合产生,通常用于研究电荷载流子捕获、迁移和分离的效率。在光催化过程中,材料在光照时的电子-空穴分离效率对其光催化性能有重要的影响[21]。如图8所示,与未掺杂的Bi2WO6样品相比,掺杂后的样品发光特征峰位置几乎没有改变,但强度缺大大降低,说明电子-空穴得到有效分离,复合率进一步降低,促进其光催化活性提高[29]。
2.8 光催化性能测试
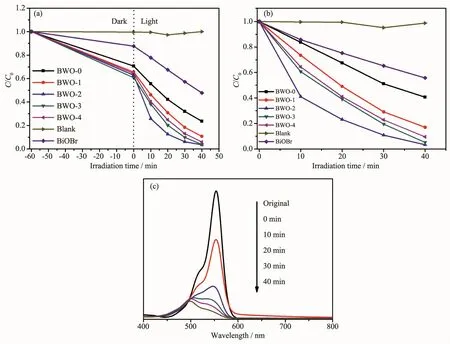
图9(a,b)BiOBr和不同掺杂量BWO-x(x=0,1,2,3,4)样品的可见光光催化活性,(c)在可见光(λ>420 nm)照射下8%Br-Bi2WO6样品随时间变化降解罗丹明-B的吸收光谱Fig.9(a,b)Visible-light-driven photocatalytic performances of BiOBr and BWO-x(x=0,1,2,3,4)samples;(c)Temporal evolution of the spectra during the photodegradation of RhB mediated by 8%Br-Bi2WO6catalyst under visible light illumination(λ>420 nm)
图9 a为BiOBr和不同Br离子含量掺杂Bi2WO6样品在可见光照射下,降解染料罗丹明B的光催化效率。可见光照射40 min后,在没有光催化剂时,罗丹明B的光降解很小,说明罗丹明B在可见光照射下是稳定的。加入Bi2WO6催化剂后在避光的条件下,罗丹明B在60 min内达到吸附平衡。与BiOBr相比Bi2WO6具有更高的吸附性能,且Br离子掺杂后罗丹明B的吸附量进一步提升。图9b为样品在可见光照射下,扣除吸附反应后降解染料污染物罗丹明B的催化效率。当以未掺杂Bi2WO6为催化剂时,可见光照射40 min后罗丹明B的降解率仅为60.41%。掺杂Br离子后,Bi2WO6产品的光催化活性明显优于BiOBr和未掺杂Bi2WO6样品的光催化性能。当掺杂量为8%时,可见光照射40 min后罗丹明B的降解率达96.73%。与未掺杂Bi2WO6和BiOBr相比,其降解效率分别提高了36.32%和44.51%。图9c是掺杂量为8%时,样品对罗丹明B的吸光度变化曲线。由图中可知,罗丹明B的特征峰位置位于553 nm处。在暗态下样品对罗丹明-B的吸附较强,随着光照时间的增加,罗丹明B的特征峰位置从553 nm逐渐移到500 nm处,并且吸光度逐渐下降,说明罗丹明B被完全降解,悬浮液的颜色由玫瑰红色先变为较浅的黄绿色,然后进一步变为无色透明溶液。
掺杂Br离子后,Bi2WO6产品光催化性能得到极大提高的原因是:适量的Br离子作为杂质元素引入到Bi2WO6的晶体结构中后,O离子被卤族元素Br离子取代,在Bi2WO6中产生了晶格缺陷,它可以作为有效的电子受体,减少催化剂表面光生电子和光生空穴的复合,使催化剂的光催化活性得到提高。当掺杂量过小时,对电荷的捕获不足,不能及时有效地分离光生载流子,随着掺杂量的增加,所产生的晶格缺陷随之增多,导带与价带之间形成了掺杂能级,使得电子跃迁时的能隙变窄,提高了对可见光的利用率。此外,掺杂Br离子后,增加了产品的比表面积,从而减小了光生载流子迁移到催化剂颗粒表面的距离,加快了光生载流子迁移到颗粒表面的速率,降低光生电子-空穴对的复合率,提高光吸收效率和光吸收量,因而样品的光催化性能得以提高[30-31]。综合以上分析,Br离子掺杂浓度对Bi2WO6催化剂的颗粒大小、光吸收边、能带和比表面积等均有较大的影响,导致不同Br离子掺杂浓度时产品光催化性能的不同。
3 结论
以一步水热法合成了卤族元素Br离子掺杂的Bi2WO6光催化剂。掺杂Br离子后,Bi2WO6产品的光催化性能得到了明显提高,当掺杂量为8%时,可见光照射40 min后罗丹明B的降解率达96.73%。与未掺杂Bi2WO6相比,其降解效率提高了36.3%。适量的Br离子引入到Bi2WO6中后,在Bi2WO6的晶体结构中产生了晶格缺陷,导带与价带之间形成了掺杂能级,增加了产品的比表面积,降低了光生电子-空穴对的复合率。另一方面,掺杂Br离子后,降低了产品的带隙,吸收边带发生红移,提高了对可见光的吸收,因而样品的光催化性能得到了提高。
[1]Fujishima A,Honda K.Nature,1972,238:37-38
[2]Yang K,Dai Y,Huang B,et al.J.Phy.Chem.C,2009,113: 2624-2629
[3]WANG Dan-Jun(王丹军),YUE Lin-Lin(岳林林),GUO Li(郭莉),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30 (4):961-968
[4]Carp O,Huisman C,Reller A.Prog.Solid State Chem.,2004, 32:33-177
[5]Kudo A,Hijii S.Chem.Lett.,1999,28:1103-1104
[6]Ishikawa K,Watanabe T,Funakubo H.Thin Solid Films, 2001,392:128-133
[7]Hamada M,Tabata H,Kawai T.Thin Solid Films,1997,306: 6-9
[8]Ding X,Zhao K,Zhang L.Environ.Sci.Technol.,2014,48: 5823-5831
[9]Zhang L S,Wang H L,Chen Z G,et al.Appl.Catal.B,2011, 106:1-13
[10]Xu C X,Wei X,Guo Y H,et al.Mater.Res.Bull.,2009,44: 1635-1641
[11]Fu H,Pan C,Yao W,et al.J.Phys.Chem.B,2005,109: 22432-22439
[12]Girish K S,Koteswara R K S R.Appl.Surf.Sci.,2015,355: 939-958
[13]Zhang Z J,Wang W Z,Gao E P,et al.J.Phy.Chem.C, 2012,116:25898-25903
[14]Yang J,Wang X H,Chen Y M,et al.RSC Adv.,2015,5: 9771-9782
[15]Qamar M,Elsayed R B,Alhooshani K R,et al.ACS Appl. Mater.Interfaces,2015,7:1257-1269
[16]Yue L F,Wang S F,Shan G Q,et al.Appl.Catal.B,2015, 176-177:11-19
[17]Yang K S,Dai Y,Huang B B,et al.Chem.Mater.,2008,20: 6528-6534
[18]Shi R,Huang G L,Lin J,et al.J.Phy.Chem.C,2009,113: 19633-19638
[19]Zhang J,Huang Z H,Xu Y,et al.Int.J.Photoenergy,2012, 2012:1-12
[20]Huang Y K,Kang S F,Yang Y,et al.Appl.Catal.B,2016, 196:89-99
[21]Li C M,Chen G,Sun J X,et al.Appl.Catal.B,2016,188:39-47
[22]Dong H,Chen G,Sun J,et al.Dalton Trans.,2014,43:7282-7289
[23]Xu H,Zhu J X,Song Y X,et al.RSC Adv.,2014,4:9139
[24]Ma H W,Shen J F,Shi M,et al.Appl.Catal.B,2012,121-122:198-205
[25]Li Y,Liu J,Huang X,et al.Dalton Trans.,2010,39:3420-3425
[26]Zhang L W,Wang Y J,Cheng H Y,et al.Adv.Mater.,2009, 21:1286-1290
[27]Zhang D,Li J,Wang Q G,et al.J.Mater.Chem.A,2013,1: 8622
[28]Tian N,Zhang Y H,Huang H W,et al.J.Phy.Chem.C, 2014,118:15640-15648
[29]Fan X Y,Yue X,Luo J M,et al.J.Nanopart.Res.,2016, 18:65
[30]Ni M,Leung M,Leung D.Int.J.Hydrogen Energy,2007, 32:2305-2313
[31]Fu Y,Chang C,Chen P,et al.J.Hazard.Mater.,2013,254-255:185-192
Hydrothermal Synthesis and Visible-Light Photocatalytic Performance of Br-Doped Bi2WO6
ZHANG Tian1ZOU Zheng-Guang1,2HE Jin-Yun1,2LONG Fei*,1,2WANG Ji-Lin1,2MO Shu-Yi1,2
(1School of Materials Science and Engineering,Guilin University of Technology, Guilin University of Technology,Guilin,Guangxi 541004,China) (2Key Laboratory of Nonferrous Materials and New Processing Technology,Ministry of Education,Guilin,Guangxi 514004,China)
Br-ions doped Bi2WO6was prepared using bismuth nitrate Bi(NO3)3·5H2O and sodium tungstate Na2WO4· 2H2O as raw materials by hydrothermal synthesis method.The effect of Br-doping on the phase structure, morphology and visible light catalytic properties of Bi2WO6was investigated using XRD,SEM,TEM,XPS, Raman,PL and DRS.The results indicated that the visible-light-driven photocatalytic performance of Bi2WO6was greatly enhanced after Br-doping.When Br-was doped with 8%of the amount(percentage of amount of substance),the Bi2WO6photocatalyst displayed the best photocatalytic performance.It could decompose 96.73% RhB after 40 minutes irradiation,which was 36.32%higher than that of the pristine one.
Bi2WO6;hydrothermal synthesis method;Br doping;visible-light-driven photocatalytic performance
O613.43;O643.32+2
A
1001-4861(2017)06-0954-09
10.11862/CJIC.2017.093
2016-11-11。收修改稿日期:2017-03-17。
国家自然科学基金(No.51662005)和广西自然科学基金(No.2014GXNSFFA118004)资助项目。
*通信联系人。E-mail:longf@glut.edu.cn
- 无机化学学报的其它文章
- CoAl2O4/蜂窝陶瓷催化剂的制备及其催化臭氧化性能
- Photocatalytic Hydrogen Production Based on Cobalt-Thiosemicarbazone Complex with the Xanthene Dye Moiety
- 两种金属-有机钙钛矿材料的负热膨胀性质
- Pyrazolate-Based Dipalladium(Ⅱ,Ⅱ)Complexes:Syntheses,Characterization and Catalytical Performance in Suzuki-Coupling Reaction
- 以滤纸为模板合成新型介孔生物活性玻璃微管材料
- 添加NaBF4对阳极氧化法制备TiO2纳米管光催化剂的影响

