同型半胱氨酸与炎症性肠病及其癌变的关系
沈嘉昕 王承党
福建医科大学附属第一医院消化内科 消化内镜中心 消化系病研究室(350005)
·综 述·
同型半胱氨酸与炎症性肠病及其癌变的关系
沈嘉昕 王承党*
福建医科大学附属第一医院消化内科 消化内镜中心 消化系病研究室(350005)
炎症性肠病(IBD)是一组非特异性肠道慢性炎症性疾病,结肠炎相关结肠癌(CACC)是其主要并发症之一。同型半胱氨酸作为甲硫氨酸循环的重要中间代谢产物,其水平升高与IBD和CACC的发生、发展密切相关。本文就同型半胱氨酸与IBD及其癌变关系的研究进展作一综述。
高半胱氨酸; 炎症性肠病; 结肠炎,溃疡性; Crohn病; 结肠肿瘤
同型半胱氨酸(homocysteine, Hcy)是一种含硫氨基酸,其血浆水平主要受叶酸、维生素(Vit)B12、Vit B6水平以及相关代谢酶的遗传多态性影响。目前认为高Hcy血症是心血管疾病的独立危险因素[1],临床上将防治高Hcy血症作为心血管疾病的一级预防措施。
炎症性肠病(inflammatory bowel disease, IBD)是一组非特 异性肠道慢性炎症性疾病,主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD),结肠炎相关结肠癌(colitis-associated colon cancer, CACC)是其主要并发症之一。近年研究[2-4]表明, IBD和CACC患者的血浆Hcy水平明显升高。本文就Hcy与IBD及其癌变关系的研究进展作一综述。
一、Hcy代谢和高Hcy血症
Hcy作为一种具有细胞毒性的非必需四碳含硫氨基酸,是饮食中摄取的甲硫氨酸去甲基后形成的重要中间代谢产物。甲硫氨酸在甲硫氨酸腺苷转移酶的作用下转化为S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM),后者作为主要甲基供体,脱甲基后生成S-腺苷同型半胱氨酸(S-adenosyl-homocysteine, SAH),再水解生成Hcy。Hcy的主要生理功能是维持体内含硫氨基酸平衡,其体内代谢途径主要有3条[5-6]:①再甲基化途径:甲硫氨酸负平衡或甲基需求过多时,体内大部分Hcy在以Vit B12为辅酶的甲硫氨酸合成酶(methionine synthase, MS)和5,10-亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase, MTHFR)催化下,以甲基四氢叶酸为甲基供体重新甲基化形成甲硫氨酸。甲硫氨酸经SAM、SAH生成Hcy,Hcy再甲基化重新生成甲硫氨酸,此循环过程称为甲硫氨酸循环。少部分在肝脏、肾脏中的Hcy以甜菜碱为甲基供体,在甜菜碱同型半胱氨酸甲基转移酶的作用下生成甲硫氨酸。②转硫化途径:甲硫氨酸过剩或甲基需求减少时,Hcy在Vit B6依赖的胱硫醚β-合成酶(cystathionine β-synthase, CBS)催化下,与丝氨酸发生不可逆缩合反应,生成胱硫醚,并进一步分解成半胱氨酸和α-丁酮酸,前者可转变为谷胱甘肽、牛磺酸或代谢为硫酸盐经尿液排出。③直接释放:体内仅极少部分Hcy被直接释放至细胞外基质(ECM)中,故正常人血浆Hcy水平极低。
正常成年人血浆Hcy水平为5~15 μmol/L,血浆水平大于 15 μmol/L 即为高Hcy血症。引起高Hcy血症的可能因素包括[5]:①遗传因素:编码CBS、MTHFR、MS等Hcy代谢关键酶的基因发生突变,引起酶缺陷或活性降低。②营养因素:对血浆Hcy水平影响最大,如叶酸、Vit B6、Vit B12等缺乏可导致Hcy代谢通路受阻,使血浆Hcy水平升高,其中叶酸缺乏是高Hcy血症的独立危险因素[7]。③性别和年龄:雌激素可降低血浆Hcy水平,故男性血浆Hcy水平高于女性;女性血浆Hcy水平在妊娠期降低,在绝经后升高。由于Hcy可经肾脏代谢,而肾脏代谢功能随年龄增长而降低,故血浆Hcy水平随年龄增长而升高。④药物:异烟肼、二甲双胍等药物可致血浆Hcy水平升高。⑤生活方式:吸烟、饮酒、肥胖等因素易导致高Hcy血症。
二、IBD及其癌变与高Hcy血症
国内外对伴高Hcy血症的结肠炎动物模型的研究[8-9]发现,与单纯结肠炎大鼠相比,皮下注射Hcy的结肠炎大鼠疾病活动指数(DAI)、结肠大体损伤指数(CMDI)、组织学指数(HI)和肠壁纤维化评分均显著升高,反映结肠炎症程度的血浆和肠黏膜组织中的髓过氧化物酶(MPO)活性亦升高。该结果表明高Hcy血症可能加重结肠炎大鼠的结肠组织氧化和炎症损伤,促进其肠壁纤维化。
临床研究[2-4]同样发现IBD患者血浆Hcy水平明显升高。Drzewoski等[10]发现活动期UC患者血浆Hcy水平显著高于缓解期,且与疾病持续时间呈正相关(r=0.663 2,P<0.05)。但亦有学者认为血浆Hcy水平与UC和CD患者的病程、疾病严重程度、病变累及范围等均无相关性[11-13]。以上研究结果不一致可能与各研究纳入的总样本量和(或)缓解期患者样本量不同有关。
IBD患者尤其是UC患者癌变率较高,而血浆Hcy水平升高是CACC发生的危险因素之一[14]。Chiang等[15]在一项病例对照研究中指出,Hcy与CACC的发生、发展有关,高Hcy血症可显著增加CACC的发生风险。Phelip等[16]发现,当高Hcy血症是由叶酸缺乏所致时,CACC发生风险将显著增加(OR=16.9, 95% CI: 2.3~126.7);而在叶酸缺乏但血浆Hcy水平正常的患者中,CACC发生风险未见明显改变。上述结果表明单纯叶酸缺乏并不影响CACC的发生,这与Akoglu等[17]的研究结果一致。
三、高Hcy血症参与IBD的机制
1. 促进氧化应激:活性氧簇(ROS)诱发的氧化应激能直接损伤肠上皮细胞,加重肠道炎症,此为IBD的重要发病机制之一[18]。研究表明Hcy在过渡金属催化剂和分子氧的参与下,通过诱导脂质过氧化物和含硝基化合物合成,发生自氧化反应,形成ROS,诱发氧化应激,导致肠道炎症[19]。且高Hcy血症可通过降低抗氧化酶如超氧化物歧化酶、谷胱甘肽过氧化物酶等的表达和活性,降低肠道清除ROS的能力,从而加重肠道氧化应激[20]。
2. 上调促炎因子表达:免疫细胞和上皮细胞产生的促炎细胞因子导致辅助性T细胞(Th细胞)与调节性T细胞(Treg细胞)失衡,在IBD发生、发展中起重要作用。研究表明UC发病与白细胞介素-6/信号转导和转录激活因子3/细胞因子信号转导抑制因子3(IL-6/STAT3/SOCS3)信号通路激活有关[21];IL-6、IL-8可诱导Th17细胞分化,抑制Treg细胞分化,导致两者失衡,从而促进肠道炎症,并刺激炎症细胞持续分泌IL-17,形成恶性循环[22]。体外研究[23]发现,Hcy可通过诱导血管内皮细胞、平滑肌细胞和单核细胞分泌多种趋化因子和炎性因子,如单核细胞趋化蛋白-1(MCP-1)、IL-8、IL-6、IL-1β等,加重肠道局部免疫异常,促进肠道炎症。Hcy还可通过激活转录因子核因子-κB(NF-κB)诱导血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)、纤溶酶原激活物抑制剂-1(PAI-1)、肿瘤坏死因子-α(TNF-α)等表达并介导细胞毒反应,引发肠道慢性炎症。
3. 抑制DNA甲基化:甲基转移酶催化的DNA甲基化能调节多种活性分子表达。在甲硫氨酸循环中,Hcy可转变为SAM,而后者是甲基转移酶强效抑制剂。血浆Hcy水平升高时,SAM生成增多,使甲基化反应受抑制,而DNA特定区域低甲基化可激活促炎因子表达,介导炎症反应[24]。因此,IBD患者的高Hcy血症可能通过抑制相关基因DNA甲基化水平引起炎症、凋亡相关因子高表达,参与疾病进展。
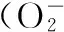
5. 诱导内质网应激:Hcy作为公认的内质网应激诱导剂,可通过改变特定基因的甲基化水平、诱导肠道氧化应激等途径影响内质网内的蛋白质折叠,导致肠道细胞发生内质网应激,从而触发未折叠蛋白反应,再通过蛋白激酶R样内质网激酶(PERK)、活化转录因子6(ATF6)和Ⅰ型内质网转膜蛋白激酶(IRE1)这三种内质网固有分子介导细胞凋亡[27]。
6. 促进肠壁纤维化:长期慢性炎症导致肠道间质细胞过度增殖、肠壁ECM沉积和肠道肌层过度生长,促使肠壁纤维化,引发肠腔狭窄,故ECM代谢失衡是肠壁纤维化的主要原因[28]。基质金属蛋白酶(MMPs)可介导ECM 降解,而金属蛋白酶组织抑制剂(TIMPs)可抑制MMPs,维持两者间的平衡是保证ECM正常代谢的关键。Abreu等[29]利用2,4,6-三硝基苯磺酸(TNBS)诱导大鼠结肠炎的研究发现,血浆高Hcy水平可促进转化生长因子-β1(TGF-β1)、结缔组织生长因子(CTGF)等促纤维化因子表达,影响MMPs/TIMPs平衡,加重大鼠肠壁纤维化。
7. 增加肠黏膜通透性:高Hcy血症可诱发IBD患者肠黏膜炎症,释放的炎症介质破坏肠上皮完整性,导致其通透性增加。Munjal等[30]的研究发现,Hcy可激活MMP-2和MMP-9,下调钙黏蛋白以及闭合小环蛋白-1(ZO-1)等细胞间紧密连接蛋白表达,开放上皮细胞间紧密连接,增加肠黏膜通透性。
四、高Hcy血症与CACC
目前广为接受的CACC发生途径为:长病程IBD→慢性炎症→异型增生→癌变。除诱导氧化应激外,高Hcy血症还可能通过以下机制参与CACC发病。
1. 基因水平:DNA甲基化可调节基因转录水平,低甲基化可致相关基因表达上调。基因组(包括编码区和非编码区)DNA低甲基化可影响DNA整合,使其修复受损,导致染色体不稳定、基因突变等,从而激活原癌基因、改变抑癌基因表达,导致肿瘤发生[31]。如前文所述,高Hcy血症可使DNA发生异常甲基化,而基因组和癌基因的低甲基化可导致CACC发生。
2. 细胞水平:Hcy硫内酯可引起肠壁纤维化、血管生成、胶原性炎症、钙化、鳞状上皮化生、角质化、肠上皮异型增生等细胞增殖性改变,诱发CACC[32]。高Hcy血症诱导产生的过氧化氢可抑制内皮细胞呼吸而导致其损伤,并可刺激平滑肌细胞增殖[33],从而参与CACC发病。此外,Hcy还可破坏IBD患者体内的凝血-纤溶平衡,促进血栓形成,继而可能诱发肿瘤生长和浸润。
3. 细胞因子水平:Hcy能刺激肠黏膜组织产生细胞黏附分子、趋化因子、细胞因子,进而诱发肠道癌变。尤其是在IBD活动期,肠黏膜固有层IL-6、TNF-α等促炎细胞因子表达上调,介导细胞毒反应[34]。动物实验表明,IL-6可激活下游STAT3信号通路,诱导肠上皮细胞增殖和癌变,而肠道黏膜固有层巨噬细胞来源的IL-6/gp130/STAT3信号通路激活与CD癌变有关。此外,TNF-α可触发炎症级联反应,诱发癌变[35]。
五、结语
高Hcy血症与IBD和CACC之间的密切联系对IBD的临床治疗和CACC的预防具有重要指导意义。首先,对于IBD患者,可将血浆Hcy水平检测作为常规实验室检查项目;对伴有高Hcy血症的高危IBD患者应实施结肠镜筛查,这是目前早期发现CACC的最佳初级管理策略[36]。其次,对于存在高Hcy血症的UC和CD患者,应查明其血浆Hcy水平升高的原因,纠正营养不良,补充叶酸和Vit B[37],叶酸可作为CACC的化学预防药物[13]。
综上所述,目前研究认为高Hcy血症与IBD有关,并可诱发CACC。纠正高Hcy血症可能有助于IBD的恢复,并能有效预防CACC,但确切机制尚不明确,有待深入研究。
1 Fournier P, Fourcade J, Roncalli J, et al. Homocysteine in chronic heart failure[J]. Clin Lab, 2015, 61 (9): 1137-1145.
2 Kallel L, Feki M, Sekri W, et al. Prevalence and risk factors of hyperhomocysteinemia in Tunisian patients with Crohn’s disease[J]. J Crohns Colitis, 2011, 5 (2): 110-114.
3 Dagli N, Poyrazoglu OK, Dagli AF, et al. Is inflammatory bowel disease a risk factor for early atherosclerosis?[J]. Angiology, 2010, 61 (2): 198-204.
4 Chen M, Mei Q, Xu J, et al. Detection of melatonin and homocysteine simultaneously in ulcerative colitis[J]. Clin Chim Acta, 2012, 413 (1-2): 30-33.
5 Sharma M, Tiwari M, Tiwari RK. Hyperhomocysteinemia: impact on neurodegenerative diseases[J]. Basic Clin Pharmacol Toxicol, 2015, 117 (5): 287-296.
6 Selhub J. Homocysteine metabolism[J]. Annu Rev Nutr, 1999, 19: 217-246.
7 Hamatani R, Otsu M, Chikamoto H, et al. Plasma homocysteine and folate levels and dietary folate intake in adolescents and young adults who underwent kidney transplantation during childhood[J]. Clin Exp Nephrol, 2014, 18 (1): 151-156.
8 丁浩,梅俏,李颖,等. 同型半胱氨酸对实验性结肠炎大鼠肠纤维化的影响及其机制[J]. 中华消化杂志, 2014, 34 (9): 624-626.
9 Scherer EB, da Cunha AA, Kolling J, et al. Development of an animal model for chronic mild hyperhomocysteinemia and its response to oxidative damage[J]. Int J Dev Neurosci, 2011, 29 (7): 693-699.
10 Drzewoski J, Gasiorowska A, Maecka-Panas E, et al. Plasma total homocysteine in the active stage of ulcerative colitis[J]. J Gastroenterol Hepatol, 2006, 21 (4): 739-743.
11 Vagianos K, Bernstein CN. Homocysteinemia and B vitamin status among adult patients with inflammatory bowel disease: a one-year prospective follow-up study[J]. Inflamm Bowel Dis, 2012, 18 (4): 718-724.
12 陈茉莉, 梅俏, 许建明, 等. 溃疡性结肠炎患者血浆同型半胱氨酸和叶酸及维生素B12的检测水平及其临床意义[J]. 中华胃肠外科杂志, 2011, 14 (3): 185-187.
13 Owczarek D, Cibor D, Saapa K, et al. Homocysteine in patients with inflammatory bowel diseases[J]. Przegl Lek, 2014, 71 (4): 189-192.
14 Miller JW, Beresford SA, Neuhouser ML, et al. Homocysteine, cysteine, and risk of incident colorectal cancer in the Women’s Health Initiative observational cohort[J]. Am J Clin Nutr, 2013, 97 (4): 827-834.
15 Chiang FF, Wang HM, Lan YC, et al. High homocysteine is associated with increased risk of colorectal cancer independently of oxidative stress and antioxidant capacities[J]. Clin Nutr, 2014, 33 (6): 1054-1060.
16 Phelip JM, Ducros V, Faucheron JL, et al. Association of hyperhomocysteinemia and folate deficiency with colon tumors in patients with inflammatory bowel disease[J]. Inflamm Bowel Dis, 2008, 14 (2): 242-248.
17 Akoglu B, Milovic V, Caspary WF, et al. Hyperproliferation of homocysteine-treated colon cancer cells is reversed by folate and 5-methyltetrahydrofolate[J]. Eur J Nutr, 2004, 43 (2): 93-99.
18 Zhu H, Li YR. Oxidative stress and redox signaling mechanisms of inflammatory bowel disease: updated experimental and clinical evidence[J]. Exp Biol Med (Maywood), 2012, 237 (5): 474-480.
19 Loscalzo J. The oxidant stress of hyperhomocyst(e)inemia[J]. J Clin Invest, 1996, 98 (1): 5-7.
20 Kruidenier L, Kuiper I, Van Duijn W, et al. Imbalanced secondary mucosal antioxidant response in inflammatory bowel disease[J]. J Pathol, 2003, 201 (1): 17-27.
21 Ke X, Hu G, Fang W, et al. Qing Hua Chang Yin inhibits the LPS-induced activation of the IL-6/STAT3 signaling pathway in human intestinal Caco-2 cells[J]. Int J Mol Med, 2015, 35 (4): 1133-1137.
22 Ueno A, Jijon H, Chan R, et al. Increased prevalence of circulating novel IL-17 secreting Foxp3 expressing CD4+ T cells and defective suppressive function of circulating Foxp3+ regulatory cells support plasticity between Th17 and regulatory T cells in inflammatory bowel disease patients[J]. Inflamm Bowel Dis, 2013, 19 (12): 2522-2534.
23 Danese S, Sgambato A, Papa A, et al. Homocysteine triggers mucosal microvascular activation in inflammatory bowel disease[J]. Am J Gastroenterol, 2005, 100 (4): 886-895.
24 Kato S, Lindholm B, Stenvinkel P, et al. DNA hypermethylation and inflammatory markers in incident Japanese dialysis patients[J]. Nephron Extra, 2012, 2 (1): 159-168.
25 Rosenfeld G, Bressler B.Mycobacteriumaviumparatuberculosisand the etiology of Crohn’s disease: a review of the controversy from the clinician’s perspective[J]. Can J Gastroenterol, 2010, 24 (10): 619-624.
26 Fang FC. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies[J]. Nat Rev Microbiol, 2004, 2 (10): 820-832.
27 Yang X, Xu H, Hao Y, et al. Endoplasmic reticulum oxidoreductin 1α mediates hepatic endoplasmic reticulum stress in homocysteine-induced atherosclerosis[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46 (10): 902-910.
28 Shelley-Fraser G, Borley NR, Warren BF, et al. The connective tissue changes of Crohn’s disease[J]. Histopathology, 2012, 60 (7): 1034-1044.
29 Abreu JG, Ketpura NI, Reversade B, et al. Connective-tissue growth factor (CTGF) modulates cell signalling by BMP and TGF-beta[J]. Nat Cell Biol, 2002, 4 (8): 599-604.
30 Munjal C, Tyagi N, Lominadze D, et al. Matrix metalloproteinase-9 in homocysteine-induced intestinal microvascular endothelial paracellular and transcellular permeability[J]. J Cell Biochem, 2012, 113 (4): 1159-1169.
31 李新, 罗鹏, 刘莉. DNA甲基化与结肠癌[J]. 国际消化病杂志, 2009, 29 (1): 29-32.
32 朱凡, 王毓明, 张勤英. 血浆同型半胱氨酸、血清叶酸及亚甲基四氢叶酸还原酶基因多态性与结、直肠癌发病关系的研究[J]. 东南大学学报(医学版), 2010, 29 (1): 88-92.
33 王崴, 杨龙, 张霁. 高同型半胱氨酸血症与TIA及脑梗死的相关性研究[J]. 中外健康文摘, 2011, 8 (9): 109-110.
34 Ferroni P, Palmirotta R, Martini F, et al. Determinants of homocysteine levels in colorectal and breast cancer patients[J]. Anticancer Res, 2009, 29 (10): 4131-4138.
35 Wu Y, Zhou BP. TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion[J]. Br J Cancer, 2010, 102 (4): 639-644.
36 Velayos F. Managing risks of neoplasia in inflammatory bowel disease[J]. Curr Gastroenterol Rep, 2012, 14 (2): 174-180.
37 Akbulut S, Altiparmak E, Topal F, et al. Increased levels of homocysteine in patients with ulcerative colitis[J]. World J Gastroenterol, 2010, 16 (19): 2411-2416.
(2016-08-28收稿;2016-09-27修回)
Correlation of Homocysteine with Inflammatory Bowel Disease and Colitis-associated Colon Cancer
SHENJiaxin,WANGChengdang.
DepartmentofGastroenterology,DigestiveEndoscopyCenter,InstituteofDigestiveDiseases,theFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou(350005)
Correspondence to: WANG Chengdang, Email: wangcdhl@sina.com
Inflammatory bowel disease (IBD) is a group of chronic, non-specific inflammatory intestinal diseases. Patients with IBD predispose to the development of colitis-associated colon cancer (CACC). Homocysteine is an important intermediate metabolite in methionine cycle, increased level of homocysteine is closely correlated with the development and progression of IBD and CACC. This paper reviewed the advances in study on correlation of homocysteine with IBD and CACC.
Homocysteine; Inflammatory Bowel Disease; Colitis, Ulcerative; Crohn Disease; Colonic Neoplasms
10.3969/j.issn.1008-7125.2017.06.010
*本文通信作者,Email: wangcdhl@sina.com

