TRIM55在结直肠癌中的表达及其临床意义*
梁 倩 房静远 张 洁 洪 洁#
上海交通大学医学院附属仁济医院消化科 上海市消化疾病研究所1(200001) 上海交通大学医学院附属仁济医院检验科2
TRIM55在结直肠癌中的表达及其临床意义*
梁 倩1房静远1张 洁2#洪 洁1#
上海交通大学医学院附属仁济医院消化科 上海市消化疾病研究所1(200001) 上海交通大学医学院附属仁济医院检验科2
背景:TRIM55为TRIM蛋白家族成员,大部分TRIM蛋白含环指结构域,可发挥E3泛素连接酶的作用,与癌症的发生、发展密切相关。目的:探讨TRIM55在结直肠癌中的表达及其临床意义,探究可能的作用机制。方法:选取2014年10月—2015年12月上海交通大学医学院附属仁济医院的70例结直肠癌组织及其相应癌旁组织,以实时PCR法检测TRIM55表达。将TRIM55小干扰RNA(siRNA)转染人结直肠癌细胞株HCT116,以CCK-8法检测细胞增殖,蛋白质印迹法检测TRIM55、SOCS1蛋白表达。结果:49例结直肠癌组织中TRIM55表达高于癌旁组织,且TRIM55高表达与肿瘤分化程度(P=0.032)、AJCC分期(P=0.001)和淋巴结转移相关(P=0.001),而与患者的性别、年龄、肿瘤大小、浸润深度、远处转移和脉管侵犯无关(P>0.05)。TRIM55 siRNA可有效下调HCT116细胞中TRIM55 mRNA和蛋白表达(P<0.01),降低细胞增殖能力(P<0.01),并上调SOCS1蛋白表达(P<0.01)。结论:E3泛素连接酶TRIM55可能通过影响SOCS1的表达促进结直肠癌细胞增殖,进而促进结直肠癌的疾病进程,提示检测TRIM55表达有望为结直肠癌的诊断和治疗提供新思路。
泛素化; TRIM55; 结直肠肿瘤; RNA, 小分子干扰; 细胞增殖; 细胞因子信号转导蛋白抑制因子
结直肠癌是最常见的恶性肿瘤之一。在美国,虽然结直肠癌发病率正逐年降低,但其导致的死亡率仍不可忽视[1]。结直肠癌的发生、进展是一个非常复杂的过程,通常是在多种致肿瘤因素的共同作用下逐级转化发生[2]。其中炎-癌途径是结直肠癌发生和转归中的重要途径之一[3]。有报道[4]表明,细胞因子信号转导抑制因子1(suppressor of cytokine signaling 1, SOCS1)作为一种炎症抑制因子,其缺失和失活与结直肠癌(尤其是炎症性肠病相关结直肠癌)的发生密切相关。TRIM55为TRIM蛋白家族成员,TRIM家族因多含有环指结构域(RING-finger domain)而发挥E3泛素连接酶的作用,可对多种蛋白进行特异性识别并降解从而影响其表达水平[5],包括SOCS1[6]。
本研究通过检测结直肠癌患者中TRIM55表达,并以TRIM小干扰RNA(siRNA)转染人结直肠癌细胞株HCT116,检测细胞增殖情况以及SOCS1蛋白表达,旨在探讨TRIM55在结直肠癌中的可能作用机制,从而为结直肠癌的诊断和治疗提供一定的理论依据。
材料与方法
一、研究对象
选取2014年10月—2015年12月上海交通大学医学院附属仁济医院的70例结直肠癌患者,诊断经术后病理检查证实。同时选取距病变边缘5 cm以上的癌旁组织作为对照。其中男37例,女33例;年龄28~82岁,平均66岁;肿瘤大小<30 cm3者50例,≥30 cm3者20例;中-高分化18例,低分化52例;根据美国癌症联合委员会(AJCC)分期,Ⅰ+Ⅱ期32例,Ⅲ+Ⅳ期38例;浸润局限于黏膜层或肌层者14例,浆膜或全层者56例;有淋巴结转移38例,无淋巴结转移32例;有远处转移13例,无远处转移57例;侵犯脉管8例,无脉管侵犯62例。入选者住院前未接受过手术、放化疗或免疫抑制剂治疗。入选者均取得知情同意,本研究方案通过上海交通大学医学院附属仁济医院伦理委员会的审批。
二、主要仪器和材料
实时荧光定量PCR仪(ABI公司);RNAiso Plus总RNA提取试剂、逆转录试剂盒和Real-Time PCR试剂盒(日本TaKaRa公司);内参GAPDH引物和TRIM55特异性引物由生工生物工程(上海)股份有限公司合成;人结直肠癌细胞株HCT116(ATCC);RPMI 1640培养基(美国Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);siRNA(上海吉玛制药技术有限公司),序列见表1;DharmaFECT 1转染试剂(GE Healthcare);CCK-8试剂盒(日本株式会社同仁化学研究所);RIPA蛋白裂解液(上海碧云天生物技术有限公司);小鼠TRIM55单克隆抗体(英国Abcam公司)、小鼠SOCS1单克隆抗体(美国Millipore公司)、HRP标记的内参GAPDH抗体、HRP标记的山羊抗小鼠IgG抗体(康成生物工程有限公司);ECL发光试剂盒(美国ThermoFisher Scientific)。
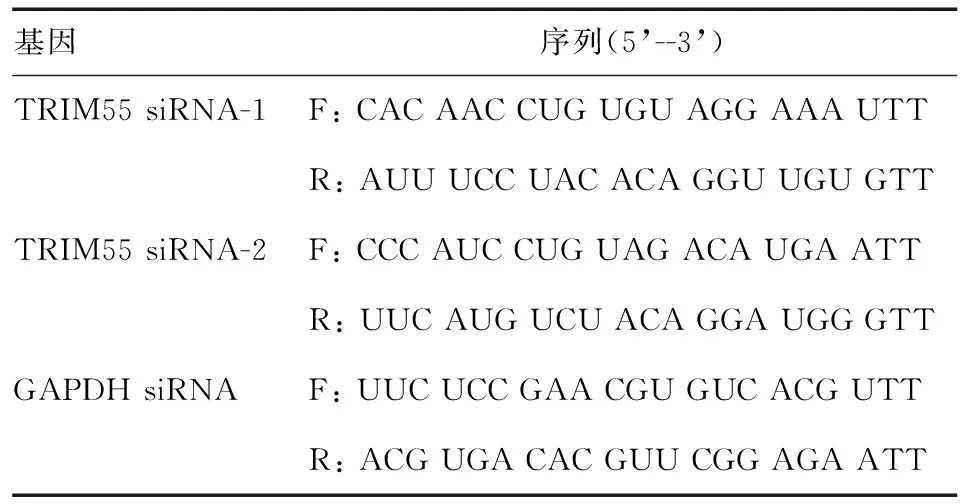
表1 各基因siRNA序列
三、研究方法
1. 实时PCR法:结肠组织充分研磨后裂解细胞,提取RNA,逆转录合成cDNA。实时PCR步骤参照试剂盒说明书进行。以2-△△Ct法计算样本目的基因mRNA相对表达量。每组设立3个复孔,实验重复3次。
2. 细胞培养和转染:将HCT116细胞培养于含5%胎牛血清的RPMI 1640完全培养基中,培养至对数生长期后,以2.0×105个/孔的密度接种于6孔板。待细胞贴壁后进行转染。转染的操作步骤参照DharmaFECT 1转染试剂说明书,以无血清的培养基清洗细胞后每孔加入无血清培养基1 mL,然后加入5 μL siRNA。于细胞培养箱中培养6 h后更换含5%胎牛血清的完全RPMI 1640培养基继续孵育24~72 h。
3. 细胞增殖实验:HCT116细胞按2 500个/孔的密度接种于96孔板,每组处理设6个复孔。细胞贴壁后行siRNA转染。加入CCK-8试剂(以无血清培养基按照1∶10的体积比稀释),分别于培养 24 h、48 h、72 h、96 h、120 h后检测细胞增殖情况。使用酶标仪读取450 nm波长处的吸光度(A)值。实验重复3次。
4. 蛋白质印迹法:将HCT116细胞转染siRNA 48~72 h后,收集细胞,以预冷的PBS洗涤,加入蛋白裂解液裂解10 min,4 ℃ 6 250×g离心10 min,取上清,BCA法定量蛋白浓度。取50 μg总蛋白上样,行10% SDS-PAGE电泳分离后转移至PVDF膜,经5%脱脂奶粉封闭2 h。分别加入TRIM55、SOCS1、GAPDH一抗(工作浓度分别为1∶1 000、1∶500、1∶3 000)4 ℃孵育过夜。TBST洗膜5次×5 min,加入二抗(工作浓度1∶3 000)常温孵育1 h。ECL发光法成像并进行灰度扫描。实验重复3次。
四、统计学分析
结 果
一、结直肠癌患者中TRIM55表达及其与临床病理特征的关系
在70例结直肠癌患者中,49例TRIM55表达高于癌旁组织,平均相对表达量为2.26±1.22;21例TRIM55表达低于癌旁组织,平均相对表达量为0.53±0.26。TRIM55高表达与肿瘤分化程度(P=0.032)、AJCC分期(P=0.001)和局部淋巴结转移(P=0.001)相关,而与患者的性别、年龄、肿瘤大小、浸润深度、远处转移和脉管侵犯等无关(P>0.05)(表2)。
二、HCT116细胞中TRIM55 mRNA和蛋白表达
实时PCR和蛋白质印迹法结果显示,分别转染两条TRIM55 siRNA的HCT116细胞中,TRIM55 mRNA表达均显著降低(抑制率分别为78.4%和87.2%,P<0.001)(图1A),蛋白表达亦显著降低(抑制率分别为46.2%和60.5%,P<0.01)(图1B),提示siRNA可有效下调HCT116细胞中TRIM55 mRNA和蛋白表达。
三、HCT116细胞增殖情况
与对照组相比,两组TRIM55 siRNA转染组的细胞增殖均受到明显抑制,差异有统计学意义(P<0.01)(图2)。
四、TRIM55表达降低对HCT116细胞中SOCS1表达的影响
蛋白质印迹法结果显示,转染72 h后,两组TRIM55 siRNA转染组细胞中SOCS1蛋白表达较对照组显著升高(P<0.01)(图3)。说明TRIM55对SOCS1蛋白表达具有一定的调控作用。
表2 结直肠癌患者中TRIM55表达与临床病理特征的关系(n)
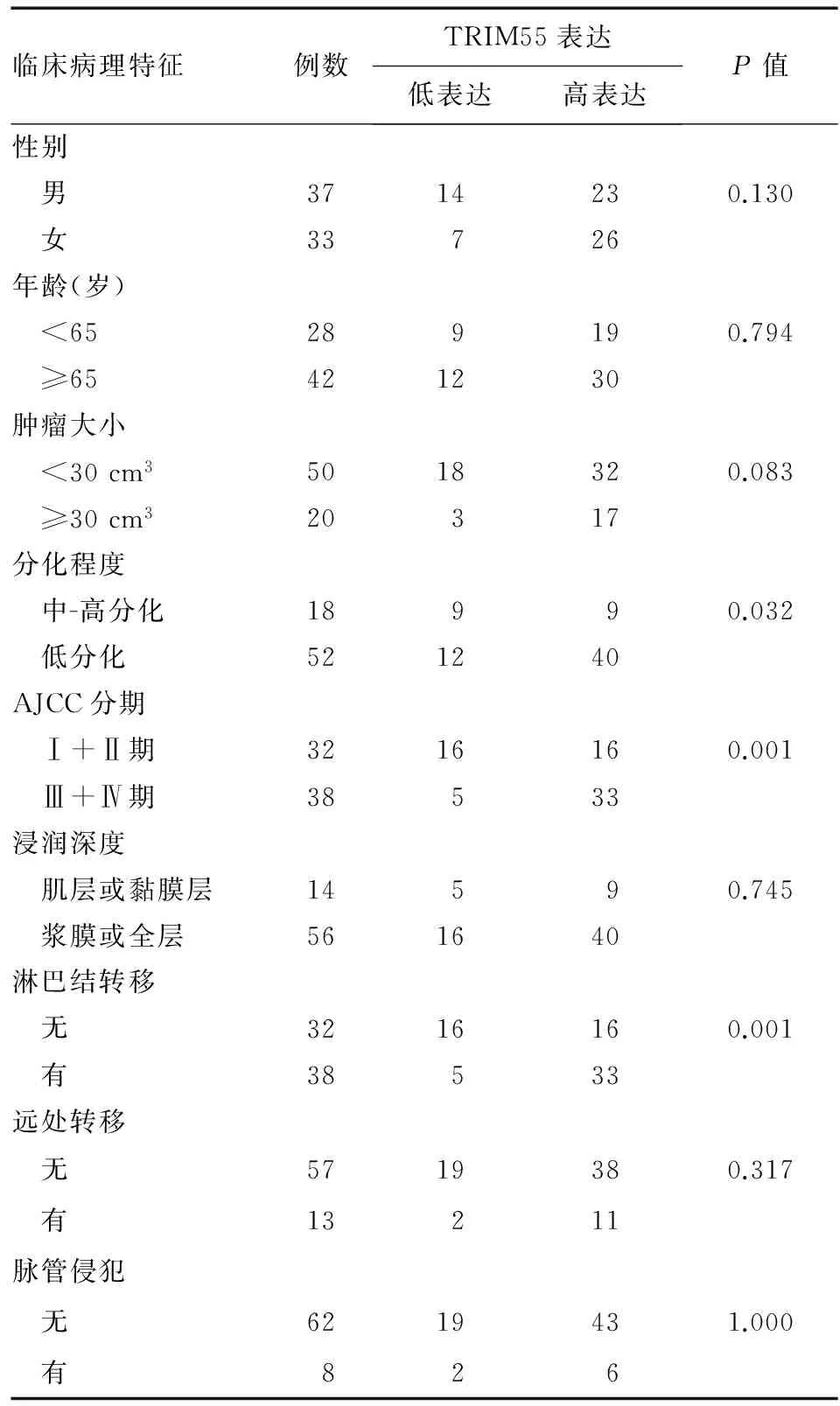
临床病理特征例数TRIM55表达低表达高表达P值性别 男3714230.130 女33726年龄(岁) <65289190.794 ≥65421230肿瘤大小 <30cm35018320.083 ≥30cm320317分化程度 中-高分化18990.032 低分化521240AJCC分期 Ⅰ+Ⅱ期3216160.001 Ⅲ+Ⅳ期38533浸润深度 肌层或黏膜层14590.745 浆膜或全层561640淋巴结转移 无3216160.001 有38533远处转移 无5719380.317 有13211脉管侵犯 无6219431.000 有826
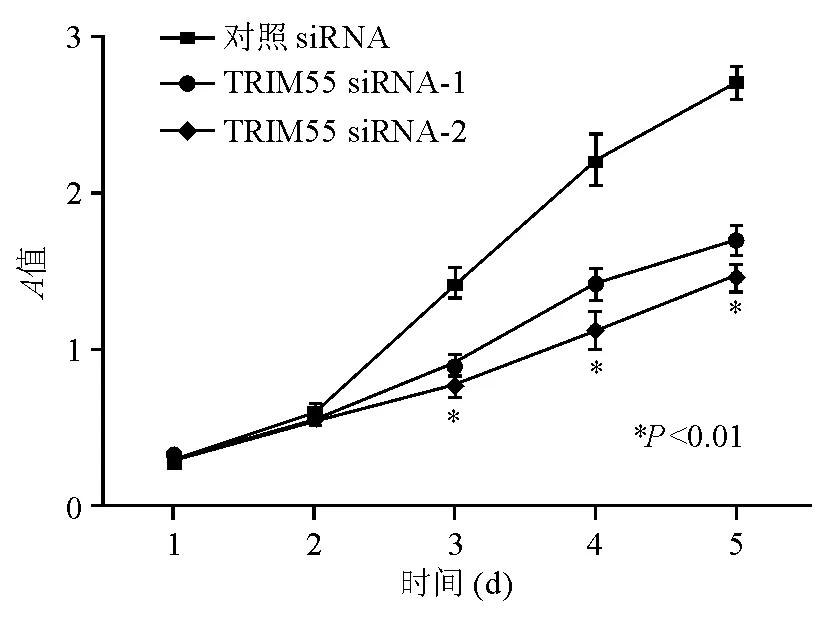
图2 转染siRNA后HCT116细胞增殖情况(CCK-8法)

1 Da=0.992 1 u
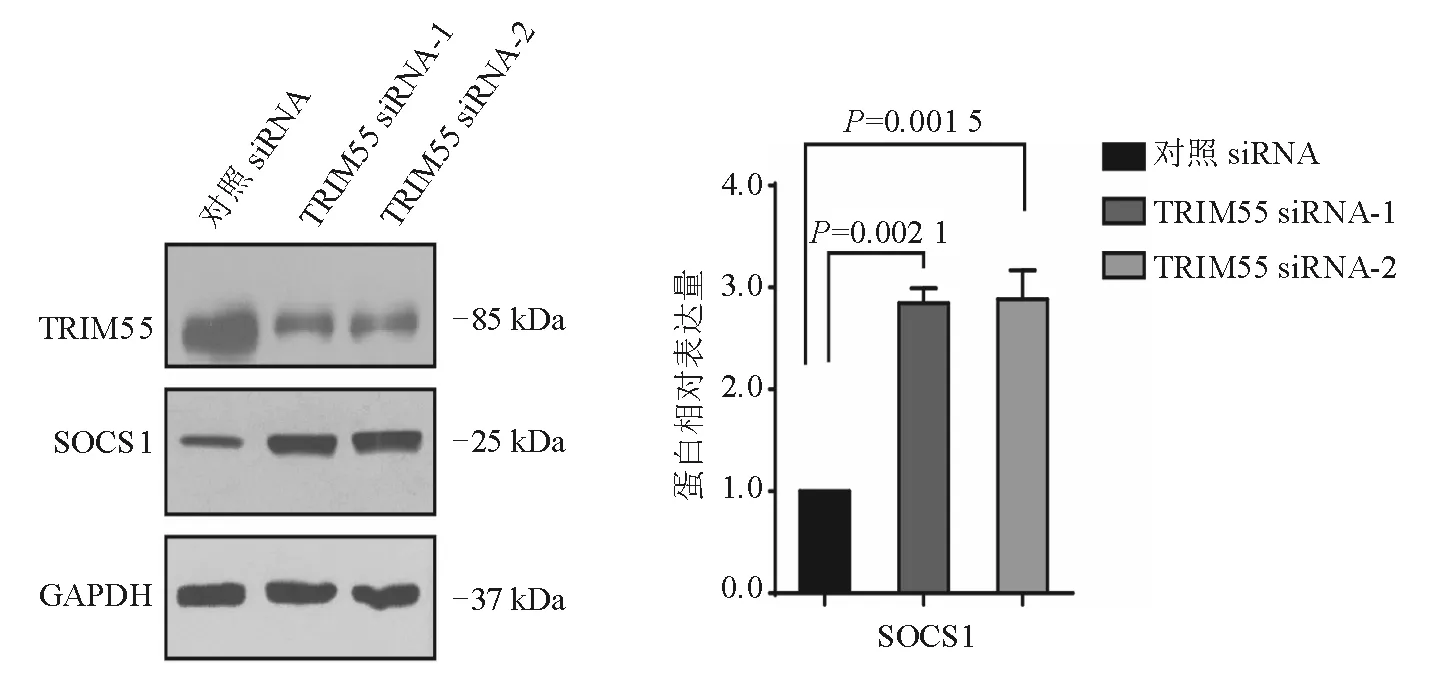
图3 转染siRNA后HCT116细胞中SOCS1蛋白表达(蛋白质印迹法)
讨 论
既往诸多研究发现,泛素化修饰是蛋白质翻译后修饰的一个常见方式,在蛋白质降解和信号通路调控中发挥重要作用[7]。泛素化作用由一系列级联反应完成,其中包括三种重要的酶,分别为E1泛素激活酶、E2泛素结合酶和E3泛素连接酶。E1泛素激活酶可利用ATP供能黏附于泛素分子的半胱氨酸残基上,随后将泛素分子转移至E2泛素结合酶。E3泛素连接酶的作用最为关键,一方面可特异性识别靶蛋白,另一方面定位于E2泛素结合酶以转移泛素分子,从而形成泛素与底物蛋白的复合物被蛋白酶体水解[8]。TRIM蛋白家族因多含有环指结构域而发挥E3泛素连接酶的作用,可识别并降解多种蛋白,从而引起其表达水平以及相关信号通路的改变[5]。由于降解的靶蛋白不同,TRIM蛋白既有促癌亦有抑癌的作用。如Smad泛素化调节因子2(Smurf2)是一种E3泛素连接酶,有研究发现Smurf2可依赖其泛素连接酶的活性参与细胞增殖、凋亡、迁移等过程,从而与肿瘤的发生、发展密切相关[9];TRIM59可使野生型p53泛素化并降解,但对突变型p53无此作用,阻碍了p53作为抑癌基因的功能,从而促进胃癌的发生、发展[10];在非小细胞肺癌中,TRIM71可通过对RNA结合蛋白Lin28B的泛素化作用,使其表达减少,抑制下游let-7-HMGA2信号的激活,从而发挥其抑癌基因的作用[11];TRIM3是一种定位于11号染色体的抑癌基因,通过降解p21削弱细胞周期蛋白D1与细胞周期蛋白依赖性激酶4(CDK4)的聚积,进而抑制肿瘤生长,其表达降低可引起血小板源性生长因子诱导的胶质瘤发病率的增加[12]。
TRIM蛋白调控肿瘤发生、发展的作用途径各不相同,包括调节自噬[13]、组蛋白[14]和免疫应答反应[15]等。Versteeg等[15]在人类已知的75种TRIM蛋白中进行cDNA克隆和系统分析,证实约一半的TRIM蛋白可从固有免疫信号通路的多个水平进行调控,从而影响固有免疫反应。SOCS1可负性调控细胞因子引起的信号通路激活,发挥潜在的炎症抑制因子的作用,并减缓肿瘤细胞的生长,因此在多种肿瘤包括结直肠癌中起抑癌的作用[4]。TRIM蛋白与SOCS1之间的相互作用降低了SOCS1的稳定性和表达水平,可阻断SOCS1的抑癌功能[6]。
本研究检测了70例结直肠癌患者中TRIM55 mRNA表达发现,49例TRIM55表达高于癌旁组织,且TRIM55高表达与肿瘤分化程度、AJCC分期和淋巴结转移密切相关(P<0.05)。提示TRIM55表达可能与结直肠癌患者的恶性程度以及病变累及范围有关。本研究进一步将TRIM55 siRNA转染人低分化结直肠癌细胞株HCT116,结果显示TRIM55 mRNA和蛋白表达均明显下调,HCT116细胞增殖受到明显抑制,而SOCS1蛋白表达明显升高。这一结果可能是由于siRNA削弱了TRIM55对SOCS1的泛素化降解作用。而在结直肠癌中,TRIM55高表达使SOCS1的降解异常增加,SOCS1水平降低,使其对肿瘤细胞增殖的抑制作用受到破坏,导致结直肠癌细胞的生物学特性发生了变化,进而加速疾病进程。
综上所述,结直肠癌患者的TRIM55表达水平升高,且与肿瘤分化程度、AJCC分期和淋巴结转移相关,可能在促进结直肠癌的发生、发展中起一定作用,其发挥作用的潜在机制可能是降解SOCS1。但TRIM55是否通过泛素化修饰的方式在结直肠癌的发生、发展中发挥作用迄今仍未见相关报道,有待进一步研究证实。本研究缺乏体内实验结果,后续可通过完善这一部分内容,使TRIM55有望成为诊断和治疗结直肠癌的新靶点。
1 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65 (1): 5-29.
2 Markowitz SD, Bertagnolli MM. Molecular origins of cancer: Molecular basis of colorectal cancer[J]. N Engl J Med, 2009, 361 (25): 2449-2460.
3 Zhao J, Bulek K, Gulen MF, et al. Human colon tumors express a dominant-negative form of SIGIRR that promotes inflammation and colitis-associated colon cancer in mice[J]. Gastroenterology, 2015, 149 (7): 1860-1871. e8.
4 Bakirtzi K, Hatziapostolou M, Karagiannides I, et al. Neurotensin signaling activates microRNAs-21 and -155 and Akt, promotes tumor growth in mice, and is increased in human colon tumors[J]. Gastroenterology, 2011, 141 (5): 1749-1761.e1.
5 Hirano A, Fu YH, Ptácˇ ek LJ. The intricate dance of post-translational modifications in the rhythm of life[J]. Nat Struct Mol Biol, 2016, 23 (12): 1053-1060.
6 Toniato E, Chen XP, Losman J, et al. TRIM8/GERP RING finger protein interacts with SOCS-1[J]. J Biol Chem, 2002, 277 (40): 37315-37322.
7 Foot N, Henshall T, Kumar S. Ubiquitination and the regulation of membrane proteins[J]. Physiol Rev, 2017, 97 (1): 253-281.
8 Clague MJ, Heride C, Urbé S. The demographics of the ubiquitin system[J]. Trends Cell Biol, 2015, 25 (7): 417-426.
9 郭晓玲, 曹勤, 蔡瑜, 等. Smurf2与肿瘤关系的研究进展[J]. 胃肠病学, 2014, 19 (1): 54-56.
10 Zhou Z, Ji Z, Wang Y, et al. TRIM59 is up-regulated in gastric tumors, promoting ubiquitination and degradation of p53[J]. Gastroenterology, 2014, 147 (5): 1043-1054.
11 Yin J, Kim TH, Park N, et al. TRIM71 suppresses tumorigenesis via modulation of Lin28B-let-7-HMGA2 signaling[J]. Oncotarget, 2016, 7 (48): 79854-79868.
12 Liu Y, Raheja R, Yeh N, et al. TRIM3, a tumor suppressor linked to regulation of p21(Waf1/Cip1.) [J]. Oncogene, 2014, 33 (3): 308-315.
13 Antonioli M, Di Rienzo M, Piacentini M, et al. Emerging mechanisms in initiating and terminating autophagy[J]. Trends Biochem Sci, 2017, 42 (1): 28-41.
14 Patel LR, Barton MC. TRIM-ing ligand dependence in castration-resistant prostate cancer[J]. Cancer Cell, 2016, 29 (6): 776-778.
15 Versteeg GA, Rajsbaum R, Sánchez-Aparicio MT, et al. The E3-ligase TRIM family of proteins regulates signaling pathways triggered by innate immune pattern-recognition receptors[J]. Immunity, 2013, 38 (2): 384-398.
(2016-12-14收稿;2017-02-20修回)
Expression and Clinical Significance of TRIM55 in Colorectal Cancer
LIANGQian1,FANGJingyuan1,ZHANGJie2,HONGJie1.
1DivisionofGastroenterologyandHepatology,RenJiHospital,ShanghaiJiaoTongUniversitySchoolofMedicine;ShanghaiInstituteofDigestiveDisease,Shanghai(200001);2DepartmentofClinicalLaboratory,RenJiHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai
Co-correspondence to: ZHANG Jie, Email: jane_zhanlin@sina.cn; HONG Jie, Email: jiehong97@shsmu.edu.cn
Background: TRIM55 is a member of TRIM family. Most TRIM proteins, which can be defined as E3 ubiquitin ligase because of the RING-finger domain, are closely related with the initiation and progression of cancer. Aims: To study the expression and clinical significance of TRIM55 in colorectal cancer, and explore the potential mechanism of TRIM55 in colorectal cancer. Methods: Seventy colorectal cancer tissues and corresponding paracancerous tissues taken from colorectal cancer patients from October 2014 to December 2015 at Shanghai Ren Ji Hospital were enrolled. Real-time PCR was performed to examine the expression of TRIM55. Human colorectal cancer cell line HCT116 was transfected with TRIM55 small interfering RNA (siRNA), cell proliferation was measured by CCK-8 assay, Western blotting was implemented to determine the protein expressions of TRIM55 and SOCS1. Results: The expression of TRIM55 was significantly increased in 49 colorectal cancer tissues than in corresponding paracancerous tissues. Increased expression of TRIM55 was closely correlated with tumor differentiation (P=0.032), AJCC staging (P=0.001) and lymph node metastasis (P=0.001), but not related to gender, age, tumor size, invasion depth, distant metastasis and vascular invasion (P>0.05). After transfection with TRIM55 siRNA, mRNA and protein expressions of TRIM55 were significantly decreased (P<0.01), proliferation of HCT116 cells was significantly decreased (P<0.01), and protein expression of SOCS1 was significantly increased (P<0.01). Conclusions: E3 ubiquitin ligase TRIM55 may promote the proliferation of colorectal cancer cells via influencing the expression of SOCS1, thus promoting the progression of colorectal cancer. This indicates that detection of TRIM55 expression may provide a new approach for diagnosis and therapy of colorectal cancer.
Ubiquitination; TRIM55; Colorectal Neoplasms; RNA, Small Interfering; Cell Proliferation; Suppressor of Cytokine Signaling Proteins
10.3969/j.issn.1008-7125.2017.06.005
*本课题由临床专职科研队伍(20152512)资助
#本文共同通信作者,张洁,Email: jane_zhanlin@sina.cn;洪洁,Email: jiehong97@shsmu.edu.cn

