自噬诱导剂pp242对肿瘤坏死因子-α所致肠屏障损伤的影响*
张 琮 王嘉正 沈玉洁 周明霞 陈颖伟,2#
上海交通大学医学院附属新华医院消化内科1(200092) 上海市小儿消化与营养重点实验室2
自噬诱导剂pp242对肿瘤坏死因子-α所致肠屏障损伤的影响*
张 琮1王嘉正1沈玉洁1周明霞1陈颖伟1,2#
上海交通大学医学院附属新华医院消化内科1(200092) 上海市小儿消化与营养重点实验室2
背景:肠屏障损伤和自噬异常均在炎症性肠病的发病中起重要作用,但自噬是否参与肠屏障损伤的发生、发展目前尚无报道。目的:探讨自噬诱导剂pp242对肿瘤坏死因子-α(TNF-α)所致肠屏障损伤的影响。方法:在Transwell小室中培养Caco-2细胞制备单层肠上皮屏障模型,并将其随机分为对照组(不给予干预)、TNF-α组(10 ng/mL TNF-α)、pp242组(1 μmol/L pp242)和TNF-α+pp242组(10 ng/mL TNF-α+1 μmol/L pp242)。以跨上皮细胞电阻(TEER)和FITC标记葡聚糖通透性评估肠上皮屏障功能,蛋白质印迹法检测自噬相关蛋白LC3B-Ⅱ和p62的表达情况。结果:与对照组相比,TNF-α组TEER显著降低(P<0.05),FITC标记葡聚糖通透性显著升高(P<0.05),LC3B-Ⅱ和p62蛋白表达均显著上调(P<0.05)。与TNF-α组相比,TNF-α+pp242组TEER显著升高(P<0.05),LC3B-Ⅱ蛋白表达显著上调(P<0.05),p62蛋白表达显著下调(P<0.05)。结论:自噬诱导剂pp242通过激活自噬流缓解TNF-α所致的肠上皮屏障损伤。
自噬; 肠黏膜屏障; 上皮细胞; 肿瘤坏死因子α; 炎症性肠病
炎症性肠病(inflammatory bowel disease, IBD)是一组病因未明的慢性肠道炎症性疾病,主要包括溃疡性结肠炎(UC)和克罗恩病(CD),近年来其发病率逐渐增高[1]。随着对IBD发病机制的深入探索,大量研究发现肠屏障功能受损以及自噬异常可能在其发病中起重要作用[2-3]。自噬是真核细胞受到内外界因素(饥饿、压力、致病菌等)刺激后通过溶酶体途径对胞内受损蛋白、衰老细胞器等物质降解的过程[4],其状态随环境的改变而发生改变,但对于IBD肠道炎症中自噬变化是否参与肠屏障损伤的发生、发展,目前尚未见报道。本研究通过将肿瘤坏死因子-α(TNF-α)作用于肠上皮屏障模型体外模拟IBD肠道炎症环境,并以自噬诱导剂pp242进行干预,旨在探讨自噬改变与IBD肠屏障损伤之间的关系。
材料与方法
一、细胞株和主要试剂
人结直肠腺癌细胞Caco-2细胞株购自中国科学院细胞库;胎牛血清、非必需氨基酸、青霉素/链霉素购自Gibco公司;FITC标记葡聚糖、兔抗LC3B多克隆抗体购自Sigma公司;兔抗p62多克隆抗体购自Santa Cruz公司;HRP标记的山羊抗兔IgG购自上海翊圣生物科技有限公司;Millicell电阻仪和ECL发光液购自Merck Millipore公司;Transwell小室(孔径为0.4 μm,有效膜面积为0.33 cm2)购自Corning公司。
二、研究方法
1. 肠上皮屏障模型的建立:将状态良好的Caco-2细胞以2×105/mL的密度接种于Transwell小室中,使用含10%胎牛血清、10 g/mL非必需氨基酸以及1%青霉素/链霉素的DMEM培养液,在37 ℃、5% CO2的条件下培养。隔日换液,培养7 d后监测跨上皮细胞电阻(transepithelial electrical resistance, TEER),电阻稳定后行下一步实验。
2. 细胞分组:将已构建好的肠上皮屏障细胞模型随机分为4组:对照组不给予干预;TNF-α组给予10 ng/mL TNF-α培养48 h;pp242组给予1 μmol/L pp242培养24 h;TNF-α+pp242组给予10 ng/mL TNF-α预处理24 h后再加入1 μmol/L pp242处理24 h。
3. TEER的测定:药物处理细胞模型后除去小室内的培养液,Hank平衡盐溶液(HBSS)冲洗细胞2遍,吸净后在上下层小室中加入HBSS并使内外液面相齐平,待电阻调零后,将电阻仪长短电极分别插入下层小室和上层小室中,读数稳定后取同一组3个小室的平均值。由于空白Transwell膜具有一定的电阻值,故标准TEER等于实际测得值减去空白对照值后再乘以Transwell小室的有效膜面积,电阻值单位为Ω·cm2。
4. FITC标记葡聚糖通透性测定:HBSS冲洗细胞后吸净残液,于上层小室加入0.1 mL含1 mg/mL FITC标记葡聚糖的HBSS,下层小室加入0.6 mL空白HBSS,37 ℃孵育2 h后收集下层小室液体,上荧光酶标仪测定荧光强度(激发波长为480 nm,发射波长为520 nm),结果以各组通透量与对照组通透量的百分比表示。
5. 蛋白质印迹法检测自噬流相关蛋白表达:将处理后的细胞样本置于含蛋白酶抑制剂的RIPA裂解液中,冰上裂解15 min,离心后所取的上清液即为总蛋白。取等量的蛋白样品进行SDS-PAGE电泳,随后将蛋白转移至PVDF膜上,室温封闭2 h,加入兔抗LC3B或p62一抗(工作浓度1∶1 000)4 ℃孵育过夜。次日用PBST洗膜3次,加入二抗(工作浓度1∶5 000)室温孵育1 h,PBST洗膜3次。ECL发光液处理后,将膜放入凝胶成像仪中进行曝光采图,应用NIH的Image J 1.49v软件对蛋白条带进行定量分析。
三、统计学分析
结 果
一、各组肠上皮屏障模型TEER的改变
4组间TEER相比差异有统计学意义(F=239.85,P<0.001),以pp242组TEER最高。进一步两两比较发现,与对照组相比,TNF-α组(t=16.19,P<0.05)、TNF-α+pp242组(t=10.39,P<0.05)TEER显著降低,pp242组显著升高(t=8.47,P<0.05),且TNF-α+pp242组TEER又显著高于TNF-α组(t=5.80,P<0.05)(表1)。
二、各组肠上皮屏障模型FITC标记葡聚糖通透性的改变
4组间FITC标记葡聚糖通透性相比差异有统计学意义(F=319.42,P<0.001),以TNF-α组最高。进一步两两比较发现,与对照组相比,TNF-α组、TNF-α+pp242组FITC标记葡聚糖通透性显著升高(t=23.40,P<0.05;t=22.21,P<0.05),而对照组与pp242组(t=1.95,P>0.05)、TNF-α组与TNF-α+pp242组(t=1.18,P>0.05)之间差异均无统计学意义(表1)。
三、自噬相关蛋白LC3B-Ⅱ和p62的改变
4组间LC3B-Ⅱ蛋白表达差异有统计学意义(F=40.89,P<0.001),以TNF-α+pp242组最高。4组间p62蛋白表达差异有统计学意义(F=147.14,P<0.001),以TNF-α组最高。进一步两两比较发现,与对照组相比,TNF-α组(t=6.62,P<0.05)、pp242组(t=8.21,P<0.05)、TNF-α+pp242组(t=10.53,P<0.05)LC3B-Ⅱ蛋白表达均显著升高,且TNF-α+pp242组又显著高于TNF-α组(t=3.91,P<0.05)。与对照组相比,TNF-α组p62蛋白显著升高(t=7.61,P<0.05),pp242组(t=11.64,P<0.05)、TNF-α+pp242组(t=7.95,P<0.05)显著降低,且TNF-α+pp242组又显著低于TNF-α组(t=15.56,P<0.05)(表1、图1)。
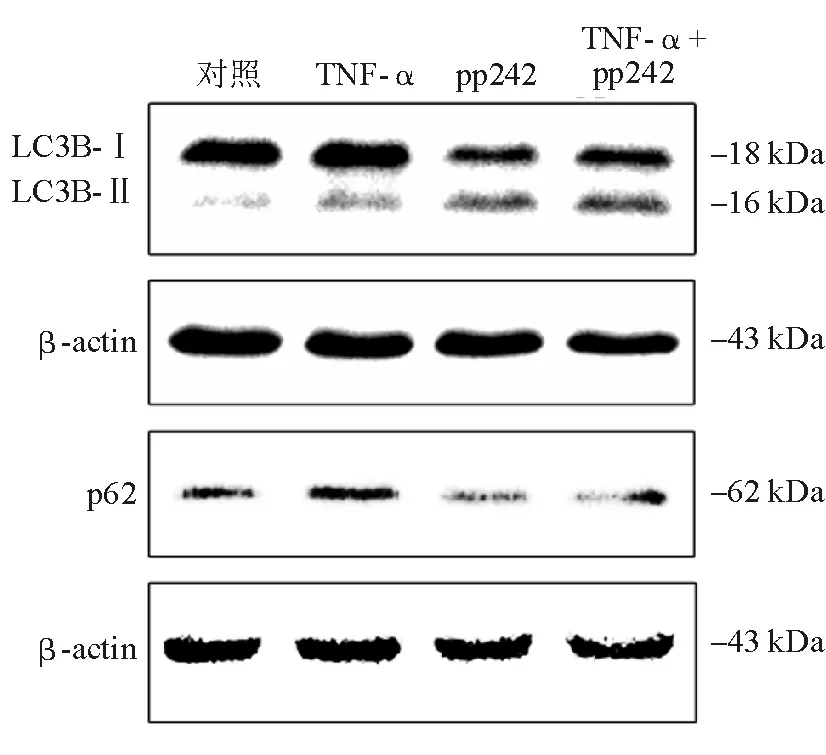
1 Da=0.992 1 u
讨 论
IBD在临床上主要表现为反复发作的腹痛、腹泻和黏液血便,并可出现肛瘘、肠梗阻、肠穿孔等严重并发症,给患者带来了巨大的心理和经济负担。迄今IBD的发病机制尚未完全明确,通常认为其发病与遗传易感人群受到外界环境刺激后出现持续异常的免疫反应相关[5]。大量临床实践表明,氨基水杨酸类、糖皮质激素、生物制剂等药物对IBD病情的缓解有一定作用,但均不能完全治愈慢性炎症[6]。因此,完善IBD的发病机制,积极寻找能干预和逆转IBD进程的靶点具有重要的临床意义。
越来越多证据表明,肠上皮屏障受损是IBD发生、发展中的重要环节[7-8]。肠上皮屏障主要包括机械屏障、生物屏障、化学屏障和免疫屏障,在维持肠道稳态中起重要作用。IBD肠屏障功能受损导致肠上皮通透性增加,使抗原物质进入黏膜固有层引起免疫反应,免疫反应产生的大量致炎因子反过来作用于肠上皮,进一步增加肠道通透性,导致恶性循环,引起持续过度的免疫反应[9]。因此,探索阻断肠屏障损伤的途径,恢复正常的肠上皮功能,可能为IBD提供新的治疗策略。
自噬是维持细胞稳态的重要代谢过程。细胞受到内外界因素的刺激后,内质网或高尔基体脱落的双层膜包裹胞内变性蛋白和衰老细胞器等物质形成自噬小体,自噬小体与溶酶体融合后形成自噬溶酶体降解包裹的内容物,降解后形成的小分子物质被细胞重新利用,完成细胞的新陈代谢以及细胞器再生[4]。近十年的全基因组关联分析(GWAS)研究[10-11]结果证实,IBD患者的多个自噬相关基因(如IRGM、ATG16L1等)发生了多态性改变。进一步的自噬基因功能研究表明,自噬在肠道胞内菌的清除过程中起关键作用;自噬缺陷会导致持续性胞内菌感染,引起Paneth细胞形态学异常和分泌功能的改变,诱发持续性肠道炎症[12-13]。Saito等[14]发现,TNF-α与自噬抑制剂可协同作用于肠上皮细胞,使细胞黏附能力下降,损伤上皮屏障功能,提示肠上皮屏障功能可能受自噬的调控。
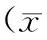
表1 各组肠上皮屏障TEER、FITC标记葡聚糖通透性和自噬相关蛋白表达的变化±s)
*与对照组比较,P<0.05;#与TNF-α组比较,P<0.05
本研究将TNF-α作用于肠上皮屏障体外模型以模拟IBD肠屏障损伤,并使用自噬诱导剂pp242进行干预,以TEER和FITC标记葡聚糖通透性分别作为评估肠上皮屏障完整性和肠上皮对大分子通透性的指标,结果显示pp242可显著缓解TNF-α所致的TEER降低,但不能缓解TNF-α所致的FITC标记葡聚糖通透性增加。初步说明pp242诱导自噬可部分改善TNF-α所致的肠上皮屏障损伤。进一步检测自噬相关蛋白表达的变化发现,TNF-α处理后LC3B-Ⅱ蛋白表达明显升高,说明自噬小体聚集增加。自噬是一个动态连续的过程,主要包括诱导、成核、延长、融合和降解5个步骤,当自噬的诱导过程增加或自噬的降解过程受抑制时,均可使细胞内自噬小体增加,即表现为LC3B-Ⅱ表达升高。p62为自噬成熟的标志蛋白,主要通过自噬过程降解。本研究发现,TNF-α作用后p62蛋白表达明显升高,说明上述LC3B-Ⅱ表达升高是自噬降解过程受抑制所致。而pp242处理后,LC3B-Ⅱ蛋白表达进一步上升,但p62蛋白表达显著降低。p62是一种主要通过自噬过程进行降解的蛋白,其表达降低提示pp242作用可使自噬降解能力恢复;pp242是一种自噬诱导剂,可促进LC3B-Ⅱ水平上升,故TNF-α+pp242组LC3B-Ⅱ水平进一步升高提示自噬流的恢复。结合上述肠屏障功能实验的结果,提示pp242可能通过解除TNF-α对自噬过程的抑制来促进自噬流的通畅从而改善肠屏障功能损伤。
综上所述,TNF-α诱导的肠上皮屏障损伤模型中存在自噬流的抑制,而自噬诱导剂pp242通过激活自噬并恢复自噬流的通畅,从而改善肠上皮屏障功能。本研究为寻找IBD可能的治疗靶点提供了新思路,但研究结论仍需进一步探讨证实。
1 Ng SC. Emerging leadership lecture: Inflammatory bowel disease in Asia: emergence of a "Western" disease[J]. J Gastroenterol Hepatol, 2015, 30 (3): 440-445.
2 Landy J, Ronde E, English N, et al. Tight junctions in inflammatory bowel diseases and inflammatory bowel disease associated colorectal cancer[J]. World J Gastroenterol, 2016, 22 (11): 3117-3126.
3 Hooper KM, Barlow PG, Stevens C, et al. Inflammatory bowel disease drugs: A focus on autophagy[J]. J Crohns Colitis, 2017, 11 (1): 118-127.
4 Zhong Z, Sanchez-Lopez E, Karin M. Autophagy, inflammation, and immunity: A troika governing cancer and its treatment[J]. Cell, 2016, 166 (2): 288-298.
5 Malik TA. Inflammatory bowel disease: Historical perspective, epidemiology, and risk factors[J]. Surg Clin North Am, 2015, 95 (6): 1105-1122, v.
6 Dulai PS, Sandborn WJ. Next-generation therapeutics for inflammatory bowel disease[J]. Curr Gastroenterol Rep, 2016, 18 (9): 51.
7 Alipour M, Zaidi D, Valcheva R, et al. Mucosal barrier depletion and loss of bacterial diversity are primary abnormalities in paediatric ulcerative colitis[J]. J Crohns Colitis, 2016, 10 (4): 462-471.
8 Vivinus-Nébot M, Frin-Mathy G, Bzioueche H, et al. Functional bowel symptoms in quiescent inflammatory bowel diseases: role of epithelial barrier disruption and low-grade inflammation[J]. Gut, 2014, 63 (5): 744-752.
9 Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases[J]. Intest Res, 2015, 13 (1): 11-18.
10 Lu XC, Tao Y, Wu C, et al. Association between variants of the autophagy related gene -- IRGM and susceptibility to Crohn’s disease and ulcerative colitis: a meta-analysis[J]. PLoS One, 2013, 8 (11): e80602.
11 Márquez A, Núez C, Martínez A, et al. Role of ATG16L1 Thr300Ala polymorphism in inflammatory bowel disease: a study in the Spanish population and a meta-analysis[J]. Inflamm Bowel Dis, 2009, 15 (11): 1697-1704.
12 Cadwell K, Patel KK, Maloney NS, et al. Virus-plus-susceptibility gene interaction determines Crohn’s disease gene Atg16L1 phenotypes in intestine[J]. Cell, 2010, 141 (7): 1135-1145.
13 Conway KL, Kuballa P, Song JH, et al. Atg16l1 is required for autophagy in intestinal epithelial cells and protection of mice from Salmonella infection[J]. Gastroenterology, 2013, 145 (6): 1347-1357.
14 Saito M, Katsuno T, Nakagawa T, et al. Intestinal epithelial cells with impaired autophagy lose their adhesive capacity in the presence of TNF-α[J]. Dig Dis Sci, 2012, 57 (8): 2022-2030.
(2016-12-16收稿;2017-04-05修回)
Effect of Autophagy Inducer pp242 on Intestinal Barrier Dysfunction Induced by Tumor Necrosis Factor-α
ZHANGCong1,WANGJiazheng1,SHENYujie1,ZHOUMingxia1,CHENYingwei1,2.
1DepartmentofGastroenterology,XinhuaHospitalAffiliatedtoShanghaiJiaotongUniversitySchoolofMedicine,Shanghai(200092);2ShanghaiKeyLaboratoryofPediatricGastroenterologyandNutrition,Shanghai
Correspondence to: CHEN Yingwei, Email: way_01chen@hotmail.com
Background: Intestinal barrier dysfunction and autophagy abnormality play important roles in the mechanism of inflammatory bowel disease, however, whether autophagy has effect on intestinal barrier dysfunction has not been reported. Aims: To explore the effect of autophagy inducer pp242 on intestinal barrier dysfunction induced by tumor necrosis factor-α (TNF-α). Methods: Model of intestinal epithelial monolayer barrier was established with Caco-2 cells in Transwell chambers, and then randomly divided into four groups: control group (without any intervention), TNF-α group (10 ng/mL TNF-α), pp242 group (1 μmol/L pp242), TNF-α+pp242 group (10 ng/mL TNF-α+1 μmol/L pp242). The intestinal barrier function was evaluated by transepithelial electrical resistance (TEER) and flux of FITC-dextran. The protein expressions of autophagy related protein LC3B-Ⅱ and p62 were detected by Western blotting. Results: Compared with control group, TEER was significantly decreased (P<0.05), flux of FITC-dextran, protein expressions of LC3B-Ⅱ and p62 were significantly increased in TNF-α group (P<0.05). Compared with TNF-α group, TEER was significantly increased (P<0.05), protein expression of LC3B-Ⅱ was significantly increased (P<0.05) while protein expression of p62 was significantly decreased in TNF-α+pp242 group (P<0.05). Conclusions: Autophagy inducer pp242 relieves TNF-α-induced intestinal epithelial barrier dysfunction via activating autophagy flux.
Autophagy; Intestinal Mucosal Barrier; Epithelial Cells; Tumor Necrosis Factor-alpha; Inflammatory Bowel Disease
10.3969/j.issn.1008-7125.2017.06.004
*本课题由国家自然科学基金(81370485)资助
#本文通信作者,Email: way_01chen@hotmail.com

