SEPT9基因甲基化在结直肠癌诊断中的研究进展
温 蕾 冯义朝 杜 夏
延安大学附属医院消化内科(716000)
SEPT9基因甲基化在结直肠癌诊断中的研究进展
温 蕾 冯义朝*杜 夏
延安大学附属医院消化内科(716000)
结直肠癌(CRC)是最常见的消化道恶性肿瘤之一,其预后差,病死率高。SEPT9基因是一种抑癌基因,在细胞分裂末期起重要作用,目前研究已发现SEPT9基因甲基化检测可用于CRC的早期诊断。本文就SEPT9基因甲基化在CRC筛查和诊断中的研究进展作一综述。
结直肠肿瘤; SEPT9基因; 甲基化; 诊断
结直肠癌(colorectal cancer, CRC)是我国最常见的消化道恶性肿瘤之一,其发病率和死亡率呈逐年增高的趋势[1]。我国每年CRC新发病例超过25万,死亡病例约14万,均占世界同期CRC病例的20%[2],因此提高CRC的早期诊断率已成为临床工作的重点。随着国内外医疗技术的不断发展,外周血和粪便SEPT9基因甲基化检测、多靶点粪便DNA检测等新技术已相继出现,大大提高了早期CRC的诊断率。大量研究[3-13]证实SEPT9基因甲基化检测筛查CRC具有很高的敏感性和特异性,是诊断CRC准确且快速的微创方法。本文就SEPT9基因甲基化在CRC筛查和诊断中的研究进展作一综述。
一、SEPT9基因概述
SEPT是一类广泛分布于真核生物的进化上高度保守的骨架蛋白基因家族,编码GTP结合蛋白,共有14个家族成员(SEPT1~14),是细胞骨架的重要组成部分,在细胞质分裂、细胞极化、细胞内物质转运、胞外分泌、细胞周期调控和细胞凋亡等过程中起有重要作用[14]。SEPT基因包含许多不同的亚型,可能与多个转录产物翻译起点和变异剪接有关。研究发现SEPT基因与感染、肿瘤和神经系统疾病等的发生有关[15]。
1. SEPT9基因的结构及其功能:SEPT9是SEPT基因家族成员之一,长约24×104bp,位于人类染色体17q25.3,其编码的SEPT9蛋白由可变的N端、C端结构域和GTP结合域组成,含有17个外显子,编码SEPT9蛋白和15种多肽。SEPT9基因有18种转录产物,广泛分布于除胸腺和脑组织外的其他组织中。SEPT9各亚型之间具有一定的结构相似性,N端可产生6种不同的mRNA变异剪接体,包括长式(SEPT9_v1、SEPT9_v2、SEPT9_v3,其N端分别相差了25、8、7个氨基酸)、中间式(SEPT9_v4、SEPT9_v4*)和短式(SEPT9_v5)[16]。SEPT9_v4和SEPT9_v4*虽然转录产物不同,但这两种亚型编码的多肽链相同。SEPT9蛋白位于SEPT蛋白八聚体的两末端位置,其表达异常或缺如可能会严重影响细胞分裂等生理活动的正常进行[17]。
SEPT9基因的生理功能主要包括维持细胞骨架以及调控囊泡运输、细胞极性、细胞分裂和细胞凋亡等。SEPT9蛋白在细胞分裂末期起有重要作用,其表达如受到小干扰RNA的影响,会使细胞不能完全分裂,最终导致双核细胞的产生[18]。SEPT9基因是一种抑癌基因,其甲基化会抑制该基因正常表达,导致细胞分裂异常和癌变,具体机制可能与细胞微管结构功能变化、细胞动力异常、细胞内外物质转运障碍等有关[19]。
2. SEPT9基因参与CRC的机制:目前较为公认的CRC癌变学说是“腺瘤-异型增生-癌变”。随着疾病进展,结肠组织SEPT9 mRNA表达呈进行性减少,且CRC组织中SEPT9 mRNA水平显著低于健康对照组[15]。结肠组织良性病变进展为恶性病变的原因可能与SEPT9 mRNA表达下调和基因表达减少有关[20]。SEPT9参与CRC癌变的机制主要包括缺氧诱导因子(HIF)-1信号通路、JNK信号通路、Rho信号通路以及通过影响细胞正常分裂诱导多核细胞产生等途径[21]。
3. SEPT9基因甲基化在CRC发生中的作用:CRC的发病机制与基因突变、染色体缺失、表观遗传学改变等相关,而表观遗传学改变为早期诊断CRC提供了条件[22-23]。Ahmed等[24]的研究发现,SEPT9_v2转录本启动子gamma1区域高甲基化是CRC发生的标志,故可通过早期检测血浆中该区域的甲基化程度来实现CRC的筛查。异常高甲基化通常发生在基因启动子区CpG岛处[25],特定的癌症相关基因(尤其是抑癌基因)异常甲基化引起相应基因表达异常,导致转录沉默和抑癌基因失活,最终使其生理功能发生异常,是诱导癌症发生的主要机制之一[26]。CRC患者结直肠组织中,从CpG岛3(CGI3)的核心到N端均存在异常高甲基化,而腺瘤患者结直肠组织CGI3的N端未发生甲基化,表明在腺瘤癌变过程中,基因甲基化程度是逐渐进展的。在CRC早期阶段,高甲基化的SEPT9基因被释放到外周循环血液中,通过检测外周血SEPT9基因的甲基化程度可判定CRC的患病风险[24]。
二、SEPT9基因甲基化检测筛查CRC的临床试验
1. 外周血SEPT9基因甲基化与CRC临床病理特征之间的联系:李士杰等[3]通过对91例CRC和79例非CRC患者的外周血进行检测发现,SEPT9基因甲基化阳性率与患者年龄、性别和病变部位无关,低分化患者甲基化阳性率显著高于高分化患者,进展期患者显著高于早期患者。Lee等[27]对101例CRC患者外周血样本进行分析,发现运用SEPT9基因甲基化检测诊断左侧结肠癌和右侧结肠癌的敏感性分别为28.6%和38.8%,两者无明显差异,说明其阳性率可能与病变部位无关。
2. 外周血SEPT9基因甲基化检测筛查CRC具有较高的敏感性和特异性:临床研究证实,SEPT9基因甲基化是CRC的特异性标记物之一。研究发现,正常肠黏膜上皮、结肠病变组织、CRC组织、CRC转移过程中,均可检测到DNA异常甲基化[28]。近年多项研究发现,SEPT9基因甲基化检测筛查CRC的敏感性主要为65%~85%,最低为36.6%;特异性主要为85%~95%,最高可达99%(表1)。由此可见,SEPT9基因甲基化检测筛查CRC具有较高的敏感性和特异性。
3. 外周血SEPT9基因甲基化阳性率与CRC分期有关:临床试验[3-13]发现,不同分期的CRC患者中均能检测到SEPT9基因甲基化,其中Ⅰ期检出率约为50%,Ⅱ期和Ⅲ期检出率约为70%,而Ⅳ期检出率几乎达100%,说明SEPT9基因甲基化水平与肿瘤恶性程度呈正相关,可作为CRC分期的指标。此外,术前SEPT9基因甲基化阳性的CRC患者接受根治手术后阴转率可高达88.9%[27],说明血浆甲基化SEPT9有可能作为CRC患者的随访指标。
4. 外周血SEPT9基因甲基化检测与结肠镜、粪便隐血试验(FOBT)筛查CRC的比较:目前我国筛查和早期诊断CRC的主要方法是问卷调查法、FOBT法、直肠指检和结肠镜检查[29]。其中,“结肠镜检查+病理活检”是诊断早期CRC的金标准,但其为侵入性检查,患者依从性较差;问卷调查法和FOBT法的影响因素较多,早期诊断CRC易出现假阳性。据统计,1/3的受试者因恐惧而拒绝行结肠镜筛查CRC,每年约44 000例患者因漏诊CRC而死亡[30],83%的受试者选择采集血液的非侵入性筛查方法[31]。SEPT9基因甲基化检测的准确性优于FOBT,且较结肠镜检查更便捷。然而,目前相对较高的费用限制了该法在大规模筛查中的应用,FOBT在价格和普及性上仍是首选。癌胚抗原(CEA)、CA19-9和CA242等肿瘤标记物亦可用于CRC的早期诊断,但阳性率低。
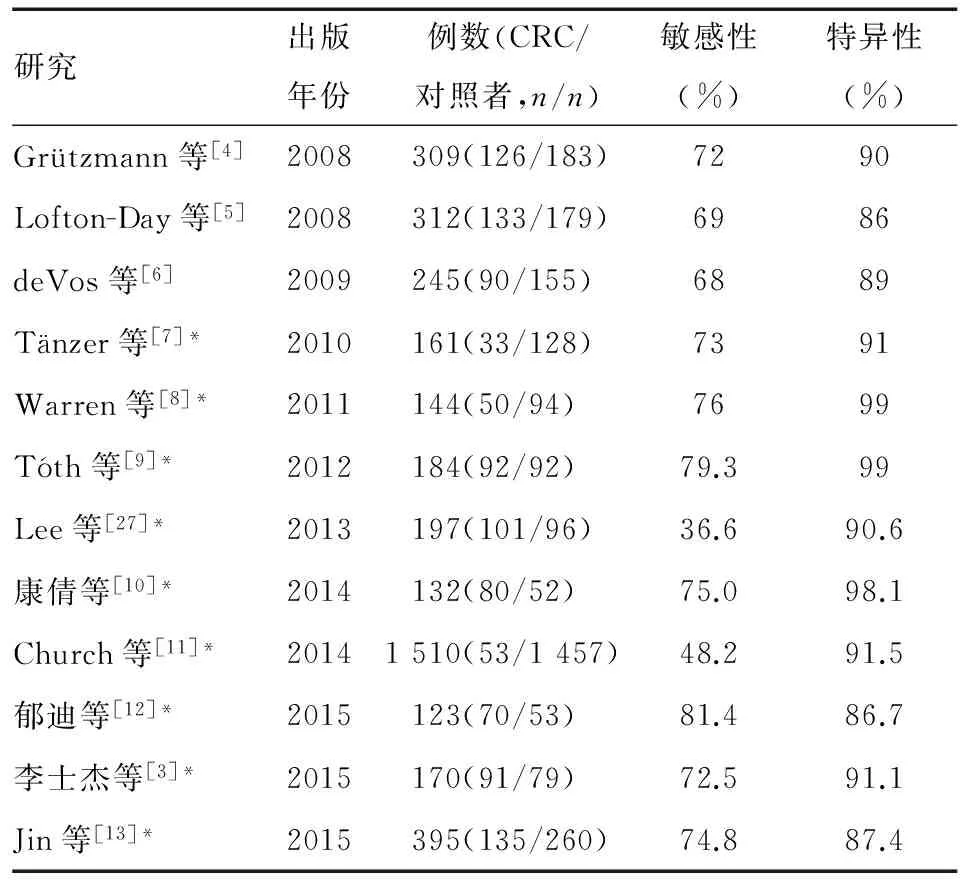
表1 SEPT9基因甲基化检测筛查CRC的敏感性和特异性
*采用2/3算法,即3次重复实验中出现≥2次阳性结果,则判断样品为阳性
5. 粪便SEPT9基因甲基化检测筛查CRC:Xue等[32]通过meta分析发现,早期CRC患者外周血和粪便中均可检测到SEPT9基因甲基化水平增高,其中外周血SEPT9基因甲基化筛查和诊断CRC已进入临床应用阶段,粪便SEPT9基因甲基化在CRC癌变过程中可作为特异性标记物之一。赵慧霞等[33]对126例CRC患者手术切除的癌组织、癌旁组织和术前粪便中提取的DNA进行SEPT9基因甲基化检测,结果显示癌组织和癌旁组织DNA中SEPT9基因甲基化率分别为84.1%和7.9%(P<0.05),与粪便组织检测结果一致,提示粪便基因甲基化检测有望代替癌组织用于CRC的早期诊断和筛查。
三、SEPT9基因甲基化与其他标记物联合检测筛查CRC
1. 血浆SEPT9基因甲基化与ALX4联合检测筛查CRC:研究[7]发现,与侵袭性CRC相比,血浆SEPT9基因甲基化与ALX4联合应用检测CRC癌前病变具有高度敏感性,敏感性和特异性可分别达71%和95%,对<10 mm息肉和>10 mm息肉的敏感性分别为37%和67%,说明血浆SEPT9基因甲基化与ALX4联合检测筛查CRC可能是更为可行的方法。何琼等[34]通过多重MethyLight多基因联合检测技术发现,CRC患者和正常人外周血ALX4阳性率分别为48% (24/50)和6%(3/50),SEPT9基因甲基化阳性率分别为75%(38/50)和4%(2/50),CRC患者外周血ALX4和SEPT9基因甲基化水平均显著高于正常人,由此可见SEPT9基因甲基化与ALX4联合检测筛查CRC有较高的特异性。
2. 血浆SEPT9基因甲基化检测与FOBT联合筛查CRC:血浆SEPT9基因甲基化检测与FOBT联用可作为CRC的筛选工具。贺娜[35]的研究发现,血浆SEPT9基因甲基化作为CRC患者外周特异性标记物,对无症状结直肠癌人群的筛查具有较高的特异性和阳性预测值,将血浆SEPT9基因甲基化检测取代FOBT或与FOBT联合应用,在CRC高危人群和癌前病变筛查中具有更高的筛查效能。Yan等[36]的研究结果显示,SEPT9基因甲基化检测和愈创木脂FOBT(gFOBT)筛查CRC的敏感性分别为66%和60%,两者联合时敏感性可达88.7%。因此,SEPT9基因甲基化检测与gFOBT联用可能有助于提高CRC诊断准确性,可作为临床实践的新方案。
3. 血清SEPT9基因甲基化与CEA、FOBT联合检测筛查CRC:郁迪等[12]对70例CRC、38例腺瘤或息肉以及15例其他肠道疾病患者血清样本行SEPT9基因甲基化检测发现,CRC患者血清SEPT9基因甲基化阳性率显著高于健康对照组(81.4%对13.2%),SEPT9基因甲基化的ROC曲线下面积(AUC)为0.841,显著高于CEA(0.716)和FOBT(0.792),三者联合检测时AUC可达0.935,说明SEPT9基因甲基化的诊断效能显著高于CEA和FOBT,且三者联合检测可进一步提高诊断效能,但血清SEPT9基因甲基化与其他标记物联合检测的最佳效能有待进一步研究。
四、结语
随着对SEPT9基因结构、功能和机制的深入研究,人们对SEPT9与CRC的相关性有了新的认识。现已有较多研究证实了外周血和粪便中的SEPT9基因甲基化检测可用于CRC的筛查和诊断,这项检测具有采样方便、受检者依从性好、敏感性和特异性高等优点,与其他标记物联合检测可提高CRC的检出率,但其在治疗效果、复发和转移的随访标记中的作用有待更多临床试验证实。
1 中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2015版)[J]. 中华消化外科杂志, 2015, 14 (10): 783-799.
2 中华医学会消化内镜学分会, 中国抗癌协会肿瘤内镜学专业委员会. 中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)[J]. 中华消化内镜杂志, 2015, 32 (6): 341-360.
3 李士杰, 刘艳刚, 王警, 等. 外周血Septin9基因甲基化检测在结直肠癌筛查中的应用[J]. 中国普通外科杂志, 2015, 24 (12): 1756-1760.
4 Grützmann R, Molnar B, Pilarsky C, et al. Sensitive detection of colorectal cancer in peripheral blood by septin 9 DNA methylation assay[J]. PLoS One, 2008, 3 (11): e3759.
5 Lofton-Day C, Model F, Devos T, et al. DNA methylation biomarkers for blood-based colorectal cancer screening[J]. Clin Chem, 2008, 54 (2): 414-423.
6 deVos T, Tetzner R, Model F, et al. Circulating methylated SEPT9 DNA in plasma is a biomarker for colorectal cancer[J]. Clin Chem, 2009, 55 (7): 1337-1346.
7 Tänzer M, Balluff B, Distler J, et al. Performance of epigenetic markers SEPT9 and ALX4 in plasma for detection of colorectal precancerous lesions[J]. PLoS One, 2010, 5 (2): e9061.
8 Warren JD, Xiong W, Bunker AM, et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer[J]. BMC Med, 2011, 9 (1): 133.
9 Tóth K, Sipos F, Kalmár A, et al. Detection of methylated SEPT9 in plasma is a reliable screening method for both left- and right-sided colon cancers[J]. PLoS One, 2012, 7 (9): e46000.
10 康倩, 金鹏, 杨浪, 等. 外周血游离DNA中Septin9基因甲基化在结直肠癌筛查中的意义[J]. 中华医学杂志, 2014, 94 (48): 3839-3841.
11 Church TR, Wandell M, Lofton-Day C, et al. Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer[J]. Gut, 2014, 63 (2): 317-325.
12 郁迪, 张小虎, 鲁辛辛. 血清SEPT9基因甲基化检测在结直肠癌诊断中的应用[J]. 临床检验杂志, 2015, 33 (9): 687-689.
13 Jin P, Kang Q, Wang X, et al. Performance of a second-generation methylated SEPT9 test in detecting colorectal neoplasm[J]. J Gastroenterol Hepatol, 2015, 30 (5): 830-833.
14 Molnár B, Tóth K, Barták BK, et al. Plasma methylated septin 9: a colorectal cancer screening marker[J]. Expert Rev Mol Diagn, 2015, 15 (2): 171-184.
15 Li Y, Song L, Gong Y, et al. Detection of colorectal cancer by DNA methylation biomarker SEPT9: past, present and future[J]. Biomark Med, 2014, 8 (5): 755-769.
16 Hall PA, Russell SE. The pathobiology of the septin gene family[J]. J Pathol, 2004, 204 (4): 489-505.
17 Smith C, Dolat L, Angelis D, et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity[J]. J Mol Biol, 2015, 427 (20): 3273-3284.
18 Chacko AD, Hyland PL, McDade SS, et al. SEPT9_v4 expression induces morphological change, increased motility and disturbed polarity[J]. J Pathol, 2005, 206 (4): 458-465.
19 Golan M, Mabjeesh NJ. SEPT9_i1 is required for the association between HIF-1α and importin-α to promote efficient nuclear translocation[J]. Cell Cycle, 2013, 12 (14): 2297-2308.
20 Tóth K, Galamb O, Spisák S, et al. The influence of methylated septin 9 gene on RNA and protein level in colorectal cancer[J]. Pathol Oncol Res, 2011, 17 (3): 503-509.
21 刘志永, 徐心. Septin9基因与结直肠癌相关性研究进展[J]. 医学综述, 2016, 22 (17): 3390-3393.
22 Coppedè F. Epigenetic biomarkers of colorectal cancer: Focus on DNA methylation[J]. Cancer Lett, 2014, 342 (2): 238-247.
23 Spisák S, Kalmár A, Galamb O, et al. Genome-wide screening of genes regulated by DNA methylation in colon cancer development[J]. PLoS One, 2012, 7 (10): e46215.
24 Ahmed D, Danielsen SA, Aagesen TH, et al. A tissue-based comparative effectiveness analysis of biomarkers for early detection of colorectal tumors[J]. Clin Transl Gastroenterol, 2012, 3 (12): e27.
25 Jones PA, Baylin SB. The epigenomics of cancer[J]. Cell, 2007, 128 (4): 683-692.
26 林春燕, 税青林. SEPT9与恶性肿瘤的研究进展[J]. 泸州医学院学报, 2013, 36 (2): 186-188.
27 Lee HS, Hwang SM, Kim TS, et al. Circulating methylated septin 9 nucleic acid in the plasma of patients with gastrointestinal cancer in the stomach and colon[J]. Transl Oncol, 2013, 6 (3): 290-296.
28 Lao VV, Grady WM. Epigenetics and colorectal cancer[J]. Nat Rev Gastroenterol Hepatol, 2011, 8 (12): 686-700.
29 张澍田. 中国早期结直肠癌及癌前病变筛查与诊治[J]. 中华医学信息导报, 2016, 31 (17): 14.
30 Willyard C. To foster screening, new colon cancer tests emphasize convenience[J]. Nat Med, 2014, 20 (4): 322-323.
31 Adler A, Geiger S, Keil A, et al. Improving compliance to colorectal cancer screening using blood and stool based tests in patients refusing screening colonoscopy in Germany[J]. BMC Gastroenterol, 2014, 14: 183.
32 Xue M, Lai SC, Xu ZP, et al. Noninvasive DNA methylation biomarkers in colorectal cancer: A systematic review[J]. J Dig Dis, 2015, 16 (12): 699-712.
33 赵慧霞, 李秋文, 董伟伟, 等. 粪便SEPT9基因甲基化检测在结直肠癌早期诊断中的应用研究[J]. 中华临床医师杂志(电子版), 2012, 6 (10): 42-45.
34 何琼, 王冕, 周建文, 等. 多重MethyLight在结直肠癌相关基因ALX4和SEPT9甲基化检测中的应用[J]. 中山大学学报(医学科学版), 2015, 36 (5): 657-662.
35 贺娜. 血浆甲基化SEPT9基因检测在优化大肠癌筛查方案中的应用研究[D]. 西安: 第四军医大学, 2015.
36 Yan S, Liu Z, Yu S, et al. Diagnostic value of methylated Septin9 for colorectal cancer screening: a meta-analysis[J]. Med Sci Monit, 2016, 22: 3409-3418.
(2016-11-18收稿;2016-12-06修回)
Advances in Study on SEPT9 Gene Methylation in Diagnosis of Colorectal Cancer
WENLei,FENGYichao,DUXia.
DepartmentofGastroenterology,YananUniversityAffiliatedHospital,Yanan,ShaanxiProvince(716000)
Correspondence to: FENG Yichao, Email: fyc.2881001@163.com
Colorectal cancer (CRC) is one of the most common gastrointestinal malignancies with poor prognosis and high mortality. SEPT9 gene is a tumor suppressor gene and plays an important role in the end of cell division. Studies have shown that methylation of SEPT9 gene could be used in the early diagnosis of CRC. This article reviewed the advances in study on SEPT9 gene methylation in the screening and diagnosis of CRC.
Colorectal Neoplasms; SEPT9 Gene; Methylation; Diagnosis
10.3969/j.issn.1008-7125.2017.06.013
*本文通信作者,Email: fyc.2881001@163.com

