黄芩苷固体脂质纳米粒的药代动力学和体外对肝癌细胞生长研究①
曹越盛,郭英雪,于 莲,周 实,平 洋
(1.佳木斯市中心医院药剂科,黑龙江 佳木斯 154002;2.佳木斯大学药学院,黑龙江 佳木斯 154007)
黄芩苷固体脂质纳米粒的药代动力学和体外对肝癌细胞生长研究①
曹越盛1,郭英雪2,于 莲2,周 实2,平 洋2
(1.佳木斯市中心医院药剂科,黑龙江 佳木斯 154002;2.佳木斯大学药学院,黑龙江 佳木斯 154007)
目的:采用高效液相色谱法研究黄芩苷固体脂质纳米粒在大鼠体内的药物动力学特征,观察黄芩苷固体脂质纳米粒在体外对肝癌细胞生长影响。 方法:采用大鼠尾静脉注射给药,测定不同时间点大鼠体内的血药浓度。采用CCK-8法测定黄芩苷固体脂质纳米粒溶液体外抑制Hep G-2细胞的生长情况。结果:黄芩苷固体脂质纳米粒溶液和黄芩苷溶液组在大鼠体内均符合药动学二室模型(权重系数为1/C2),且黄芩苷固体脂质纳米粒溶液组平均AUC0-t=350.751μg/mL,t1/2=5.983h,baicalin溶液组AUC=231.178μg/mL,t1/2beta=4.434h,黄芩苷固体脂质纳米粒溶液在体内的绝对生物利用度为163.394%。结论:黄芩苷固体脂质纳米粒溶液在大鼠体内具有缓释作用,且黄芩苷固体脂质纳米粒溶液体外对Hep G-2细胞的生长有抑制作用,并且抑制作用强于黄芩苷溶液组。
黄芩苷固体脂质纳米粒;药代动力学;体外抗肿瘤
黄芩苷(baicalin, C21H18O11)是从唇形科植物黄芩(Scutellaria baicalensis Georigi)的干燥根中提取的一种黄酮类化合物。具有多种药理作用,如降压、镇静、保肝、利胆、抗菌、消炎等,临床证明其抗菌抗炎作用确切,主要用于感染性肝炎、肺炎等疾病[1~5]。由于黄芩苷的亲水性和亲油性较差,经口服给药后,药物在肠道的吸收不完全,导致其生物利用度差,进而限制了黄芩苷在临床上的应用。因此通过改变剂型增加体内的吸收并提高生物利用度。目前国内外许多从事药物研发的工作者对黄芩苷的药理、药效等作用研究已经十分深入,已发现黄芩苷具有抗菌抗病毒、清除氧自由基、抗氧化、解热、镇痛、抗炎、抗肿瘤、保护心脑血管及神经元、保肝、预防或治疗糖尿病及其并发症等作用[6~9],肝癌是严重威胁人类健康的恶性肿瘤之一,病程隐匿,病死率高,容易产生耐药[10~13],使肝癌治疗很不理想,导致治疗失败和预后不佳。本研究将继续对黄芩苷固体脂质纳米粒(BSLNs)的体内药动学进行研究,并考察BSLNs体外抑制肝癌细胞作用。
1 仪器与试药
1.1 仪器
Agilent 1100高效液相色谱仪工作站(日本岛津公司);TGL-16M高速冷冻离心机(长沙平凡仪器仪表有限公司);FA2004N-电子分析天(上海恒平科技有限公司);XW-80A旋涡混合器(郑州南北仪器设备有限公司);371型-CO2培养箱(美国Thermo公司)TECAN sunrise光吸收酶标仪(瑞士帝肯公司)。
1.2 试药
黄芩苷原料药(诸城市浩天药业有限公司,含量85%);黄芩苷标准品(天津一方科技有限公司,含量98%,批号10081418);卡马西平标准品(中国药品生物制品检定所,含量99.7%,批号10014-201004);黄芩苷固体脂质纳米粒(自制);黄芩苷原料药(诸城市浩天药业有限公司,含量85%); CCK-8试剂盒(日本同仁化学研究所);RPMI-1640培养基(Hyclone);胎牛血清(Hyclone);PS(Hyclone);0.25%胰酶(Hyclone);PBS(Hyclone)其他溶剂或试剂均为色谱纯级别。
1.3 动物及细胞
SD大鼠(大连医科大学动物实验中心,SCXK(辽)2008-0002),体重(200±20)g;Hep G-2人肝癌细胞株(中国科学院上海生命科学研究院细胞库)。
2 实验方法
色谱条件: Agilent C18色谱柱(4.6mm ×250mm,5 μm); 流动相:甲醇-水-磷酸(55:45:0.2);流速:1mL·min-1;紫外检测波长279nm;柱温:室温; 进样量:10μL;内标:卡马西平。
对照品溶液和内标溶液配制: 精密称取黄芩苷对照品10mg,置于100mL容量瓶中,甲醇定容,配制成浓度为100μg/mL的黄芩苷对照品溶液。分别精密吸取不同浓度的标准品溶液置于10mL容量瓶中,甲醇定容,得到浓度分别为3~50μg/mL系列浓度的对照品溶液。
精密称取内标物卡马西平10mg,甲醇溶液定容于100mL容量瓶中,配成浓度为100μg/mL的卡马西平溶液。精密吸取1mL于100mL容量瓶中,配制浓度为10μg/mL卡马西平甲醇溶液备用。
动物分组及给药方案: SD大鼠8只随机分成两组,即黄芩苷溶液组和黄芩苷固体脂质纳米粒溶液组,大鼠禁食12h后尾静脉注射给药,剂量为大鼠体重30mg/kg,分别于给药后0.25、0.5、1、2、2.5、4、5、6、8、12h眼眶取血2mL于肝素钠抗凝管中,14000r/min
离心10min分离血浆,-18℃冻存。
血浆样品处理及测定: 取大鼠血浆0.5mL,分别加入内标物50μL、乙腈0.5mL,涡旋1min,14000r/min离心10min,取上清液水浴挥干(55-60℃)。残渣用300μL流动相溶解,进样10μL,记录色谱图及峰面积。
方法专属性考察: 分别吸取2份空白血浆样品0.5mL,一份按“血浆样品处理”项操作,HPLC测定并记录色谱图;另一份空白血浆样品中加入黄芩苷标准品50μL和内标物卡马西平50μL,处理方法同上,HPLC测定并记录色谱图;再取给药后血浆样品0.5mL,处理方法同上,HPLC测定并记录色谱图。
标准曲线绘制: 精密吸取若干份空白血浆,每份0.5mL,分别加入50μL浓度为3~50μg/mL的黄芩苷甲醇标准品溶液,配制成含不同浓度黄芩苷的血浆样品溶液,按“血浆样品处理”项操作,HPLC测定,以样品中黄芩苷的浓度为横坐标,黄芩苷标准品与内标物的峰面积比值为纵坐标,绘制血浆样品中黄芩苷标准曲线。
精密度考察: 取9份空白血浆,每份0.5mL,分别加入5μg/mL、15μg/mL、30μg/mL黄芩苷标准品溶液0.1mL,涡旋混合1min,配制成3个不同浓度的血浆样品,每个浓度3份,按“血浆样品处理”项进行操作,每隔10min HPLC测定,代入黄芩苷血浆标准曲线,计算日内精密度。
回收率试验: 取3份大鼠空白血浆0.5mL,分别加入高、中、低黄芩苷标准品溶液0.1mL,涡旋混合1min,按“血浆样品处理”项进行操作,HPLC测定,记录黄芩苷与内标物的峰面积,计算峰面积比值,并代入血浆标准方程中算浓度,以测得浓度与实际加入浓度的比计算方法回收率。
HepG-2细胞的培养: HepG-2细胞培养于RPMI-1640培养基中,内含90%RPMI-1640培养基,10%胎牛血清,1%PS。放于5%CO2培养箱中进行培养传代。
CCK-8实验方法: 取对数生长期HepG-2细胞按1×105/mL,接种于96孔板内,每个浓度设定3个复孔,放于5%CO2培养箱中正常培养,向每孔中加入不同浓度的baicalin溶液和BSLNs溶液,对照组加等量培养液,继续培养12、24、48h后每孔加入 CCK-8 溶液放于5%CO2培养箱培养,酶标仪450nm测定各孔的吸光度值,并计算各组对HepG-2细胞生长抑制率。
2 结果
2.1 方法专属性考察
在选定的色谱条件下,黄芩苷出峰时间为7.5min,内标物出峰时间为10.8min,黄芩苷与内标物分离较好,在样品处理过程中未引入干扰性杂质,因此在此色谱条件下,黄芩苷测定无干扰。见图1~3。

图1 空白血浆

图2 空白血浆加标准品和内标

图3 血浆样品
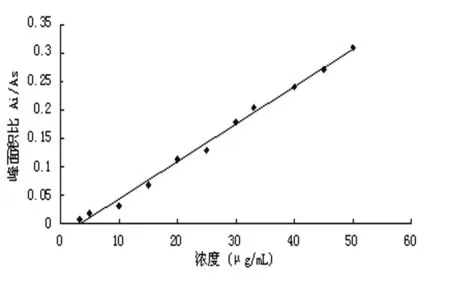
图4 HPLC法测定血样中黄芩苷标准曲线
血浆样品中黄芩苷的标准曲线方程为y=0.0066x-0.0215, R=0.9972,在线性范围为3~50μg/mL,线性关系良好,见图4。
2.2. 方法学考察
见表1~3。

表1 血浆样品中测得黄芩苷精密度
日内精密度相对标准偏差小于15%,日内精密度高,符合体内药物分析要求。

表2 血浆样品中测得黄芩苷回收率
表2说明黄芩苷在血浆中的方法回收率达到体内药物分析要求。药物浓度-时间曲线和药动学参数大鼠体内血浆药物浓度-时间曲线见图5。将BSLNs样品溶液组和baicalin溶液组的血药浓度结果用“药动学计算程序3P97”拟合,求动力学参数,见表3。

图5 大鼠尾静脉注射黄芩苷溶液和黄芩苷固体脂质纳米粒注射液后药-时曲线(n=3)

表3 大鼠尾静脉注射后动力学参数
图5可知BSLNs样品溶液组的药-时曲线下面积大于baicalin溶液组药-时曲线下面积,说明BSLNs在大鼠体内吸收效果好于baicalin溶液。由表3中数据可知BSLNs和baicalin溶液在体内药动模型均符合二室模型,权重系数为1/C2 ;BSLNs在体内的消除半衰期t1/2beta=5.983h,baicalin溶液的消除半衰期t1/2beta=4.434h,说明BSLNs样品溶液在大鼠体内的停留时间长于baicalin溶液,说明BSLNs具有缓释作用;BSLNs样品溶液组AUC=350.751,baicalin溶液组AUC=231.178,说明BSLNs在体内的吸收作用强于baicalin溶液;BSLNs样品溶液组在体内清除率CL=0.171,baicalin溶液组CL=0.260,相比baicalin溶液组 BSLNs样品溶液组在体内的清除率降低,再次说明BSLNs缓释作用效果明显。
2.3 生物利用度
绝对生物利用度,说明固体脂质纳米粒这种剂型提高了黄芩苷在体内生物利用度。
2.4 CCK-8法体外抑制Hep G-2细胞生长
见图6~8。

图6 12h HepG-2细胞体外抑制率

图7 24h HepG-2细胞体外抑制率
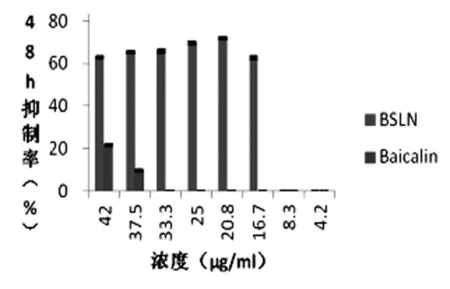
图8 48h HepG-2细胞体外抑制率
由图6~8可以看出baicalin组对HepG-2细胞生长的抑制率随着时间的延长抑制率逐渐减弱, 24h后仅42μg/mL和37.5μg/mL两个浓度对HepG-2细胞生长有抑制作用,且抑制率不足20%,其余浓度均对HepG-2细胞没有抑制作用。BSLNs组对HepG-2细胞生长的抑制率明显高于baicalin组,有效浓度在16.7~42μg/mL,且高浓度范围33.3~42μg/mL BSLNs组对HepG-2细胞生长的抑制作用随着时间的延长,24h时抑制率最高,可以达到76.7%;中浓度范围16.7~25μg/mL BSLNs组对HepG-2细胞生长的抑制率随着时间的延长呈上升趋势,且在48h抑制率为72.4%。说明BSLNs组对抑制HepG-2细胞的生长情况优于baicalin组。BSLNs较baicalin抑制HepG-2细胞生长作用强。
3 讨论
本实验对BSLNs进行了体内药动学和体外抗肝癌细胞活性研究,采用反相高效液相色谱法测定血浆样品中黄芩苷药物浓度,结果BSLNs样品溶液在大鼠体内吸收效果高于baicalin溶液;血药浓度-时间数据拟合结果可知BSLNs样品溶液和baicalin溶液在大鼠体内均符合药动学二室模型,且BSLNs样品溶液组平均AUC0-t和t1/2均高于baicalin溶液组,说明BSLNs在体内的吸收利用度较baicalin溶液组好,并且在体内具有明显的缓释作用,BSLNs在体内的绝对生物利用度为163.394%。CCK-8法体外抑制HepG-2细胞试验结果表明,BSLNs样品溶液组的体外抑制癌细胞生长作用效果明显高于baicalin溶液,这既符合黄芩苷的药理作用,也说明固体脂质纳米粒这种剂型能够保证黄芩苷最大作用发挥疗效,当然也为将来BSLNs对体内抗肿瘤作用研究提供理论基础。
[1]ZHANG Jian-chun,ZHANG Hua,SHI Ying,et al. Recent research of baicalin[J].Lishizhen Meducine and Materia Medica Research, 2005,16(3):247-249
[2]ZHANG Xi,LI Hong,HOU Mao-jun,et al.Pharmacological Studies of the skullcap and its active ingredient[J]. Tianjin Pharmaceutical,2000,12(4):8-11
[3]Hou Tanning, Zhu Xiuyuan, Cheng Guifang.Study on the anti-inflammatory mechanism of baicalin[J].Acta Pharmaceutica Sinica, 2000,35(3):161-164
[4]Wu JA,Attele AS,Zhang L,et al.Anti-HIV activity of medieinal herbs:Usage and Potential development[J].Chin Med,2001,29(l):69-81
[5]ZHANG Xi-Ping,TIAN Hua,CHENG Qi-Hui.Thecueernt situation in pharmacological study on baicalin[J].Chinese Pharmacological Bulletin, 2003,19(11):1212-1215
[6]辛文妤, 宋俊科, 何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22(6):647-653
[7]王瑞廷,申兴斌,许倩,等.黄芩茎叶总黄酮对人宫颈癌 Hela 细胞株体外生长的影响[J] .山东医药, 2005, 45:15-16
[8]Broncel M .Antiatherosclerotic properties of flavones from the roots of Scutellaria baicalensis Georgi [J] .Wiad Lek, 2007, 60(5-6):294-297
[9]郭昱, 姚树坤.黄芩甙对人肝癌BEL-7402细胞系侵袭和转移的影响[J].第三军医大学学报, 2006, 28:594-597
[10]平洋, 曹越盛, 于莲. 黄芩苷固体脂质纳米粒的制备及表征研究[J].黑龙江医药科学,2014,36(5):13-15
[11]刘娟,郭宇,胡孟洋,等.葛根素固体脂质纳米粒制备工艺研究[J].黑龙江医药科学,2016,39(1):1-5
[12]张颖慧, 平洋, 江欣,等.长春西汀纳米脂质载体制备及制剂学性质研究[J].黑龙江医药科学,2016,39(1):138-139
[13]李明军,荣向辉,李英,等.携载紫杉醇的纳米粒子靶向治疗脑胶质瘤的研究进展[J].黑龙江医药科学,2015,38(3):90-92
Study of pharmacokinetic and anti liver cancer cells effect of baicalin solid lipid nanoparticles in vitro
CAOYue-sheng1,GUOYing-xue2,YULian2,ZHOUShi2,PINGYang2
(1.Department of Pharmacy, Central Hospital of Jiamusi City, Jiamusi 154002,China;2.College of Pharmacy, Jiamusi University, Jiamusi 154007,China)
Objective: To investigate the pharmacokinetics of baicalin solid lipid nanoparticals (BSLNs) in rats by HPLC method, and the inhibitory effect of BSLNs on the Hep G-2 cells. Method: By intravenous administration, the concentration of baicalin in blood plasma at different time points were determined. Human Hep G-2 cells were treated with BSLNs, and the effects on cells inhibition were investigated by CCK-8 cell viability assay. Result: The study of pharmacokinetics of BSLNs and baicalins-sol in rats showed that the two preparations were fitted with two-compartment model; and pharmacokinetic results showed that the mean AUC0-t of BSLNs group was 350.751μg/mL, t1/2is 5.983h, while the AUC=231.178μg/mL, t1/2beta=4.434h. (Weighting factor is1/C2). The absolute bioavailability was 163.394%. Conclusion: BSLNs group shows a significant sustained-release in vivo. Then BSLNs shows a greater effect on inhibiting the growth of Hep G-2 cells compared with baicalins-sol group.
baicalin solid lipid nanoparticals;pharmacokinetics;anti-tumor in vitro
佳木斯大学校级科研项目,编号:S2014-016。
曹越盛(1985~)男,黑龙江佳木斯人,学士,药师。
平洋(1986~)女,黑龙江佳木斯人,硕士,讲师。E-mail:18245482328@163.com。
R285.5;R735.7
A
1008-0104(2017)03-0053-04
2016-12-20)

