基于肠道菌群调节的GLP-1降糖作用机制研究
袁 晓 陈夏凉 陈 颉 吴巧敏 冯晓红
基于肠道菌群调节的GLP-1降糖作用机制研究
袁 晓 陈夏凉 陈 颉 吴巧敏 冯晓红
目的 从肠道菌群调节角度探讨胰高血糖素样肽-1(GLP-1)的降糖作用机制。方法 40只SD雄性大鼠,随机分为正常组(N组)、模型组(M组)、二甲双胍组(MET组)、GLP-1组(GLP-1组),每组各10只。除N组外,其余大鼠高脂饲料喂养8周后,按30mg/kg腹腔注射链脲佐菌素(STZ)进行2型糖尿病造模。造模后,MET组、GLP-1组分别以二甲双胍及GLP-1治疗,N组和M组等量生理盐水皮下注射,治疗6周后,收集大鼠粪便,进行肠道菌群16SrDNA测序分析。结果 治疗6周后,与N组比较,M组、MET组、GLP-1组大鼠空腹血糖均显著升高(P<0.01);与M组比较,MET组与GLP-1组空腹血糖均显著下降(P<0.01),且两组差异无统计学意义(P>0.05)。Alpha多样性上,observed_species、shanno、chao 3个指数均为N组>GLP-1组>MET组>M组,与N组比较,M组、MET组3指数差异均有显著统计学意义(P<0.01),GLP-1组仅chao指数差异有统计学意义(P<0.05)。与N组比较,M组拟杆菌门比例显著下降(P<0.01),变形菌门、厚壁菌门比例显著升高(P<0.01);与M组比较,GLP-1组拟杆菌门比例显著升高(P<0.01),变形菌门比例显著下降(P<0.01)。与N组比较,M组乳酸杆菌属、双歧杆菌属比例显著下降(P<0.01),大肠杆菌属、链球菌属比例显著升高(P<0.01);与M组比较,GLP-1组乳酸杆菌属、双歧杆菌属比例显著升高(P<0.01),大肠杆菌属、链球菌属比例显著下降(P<0.01)。结论 GLP-1可能通过增加T2DM大鼠肠道菌群物种多样性,同时提高乳杆菌、双歧杆菌等益生菌比例,从而起到调控血糖的作用。
肠道菌群 GLP-1 降糖 作用机制
糖尿病是一组由遗传和环境因素相互作用而引起的临床综合征,因胰岛素分泌不足或(和)胰岛素抵抗,引起糖、脂肪、蛋白质等一系列代谢紊乱。研究发现,肠道菌群失衡与T2DM的发生、发展可能密切相关[1]。胰高血糖素样肽-1(GLP-1)是回肠及结肠远端L细胞内合成并分泌的一种肠促胰素,能通过促进胰岛素合成和分泌、减少胰高糖素分泌及减缓胃排空等多种机制调控血糖。研究证实[2],T2DM患者或小鼠胃肠旁路术后,在血糖控制改善的同时,GLP-1水平变化与肠道菌群变化存在一定的相关性。2016年 5月至11月作者应用16SrDNA测序技术,通过对正常大鼠、T2DM模型大鼠、二甲双胍及GLP-1治疗后大鼠肠道菌群的检测,观察T2DM大鼠肠道菌群的变化,并从肠道微生态菌群调节角度探讨GLP-1的降糖作用机制。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠40只,体质量(200±20)g,由浙江中医药大学动物实验中心购于中科院上海实验动物中心,实验动物许可证号:SYXK(浙)2013-0184。
1.2 主要试剂和药品 GLP-1选用美国礼来公司长效GLP-1类似物艾塞那肽注射液(商品名:百泌达);二甲双胍选用施贵宝公司药品(商品名:格华止)。粪便DNA提取试剂盒(德国QIAGEN公司);链脲佐菌素(STZ,美国Sigma公司)。
1.3 主要仪器 PCR仪(LongGene,A200),离心机(ependorf,5424),16SrDNA测序仪(Miseq,2825)。1.4 方法 (1)动物分组:适应性喂养1周后,SD大鼠随机分为4组:正常组(N组),模型组(M组),二甲双胍组(MET组),GLP-1组,每组各10只。(2)模型制备:造模方法参考《药理实验方法学》,适应性喂养1周后,开始实验:N组大鼠普通饲料喂养,其余3组大鼠高脂饲料喂养。喂养 8周后,空腹18~24h,M组、MET组、GLP-1组均按空腹体重30mg/kg腹腔注射STZ[用前以pH4.4的0.1mol/L 柠檬酸-柠檬酸钠缓冲液配成1%(10mg/ml)的浓度],并继续以高脂饲料喂养,72h后,禁食8h,尾静脉采血,测空腹血糖,2次血糖≥16.7mmol/L,即造模成功;N组仅注射同等体积的生理盐水。(3)给药剂量及方法:模型建立后,开始药物治疗6周:GLP-1 组给予艾塞那肽注射液5μg/kg,2次/d皮下注射;MET组予二甲双胍400mg/(kg·d),2次/d灌胃给药;N组和M组予等量生理盐水皮下注射,2次/d,连续6周。(4)检测指标及方法:①血糖监测:造模成功后,M组、MET组及GLP-1组大鼠测空腹血糖,1次/周,尾静脉取血,葡萄糖氧化酶法测定。②肠道菌群16SrDNA测序及信息分析:于治疗6周后,以无菌方法收集4组大鼠粪便,将每只大鼠粪便分别放入灭菌EP管,-80℃保存,称取0.1g大鼠便样,采用TIANGEN公司粪便基因组DNA提取试剂盒提取样品的总基因组DNA;16SrDNA测序通过对V3和V4双可变区进行PCR扩增,纯化产物建库,文库构建步骤遵循Illumina测序仪文库构建方法。测序分析针对Illumina MiSeq 2X300bp paired-end测序数据进行分析,对于MiSeq测序获得的双端数据,根据barcode信息进行样品区分,然后根据overlap关系进行merge拼接成tag,对拼接完成的数据进行数据过滤,随后进行Q20、Q30等质控分析,对最终获得clean数据进行OTU聚类分析和物种分类学等信息分析。
1.5 统计学方法 采用SPSS17.0统计软件。计量资料用(x±s)表示,多组数据比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠空腹血糖比较 实验开始,各组大鼠空腹血糖比较,差异无统计学意义(P>0.05)。喂养8周后,M组、MET组、GLP-1组空腹血糖均高于N组,但差异均无统计学意义(P>0.05)。治疗6周后,与N组比较,M组、MET组、GLP-1组空腹血糖均显著升高(P<0.01);与M组比较,MET组与GLP-1组空腹血糖均显著下降(P<0.01),且两组间血糖差异无统计学意义(P>0.05)。见表1。
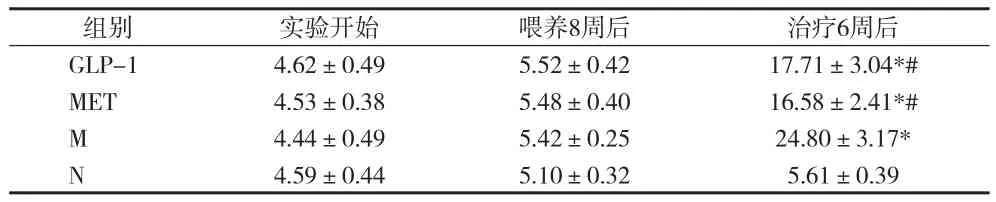
表1 各组大鼠空腹血糖变化(x±s)
2.2 肠道菌群物种Alpha多样性分析 Alpha多样性是对单个样品中物种多样性的分析,包括observed_ Species、shannon、chao指数以及simpson指数等,前面3个指数越大,最后一个指数越小,说明样品中的物种越丰富。见表2。
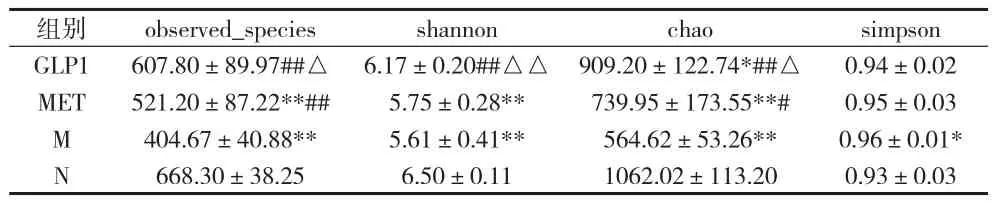
表2 各组observed Species、shannon、chao及simpson指数比较(x±s)
2.3 各组大鼠肠道菌群门分类水平的主要物种组成比较 各组大鼠肠道菌群最主要的均由拟杆菌门、厚壁菌门和变形菌门三者组成。N组大鼠肠道菌群主要组成为拟杆菌门75.5%、厚壁菌门20.8%、变形菌门3.1%;M组大鼠为拟杆菌门59.5%、厚壁菌门34.9%、变形菌门5.0%;MET组大鼠为拟杆菌门59.1%、厚壁菌门34.2%、变形菌门5.0%;GLP-1组大鼠为拟杆菌门61.0%、厚壁菌门35.1%、变形菌门3.4%。与N组比较,M组拟杆菌门比例显著下降(P<0.01),变形菌门、厚壁菌门比例显著升高(P<0.01);与M组比较,GLP-1组拟杆菌门比例显著升高(P<0.01),变形菌门比例显著下降(P<0.01),厚壁菌门比例差异无统计学意义(P>0.05);MET组拟杆菌门、厚壁菌门比例均显著下降(P<0.01),变形菌门比例差异无统计学意义(P>0.05)。
2.4 各组大鼠肠道菌群属分类水平比较 与N组比较,M组大鼠乳酸杆菌属、双歧杆菌属比例显著下降(P<0.01),大肠杆菌属、链球菌属比例显著升高(P<0.01)。与M组比较,GLP-1组大鼠乳酸杆菌属、双歧杆菌属比例显著升高(P<0.01),大肠杆菌属、链球菌属比例显著下降(P<0.01);MET组大鼠乳酸杆菌属、螺杆菌属比例显著升高(P<0.01),大肠杆菌属、链球菌属比例显著下降(P<0.01),双歧杆菌属差异无统计学意义(P>0.05)。
3 讨论
肠道是人体最大的微生态系统,其中的大量微生物称肠道菌群。据估计人体肠道中含有>1000种细菌,总数>1014个[3]。肠道菌群在合成营养成分、调节免疫、生物拮抗方面发挥着十分重要的作用。
肠道菌群失衡是指由于肠道菌群结构改变、细菌代谢活性变化或菌群在局部分布变化而引起的失衡状态,较多因素如抗生素、肠蠕动改变及饮食变化等均可引起肠道菌群失衡。最新研究认为,肠道菌群失衡可引发机体免疫力下降、慢性炎症反应、能量失衡等一系列问题,进而可导致代谢失调,最终可促使T2DM的发生[4]。
GLP-1是肠上皮细胞分泌的肠肽激素,除了刺激胰岛β细胞分泌胰岛素、抑制胰高糖素分泌等作用外,还能抑制迷走神经减少胃和十二指肠的蠕动,减少胃酸分泌、増加幽门压力、延缓胃排空。基于GLP-1可作用于胃肠道引起肠蠕动的改变,而肠蠕动的改变可引起肠道菌群变化,且临床和动物研究均显示T2DM患者或小鼠胃肠旁路术后,GLP-1水平变化与肠道菌群变化存在一定的相关性[2],因此,推测GLP-1可能可以通过对肠道菌群数量、结构等的调节起到调控血糖的作用。
本资料中Alpha多样性分析显示,与N组比较,M组大鼠肠道菌群物种多样性显著降低,这和黄旭东[5]等研究结果基本一致,提示肠道菌群物种数量下降与糖、脂代谢的异常有关,是T2DM等代谢性疾病的重要病因之一。经过GLP-1或二甲双胍治疗后,T2DM大鼠肠道菌群物种多样性均有不同程度增加,且在血糖水平无显著差异的情况下,GLP-1组肠道菌群多样性增加较MET组更为显著,接近正常组大鼠,提示GLP-1可能可以通过提高肠道菌群物种多样性起到调控血糖的作用。
在肠道菌群门分类水平比较显示,各组大鼠肠道优势菌群都集中在拟杆菌门、变形菌门和厚壁菌门。拟杆菌门包括了如多形拟杆菌等众多益生菌,而变形菌门包括较多有害菌,如大肠杆菌、螺杆菌等。与N组比较,M组大鼠拟杆菌门比例显著减少,变形菌门比例显著增加,这与既往研究基本一致[6]。与M组比较,GLP-1组拟杆菌门比例显著升高,变形菌门比例显著下降,菌群比例恢复至接近正常组大鼠;而MET组拟杆菌门、厚壁菌门比例均下降,变形菌门比例差异无统计学意义。
在肠道菌群属分类水平上比较显示,与N组比较,M组大鼠乳酸杆菌属、双歧杆菌属等益生菌属比例显著下降,而大肠杆属菌、链球菌属等有害菌属比例显著升高。经治疗后,MET组益生菌双歧杆菌属比例无显著增加,而GLP-1组乳酸杆菌属、双歧杆菌属等益生菌比例显著增加,大肠杆菌属、链球菌属等有害菌比例显著下降,趋向正常大鼠菌群水平。
对于肠道益生菌调节血糖的机制,目前已有较多研究:部分益生菌产生的丁酸进入血液中具有抗炎和改善胰岛素抵抗的作用,与胰岛素抵抗及T2DM发生密切相关[7];双歧杆菌、嗜酸乳杆菌、乳球菌等益生菌能提高机体抗氧化应激的能力,还可提高铬、锌等微量元素的生物活性。益生菌还可以提高肠道细菌分泌酶的活性,如β-半乳糖苷酶、葡萄糖苷水解酶等活性,使糖类分解为人体更易吸收的预消化状态,有助于促进外周组织对糖的摄取和利用[8];益生菌可将一些多糖转化为短链脂肪酸,部分被肠道黏膜直接利用,部分吸收入血,通过与脂肪细胞膜上的G蛋白偶联的脂肪酸受体结合,促进游离脂肪酸和葡萄糖的吸收,并改善胰岛素抵抗状态[9]。
基于GLP-1对胃肠道生理功能具有一定调节作用,结合本资料结果显示,GLP-1对肠道微生态菌群具有一定调节作用,可能通过增加T2DM大鼠肠道菌群物种的多样性,同时提高乳杆菌、双歧杆菌等益生菌比例,从而起到调控血糖的作用。这为更全面阐释GLP-1降糖作用机制,并为后续GLP-1基础上T2DM治疗靶点和治疗药物的研究提供可靠的实验依据。
[1] Backhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA, 2004, 101(44): 15718-15723.
[2] 李琳琳.db/db2型糖尿病模型小鼠肠道多形拟杆菌、产甲烷短杆菌与GLP-1的相关性研究. 中国药理通讯, 2012, 29(3): 57-58.
[3] Gill SR, Pop M, Deboy RT, et al. Metagenomic analysis of the human distal gut microbiome. Science, 2006, 312: 1355-1359.
[4] Amyot J, Semache M, Ferdaoussi M, et al. Lipopolysac-charides impair insulin gene expression in isolated islets of Langerhans via Toll-like receptor-4 and NF-kB signalling. PloS One, 2012, 7(4): e36200.
[5] 黄旭东, 郑晓鹏, 郑赵利. 2型糖尿病患者肠道菌群的研究. 河北医学, 2011, 17(8): 1041-1043.
[6] Karlsson FH, Tremaroli V, Nookaew I, et al. Gut metagenome in European women with normal. Impaired and Diabetic glucose control. Nature 2013, 498(7452): 99-103.
[7] Jakobsdottir G, Jadert C, Holm L, et al. Propionic and butyric acids, formed in the caecum of rats fed highly fermentable dietary fibre, are reflected in portal and aortic serum. Br J Nutr, 2013, 110(09): 1565-1572.
[8] Donadill BA. Fermentative metabolism by the human gut microbiota. Gastro ententerol Clin Biol, 2010, 34(1): 17-23.
[9] Talukdar S, Olefsky JM, Osborn O. Targeting GPR120 and other fatty acid sensing GPCRs ameliorates insulin resistance and inflammatory diseases. Trends Pharmacolog Sci, 2011, 32(9): 543-550.
Objective To explore the mechanism of hypoglycemic effect of GLP-1 on the regulation of intestinal fl ora. Methods 40 SD male rats were randomly divided into normal group,model group,metformin group and GLP-1 group,10 rats in each group. In addition to the N group,the other rats were fed with high fat diet for 8 weeks and intraperitoneal injection of STZ according to the 30mg/kg for type 2 diabetes model. MET and GLP-1 group were treated respectively with metformin and GLP-1,N and M groups were subcutaneous injected with normal saline for 6 weeks,then collected of rat feces to intestinal fl ora 16SrDNA sequence. Results Compared with N group,the fasting blood glucose of M,MET and GLP-1 group rats were signif i cantly elevated(P<0.01);compared with M group,MET and GLP-1 group were signif i cantly decreased(P<0.01),and no signif i cant difference between the two groups(P<0.01).The 3 indexes of observed species,shanno,and chao were N grouP>GLP-1 grouP>MET grouP>M group. Compared with N group,the 3 indexes’ difference of M group and MET group had statistical signif i cance(P<0.01),while only Chao index difference of GLP-1 group had statistical significance(P<0.01). Compared with the N group,the proportion of Bacteroidetes of M group was signif i cantly decreased(P<0.01),and the proportion of Proteobacteria and Firmicutes were signif i cantly increased(P<0.01).Compared with the M group,the proportion of Bacteroidetes of GLP-1 group was significantly increased(P<0.01),and the proportion of Proteobacteria was signif i cantly decreased(P<0.01).Compared with N group,the proportion of Lactobacillus and Bif i dobacterium of M group were signif i cantly decreased(P<0.01),and the proportion of Escherichia and Streptococcus were significantly increased(P<0.01).Compared with M group,the proportion of Lactobacillus and Bif i dobacterium of GLP-1 group were signif i cantly increased(P<0.01),and the proportion of Escherichia and Streptococcus were signif i cantly decreased(P<0.01). Conclusion GLP-1 may increase the species diversity of the intestinal fl ora of T2DM rats,and increase the proportion of probiotics such as Lactobacillus and Bif i dobacteria,thus playing a role in regulating blood glucose.
Intestinal fl ora GLP-1 Hypoglycemic Mechanism
浙江省医药卫生科技计划项目(2016KYB218)
310006 浙江中医药大学附属第一医院(袁晓 陈颉吴巧敏 冯晓红)310006 浙江大学医学院附属第一医院(陈夏凉)

