依达拉奉对不同冷缺血时间大鼠移植供肝JAK2/STAT3信号通路的影响
薛佩彤,张全胜,李欣,李宏△
依达拉奉对不同冷缺血时间大鼠移植供肝JAK2/STAT3信号通路的影响
薛佩彤1,张全胜2,李欣3,李宏3△
目的探讨依达拉奉对不同冷缺血时间大鼠移植供肝缺血再灌注损伤(IRI)后JAK2/STAT3信号通路的影响。方法SD大鼠102只,随机分为假手术组、对照组及实验组。假手术组6只,游离肝脏,不进行移植;对照组及实验组各48只,2组各自按照不同冷缺血时间30 min、6 h、12 h、18 h分为4个处理亚组,每处理组供体、受体各6只。采用改良的“二袖套法”建立大鼠原位肝移植模型,供体采用腹主动脉灌注法,热缺血时间为3~5 min。供肝在不同冷缺血时间后,实验组分别于新肝血管开放前5 min经鼠尾静脉注射依达拉奉3 mg/kg;对照组分别注射生理盐水3 mg/kg。各组受体均于6 h后处死取材。采用实时荧光定量PCR(RT-PCR)检测受体供肝组织中JAK2和STAT3 mRNA的相对表达量。结果内参基因GAPDH与检测基因JAK2、STAT3扩增良好;在同一冷缺血时间,与对照组比较,实验组大鼠供肝基因JAK2/STAT3相对表达量均明显降低(P<0.05);随冷缺血时间延长,对照组JAK2、STAT3 mRNA和实验组STAT3 mRNA相对表达量均呈逐渐降低趋势,而实验组JAK2 mRNA相对表达量呈先增后降趋势(P<0.05)。结论依达拉奉对不同冷缺血时间移植供肝具有一定的保护作用。依达拉奉可延长供肝冷缺血时间至18 h,其机制可能与抑制肝细胞JAK2/STAT3信号转导通路有关。
肝移植;活体供者;冷缺血;再灌注损伤;疾病模型,动物;大鼠,Sprague-Dawley;JAK2/STAT3;依达拉奉
目前,肝移植已成为治疗终末期肝病患者的有效方式之一[1]。通常情况下,在手术中,供体的肝脏要经过热缺血、冷缺血及植入受体等多个重要环节,这就不可避免地会发生肝脏的缺血再灌注损伤(ischemia-reperfusion injury,IRI),而其中冷缺血作为器官保存的主要不利因素直接影响了供肝的存活质量。既往研究认为,肝脏缺血后再灌注产生的过量氧自由基是引起肝脏IRI的主要原因[2]。依达拉奉(Edaravone,MCI-186)作为一种新的氧自由基清除剂,具有抗氧化作用,能够减轻多种再灌注损伤,临床中最早用于缺血性脑血管疾病的防治[3]。本研究通过建立不同冷缺血时间下供肝移植大鼠的体内实验模型,尤其是针对长时间冷缺血的肝脏供体,观察依达拉奉的作用结果并探讨其可能机制,为临床合理把握移植供肝冷缺血的安全时限提供参考。
1 资料与方法
1.1 一般资料 (1)实验动物。成年、健康、SPF级近交系、雄性SD大鼠102只(中国人民解放军军事医学科学院实验动物中心),体质量260~300 g,月龄3~4个月。普通喂养于层流动物房内,室温20~25℃。(2)主要试剂及仪器。氯化钠注射液(0.9%,CISEN 辰欣®;国药准字 H20013310)、依达拉奉注射液(1.5 g/L,积华尤敏®,国药准字H20080495)、Belzer UW液(北京慧鑫清源科技发展有限公司)、电泳缓冲液(TAE,北京Biotopped公司)、TriPure分离试剂盒(瑞士Roche)、脱氧核糖核酸酶Ⅰ(DNaseΙ,美国 NEB),cDNA 合成试剂盒、qPCR混合合成试剂盒、qPCR引物试剂盒(美国GeneCopoeia),实时荧光定量 PCR 系统(美国 ABI),8000超微分光光度计(美国Thermo),PCR仪(日本Takara)。
1.2 实验分组 大鼠按随机数字表法分组。假手术组6只,只游离肝脏,不进行移植。对照组和实验组96只,2组均各自再分为4个处理亚组,每处理组供体(体质量小者)、受体大鼠各6只,分别于30 min、6 h、12 h及18 h作相应冷缺血处理:冷缺血30 min,受体肝脏切除后立即将供肝植入受体;冷缺血6 h,切取供肝冷保存6 h后行肝移植术;冷缺血12 h,切取供肝冷保存12 h后行肝移植术;冷缺血18 h,切取供肝冷保存18 h后行肝移植术。另外选取若干体质量范围内的大鼠备用,以作为在实验过程中出现手术模型失败后每组大鼠数量的补充。
1.3 操作与干预 供体大鼠术前不禁食水;受体大鼠术前禁食12 h,自由饮水。采用5%水合氯醛(0.7 mL/100 g)腹腔注射麻醉。供体采用腹主动脉灌注法,热缺血时间控制在3~5 min,供肝切取后立即保存在4℃的UW器官保存液(the University of Wisconsin solution,UW液)中,参照改良的“二袖套法”建立原位肝移植模型[4-5]。对照组对 30 min、6 h、12 h、18 h 4个不同冷缺血时间各移植后大鼠均分别于新肝血管开放前5 min,经鼠尾静脉注射生理盐水3 mg/kg;实验组则分别于新肝血管开放前5 min经鼠尾静脉注射依达拉奉注射液3 mg/kg。所有受体大鼠均在移植6 h后处死,取移植肝组织标本进行检测;假手术组不经处理,直接取肝组织作为参照。
1.4 RNA提取和分离 按照Trizol法操作说明进行RNA的抽提,取约80~100 mg肝组织进行液氮研磨处理,经过分离、沉淀、洗涤、溶解后-70℃保存,用分光光度计测定RNA的浓度及纯度。配制1%的TAE琼脂凝胶、制备胶板、加样、调整电压为10 V/cm进行RNA电泳,结束后在紫外灯下以DL2000 DNA Marker观察。每一样本总RNA均取2 μL去除污染DNA,反转录合成cDNA,根据cDNA首链合成说明操作,反转录后-20℃保存。
1.5 定量 PCR检测 反应体系 20 μL:2×All-in-OneTM qPCR Mix 10 μL,All-in-OneTM qPCR Primer(2 μmol/L)2 μL,cDNA(1∶8 稀释)2 μL,ddH2O 6 μL。短暂离心,标准程序进行反应,扩增条件:95℃预变性10 min;95℃变性10 s,60℃退火20 s,72℃延伸15 s,循环40次。PCR反应后,72~95℃,0.5℃温度间隔,每10 s测定光密度(OD)值并进行熔解曲线分析,ABI 7500 Software v2.0.1软件测各组Ct值。引物由广州易锦生物有限公司合成,引物序列见表1。以GAPDH作为内参,假手术组所得Ct值作为正常标准值,将目的基因的 Ct值进行相对表达量 2-ΔΔCt计算[6]分析各组检测供肝JAK2和STAT3 mRNA的表达。

Tab.1 RT-PCR primer sequence表1RT-PCR引物序列
1.6 统计学方法 采用SPSS 19.0统计软件进行数据处理。符合正态分布的计量数据以±s表示,2组间比较采用t检验;组内多时点比较采用单因素方差分析,组间多重比较用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 定量PCR检测结果 OD260/OD280均在1.7~2.0内,表示提取的RNA纯度较高;琼脂糖凝胶电泳可见28 s、18 s两条较清晰的条带,无其他杂带,其中28 s条带亮度约为18 s条带的2倍,说明被检组织PCR产物RNA完整,没有降解,见图1。其次,内参基因GAPDH与检测基因JAK2、STAT3扩增曲线良好,呈“S型”,均得到Ct值;各基因产物熔解曲线均为单峰形状,表明呈特异性扩增,见图2。
2.2 2组JAK2、STAT3 mRNA相对表达量比较 同一冷缺血时间下,与对照组相比,实验组基因JAK2/STAT3相对表达量均降低(P<0.05);随冷缺血时间延长,对照组JAK2、STAT3 mRNA和实验组STAT3 mRNA相对表达量均呈逐渐降低趋势,而实验组JAK2 mRNA相对表达量呈先增后降趋势(P<0.05),见表 2。

Fig.1 Total RNA agarose gel electrophoresis image of control group and experimental group图1 对照组和实验组总RNA琼脂糖凝胶电泳图

Fig.2 Amplification plot and dissolution melt curve of gene GAPDH,JAK2 and STAT3图2 基因GAPDH、JAK2、STAT3的扩增曲线和熔解曲线图
3 讨论
肝脏是人体最大的代谢性器官,目前肝移植仍然是治疗终末期肝病的唯一有效途径[2]。早期研究显示,与有心跳或活体亲属供肝移植相比较,心脏死亡供体(Donate after cardiac death,DCD)术后原发性移植功能障碍(Primary graft dysfunction,PGD)的发生率明显更高,IRI可能是影响肝移植患者预后的主要风险因素[7]。研究认为,在手术过程中,首先影响供体器官的就是冷缺血时间,而实际上,组织或器官在缺血期形成的可逆性损伤在恢复血流后的进一步加重或者转化为不可逆损伤的过程即为再灌注损伤,因此,一定程度上来说,IRI依赖于缺血时间[8]。
3.1 冷缺血安全时限的研究现状 一般认为,冷缺血是移植器官保存的不利因素之一[1]。在临床开展肝移植初期认为,热缺血时间为5 min时,供肝在UW 液中冷缺血保存的时间不应超过 8 h[9]。Monbaliu等[10]进行的猪原位肝移植实验显示,热缺血15 min时,为避免术后早期胆管坏死,DCD供肝冷缺血时间最长不应超过8 h。杨士明[11]研究认为,供肝冷保存12 h内,可有效降低肝移植术后胆道并发症的发生。另外,Sibulesky等[12]总结了350例肝移植术后患者资料,认为长时间的冷缺血可导致患者早期出现同种异体移植功能障碍,但冷缺血时间在8~12 h时,对移植器官或患者生存率并无太大影响。因此,目前针对供肝耐受冷缺血的时限范围仍无统一的认定标准。本实验通过建立大鼠不同冷缺血时间的模型,在供肝血管开放前使用依达拉奉进行干预,结果显示,随着冷缺血时间的延长,依达拉奉可降低JAK2/STAT3的表达,并可延长冷缺血时间至18 h。
Tab.2 Comparison of relative expression of JAK2 and STAT3 mRNA between two groups表22组JAK2、STAT3 mRNA相对表达量比较(n=6,±s)
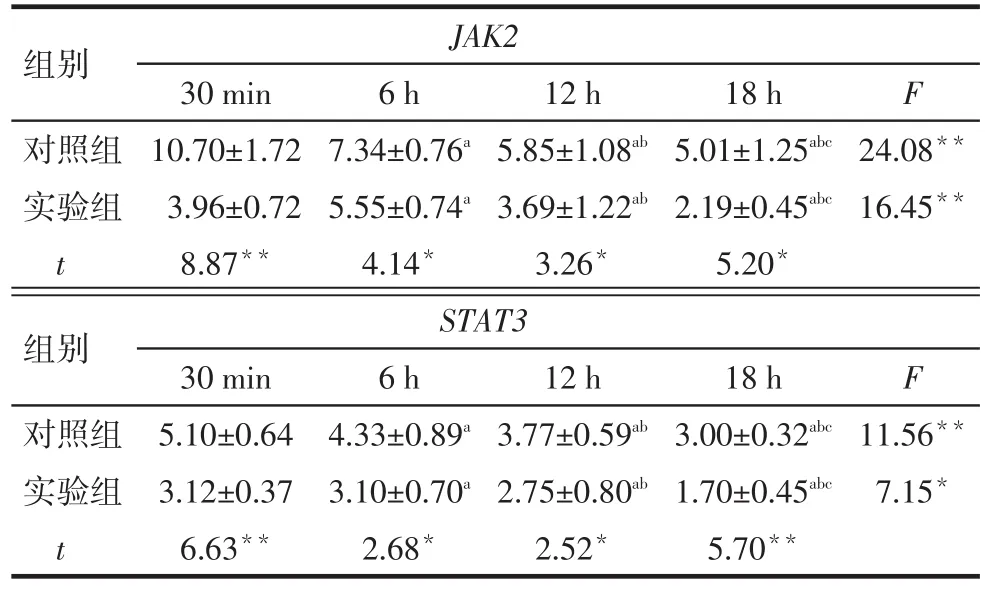
Tab.2 Comparison of relative expression of JAK2 and STAT3 mRNA between two groups表22组JAK2、STAT3 mRNA相对表达量比较(n=6,±s)
*P<0.05,**P<0.01;a与 30 min 比较,b与 6 h 比较,c与 12 h 比较,P<0.05
组别对照组实验组t组别对照组实验组t 30 min 10.70±1.72 3.96±0.72 8.87**12 h 5.85±1.08ab3.69±1.22ab3.26*18 h 5.01±1.25abc2.19±0.45abc5.20*F 24.08**16.45**30 min 5.10±0.64 3.12±0.37 6.63**JAK2 6 h 7.34±0.76a5.55±0.74a4.14*STAT3 6 h 4.33±0.89a3.10±0.70a2.68*12 h 3.77±0.59ab2.75±0.80ab2.52*18 h 3.00±0.32abc1.70±0.45abc5.70**F 11.56**7.15*
3.2 依达拉奉对JAK2/STAT3信号通路的影响 JAK/STAT信号通路是近年来研究较多的由细胞因子刺激引发的一条细胞信号转导通路,分别由JAKs和STATs蛋白家族组成,参与了细胞增殖、分化、凋亡和免疫应答等多种生物过程,JAK2/STAT3是其中一种[13]。JAK2/STAT3信号通路主要活化过程为:酪氨酸激酶相关配体与受体结合使受体二聚体化激活 JAKs,JAKs作为 STATs的上游激酶将STATs磷酸化,STATs形成二聚体使进入细胞核的信号暴露,随后调节下游的基因表达[14]。
在肝移植手术进行至再灌注期时,缺血后再开放血流,炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、活性氧等大量产生,这些细胞因子可作为配体与其胞内相应受体结合发生二聚体化,JAKs则与二聚体化的受体的功能区结合发生磷酸化进而被激活,而STATs则作为JAKs的底物进一步被激活转运至细胞核内,调控下游的基因转录,最终发挥生物学效应。有研究指出,由于Bcl-2和Bax是抗细胞凋亡的重要基因,STAT1、STAT3的过量活化能降低Bcl-2、Bax的表达,进而加剧细胞凋亡[15]。Hayashi等[16]认为依达拉奉不仅能够清除氧自由基,而且可以抑制Fas诱导的线粒体凋亡通路;抑制中性粒细胞浸润及炎症因子表达。蓝柳根等[17]研究认为,依达拉奉能够抑制与炎性因子及氧化应激相关的胞内JAK2/STAT3信号转导途径,从而减轻大鼠肝移植的IRI。与既往研究结果相符,本研究结果表明:同一冷缺血时间下,实验组中的JAK2/STAT3 mRNA相对表达量明显低于对照组,表明其表达通路受到了抑制;随冷缺血时间延长,对照组JAK2、STAT3 mRNA和实验组STAT3 mRNA相对表达量均逐渐减少;实验组JAK2 mRNA相对表达量则先增加后减少;而实验组中JAK2/STAT3 mRNA相对表达量整体下降的趋势比对照组更加明显。由此笔者推断,依达拉奉能够通过抑制JAK2/STAT3信号转导通路,从而延长大鼠移植供肝冷缺血时间,进一步减轻大鼠移植供肝的IRI,减轻肝细胞损伤,适当保护长时间冷缺血的供体肝脏。其次提示,供体肝脏JAK2与STAT3 mRNA的表达受冷缺血时间的影响,实验组在冷缺血6 h时出现JAK2的表达量较30 min时增加,这可能与依达拉奉作用于JAK2的药代动力学相关,但其具体机制还有待进一步研究。同时,本研究参照文献[4-5]选择改良后的“二袖套法”进行大鼠原位肝移植,在冷缺血30 min对照组中,JAK2的表达量明显较高,这不排除在实验起初由于人为操作的因素导致移植模型不稳定,引起结果可能出现了相对误差。另外,我国肝病患者居多,临床供体短缺、受体需求扩大以及供肝普遍要经历长时间的保存和较远距离的运送,因此保证移植供肝在冷缺血的安全时限内仍然是肝移植手术中亟待解决的主要问题之一。目前UW液已作为移植器官的最佳保护液,术前可再通过药物干预保护[18]。但是,在本实验中只是将供肝冷缺血的最长时间设定为18 h进行大鼠肝脏移植,而能否通过干预进一步保护更长时间冷缺血的供体还有待进一步的探究。
综上所述,依达拉奉对长时间的冷缺血供肝具有一定的保护作用,在热缺血时间控制在3~5 min时,依达拉奉作用于供肝冷缺血时间可延长至18 h,这一作用机制可能与其可调控JAK2/STAT3信号转导通路相关。
[1]唐晖,傅斌生,陈规划.心脏死亡器官捐献肝移植的供体功能维护[J].器官移植,2016,7(1):21-25.Tang H,Fu BS,Chen GH.Cardiac death organ donation liver transplantation donor function maintenance[J].Organ Transplantation,2016,7(1):21-25.doi:10.3969/j.issn.1674-7445.2016.01.004.
[2]Czigány Z,Iwasaki J,Yagi S,et al.Improving research practice in rat orthotopic and partial orthotopic liver transplantation:a review,recommendation,and publication guide[J].Eur Surg Res,2015,55(1/2):119-138.doi:10.1159/000437095.
[3]Fujiwara N,Som AT,Pham LD,et al.A free radical scavenger edaravone suppresses systemic inflammatory responses in a rat transient focal ischemia model[J].Neurosci Let,2016,633:7-13.doi:10.1016/j.neulet.2016.08.048.
[4]Ishii E,Shimizu A,Takahashi M,et al.Surgical technique of orthotopic liver transplantation in rats:the Kamada technique and a new splint technique for hepatic artery reconstruction[J].J Nippon Med Sch,2013,80(1):4-15.doi:10.1272/jnms.80.4.
[5]黄戎娟,刘洋,张聪.建立大鼠原位肝移植模型的手术技巧[J].肝脏,2016,21(4):298-301.Huang RJ,Liu Y,Zhang C.Surgical technique of establishing rat orthotopic liver transplantation model[J].Chinese Hepatology,2016,21(4):298-301.doi:10.14000/j.cnki.issn.1008-1704.2016.04.017.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.doi:10.1006/meth.2001.1262.
[7]Wakiya T,Sanada Y,Mizuta K,et al.Interventional radiology for hepatic artery complications soon afterliving donorliver transplantation in a neonate[J].Pediatr Transplant,2012,16(3):E81-85.doi:10.1111/j.1399-3046.2010.01441.x.
[8]Grąt M,Wronka KM,Patkowski W,et al.Effects of donor age and cold ischemia on liver transplantation outcomes according to the severity of recipient status[J].Dig Dis Sci,2016,61(2):626-635.doi:10.1007/s10620-015-3910-7.
[9]Barbas AS,Goldaracena N,Dib MJ,et al.Ex-vivo liver perfusion for organ preservation:Recent advances in the field[J].Transplant Rev(Orlando),2016,30(3):154-160.doi:10.1016/j.trre.2016.03.002.
[10]Monbaliu D,Liu Q,Vekemans K,et al.Potentiation of adverse effects of cold by warm ischemia in circulatory death donors for porcine liver transplantation[J].Transplant Proc,2012,44(9):2874-2879.doi:10.1016/j.transproceed.2012.09.078.
[11]杨士明.供肝冷保存不同时限对肝内胆管上皮细胞凋亡及Bcl-2、Fas表达的影响[D].大连大学,2014:8-16.Yang SM.The influence of liver graft different donor cold preservation time on apoptosis intrahepatic and expression of Bcl-2,Fas in bile duct epithelial cells[D].Dalian University,2014:8-16.
[12]Sibulesky L,Li M,Hansen RN,et al.Impact of cold ischemia time on outcomes of liver transplantation:a single center experience[J].Ann Transplant,2016,21:145-151.doi:10.12659/AOT.896190.
[13]Sai K,Wang S,Balasubramaniyan V,et al.Induction of cell-cycle arrest and apoptosis in glioblastoma stem-like cells by WP1193,a novel small molecule inhibitor of the JAK2/STAT3 pathway[J].J Neurooncol,2012,107(3):487-501.doi:10.1007/s11060-011-0786-z.
[14]Zhou GY,Yi YX,Jin LX,et al.The protective effect of juglanin on fructose-induced hepatitis by inhibiting inflammation and apoptosis through TLR4 and JAK2/STAT3 signaling pathways in fructose-fed rats[J].Biomed Pharmacother,2016,81:318-328.doi:10.1016/j.biopha.2016.04.013.
[15]García-Ruíz C,Morales A,Fernández-Checa JC.Oxidative stress and liver ischemia-reperfusion injury[M].Studies on Hepatic Disorders.Springer International Publishing,Switzerland,2015:149-170.
[16]Hayashi C,Ito M,Ito R,et al.Effects of edaravone,a radical scavenger,on hepatocyte transplantation [J].J Hepatobiliary Pancreat Sci,2014,21(12):919-924.doi:10.1002/jhbp.164.
[17]蓝柳根,彭民浩,卢景宁,等.依达拉奉对大鼠肝脏移植缺血再灌注损伤后JAK2/STAT3信号通路的影响[J].中外医疗,2009,32(10):16.Lan LG,Peng MH,Lu JN,et al.Effects of edaravone on JAK2/STAT3 signaling pathway afterhepatic ischemiareperfusion injury in rats[J].China Foreign Medical Treatment,2009,32(10):16.doi:10.16662/j.cnki.1674-0742.2009.10.059.
[18]Stewart ZA.UW solution:still the"gold standard"for liver transplantation[J].Am J Transplant,2015,15(2):295-296.doi:10.1111/ajt.13062.
(2017-02-13收稿 2017-04-05修回)
(本文编辑 陆荣展)
Effects of edaravone on JAK2/STAT3 signaling pathway in transplanted donor liver of rats with different cold ischemia times
XUE Pei-tong1,ZHANG Quan-sheng2,LI Xin3,LI Hong3△
1 Gansu University of Chinese Medicine,Gansu 730030,China;2 Tianjin Key Laboratory of Organ Transplantation;3 Department of Anesthesiology,the Affiliated Hospital of Logistics College of the Chinese People’s Armed Police Force△
E-mail:fch6161@sina.com
ObjectiveTo investigate the effect of edaravone on the JAK2/STAT3 signaling pathway after ischemiareperfusion injury in donor rat liver under different cold ischemia times.MethodsA total of 102 SD rats were randomly divided into sham operation group,control group and experimental group.Six rats were in sham operation group with free liver operation and no transplantation.Forty-eight rats were in control group and experimental group respectively,and divided into subgroups according to the different cold ischemia times(30 min,6 h,12 h and 18 h).There were 6 donors and 6 recipients in each group.The rat model of orthotopic liver transplantation was established by modified"two cuff method".All the donors were perfused by abdominal aorta and the warm ischemia time was 3-5 min.After different cold ischemia times,the experimental group was treated with edaravone(3 mg/kg)at 5 min before the opening of the new hepatic artery,and control group was injected with 3 mg/kg saline.Recipients of each group were sacrificed after 6 h.Finally,real-time fluorescence quantitative PCR was used to analyze the relative expression of JAK2/STAT3 mRNA of donor liver.ResultsThe GAPDH gene and JAK2/STAT3 were well amplified.Under the same cold ischemia time,compared with the control group,the relative expression of JAK2/STAT3 was significantly decreased in the experimental group(P<0.05).With the prolongation of cold ischemia time,the relative expressions of JAK2 and STAT3 mRNA showed a decreasing trend in control group and experimental group,while the relative expression of JAK2 mRNA increased first and then decreased in the experimental group(P<0.05).ConclusionEdaravone has a protective effect on transplanted donor liver during differentcold ischemia times,and extends the cold ischemia time for 18 h,which may be related to the inhibition of JAK2/STAT3 signal transduction pathway.
liver transplantation;living donors;cold ischemia;reperfusion injury;disease models,animal;rats,Sprague-Dawley;JAK2/STAT3;edaravone
R657.3
:A
10.11958/20170174
武警医学院附属医院种子基金(FYM201102)
1甘肃中医药大学(邮编730030);2天津市器官移植重点实验室;3武警后勤学院附属医院麻醉一科
薛佩彤(1990),女,硕士在读,主要从事肝脏保护方面研究
△通讯作者 E-mail:fch6161@sina.com

