脑微出血患者血清Aβ1-40 Aβ1-42的检测及意义
李学仲
河南安阳市人民医院神经内科 安阳 455000
脑微出血患者血清Aβ1-40 Aβ1-42的检测及意义
李学仲
河南安阳市人民医院神经内科 安阳 455000
目的 探讨对脑微出血患者进行血清Aβ1-40、Aβ1-42检测的意义。方法 选择2015-04—2016-04我院收治的45例急性腔隙性梗死患者为观察组,并选取同期在我院接受治疗的无急性腔隙性梗死的43例患者为对照组。分别检测2组患者的血清Aβ1-40和Aβ1-42水平,并进行比较。结果 观察组患者血清Aβ1-40水平明显高于对照组,而Aβ1-42水平则明显低于对照组,差异具有统计学意义(P<0.05)。结论 血清Aβ1-40、Aβ1-42的检测是诊断脑微出血的重要方法,Aβ1-40、Aβ1-42水平能够准确反映患者脑微出血情况。
脑微出血;血清;Aβ1-40;Aβ1-42
脑微出血是无明显症状的脑部微小动脉血管病变导致的微出血状况,是脑淀粉样血管病及高血压性脑血管病的前期表现,在老年人当中尤为多发[1]。脑微出血患者经影像学检测往往可以发现深部腔隙性梗死、脑白质病变或脑微出血等现象[2]。脑微出血不易被发现,患病后早期也无明显症状,但病情长期发展有致死和致残的危险。因此,对其进行准确诊断、确定病情,并尽早展开治疗,对保证患者生命健康极为重要。血清Aβ1-40、Aβ1-42是脑微出血诊断的重要指标[3]。本研究对我院收治的有脑微出血患者和无脑微出血患者进行血清Aβ1-40、Aβ1-42比较,探讨脑微出血患者血清Aβ1-40、Aβ1-42的检测及意义。现报告如下。
1 资料与方法
1.1 一般资料 2015-04—2016-04我院共收治45例急性腔隙性梗死患者分为观察组,另选择我院同期收治的43例无急性腔隙性梗死的患者为对照组。2组患者在一般资料及血脂水平等方面差异无统计学意义(P>0.05),具有可比性。见表1。所有患者均无严重器官功能衰竭性疾病、脑瘤,无脑部外伤史。

表1 2组一般资料及血脂水平比较
1.2 方法 采集2组患者5 mL空腹静脉血待检。在血液标本收集1 h内对血液标本进行离心处理,离心转速为3 000 r/min收集离心后的血清。将血清保存于—80 ℃的冲箱中。应用酶联免疫分析法在23~29 ℃的室温条件下使用济南来宝医疗器械有限公司生产的全自动酶免分析仪检测血清Aβ1-40、Aβ1-42水平,相关检测试剂盒由Roche公司提供。检测过程中严格按照操作说明书进行。
1.3 观察指标评定标准[3]观察并记录2组患者血清Aβ1-40、Aβ1-42水平,比较其差异性。

2 结果
观察组血清Aβ1-40水平明显高于对照组;血清Aβ1-42水平明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
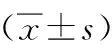
表2 2组血清Aβ1-40、Aβ1-42水平比较
3 讨论
脑微出血是脑淀粉样血管病及高血压性脑血管病的前期表现,脑微出血患者前期无任何明显症状,也不会影响患者正常的工作和生活,致残率和致死率低,但随病情发展患者的生活质量会逐渐下降,致残率和致死率也大大增加[4]。脑微出血诊断较为困难,近年来随着影像学的发展,诊断率极大提高,患者治疗更及时[5]。但因价格因素仍有很多患者不能得到明确诊治。因此,探究脑微出血病质优价廉的检测方法,提高检出率极为必要。有研究曾提出,脑微出血主要是由于血浆Aβ含量发生改变,血清Aβ1-40、Aβ1-42水平发生变化从而使血脑屏障功能受损,Aβ经血脑屏障进入脑组织、脑神经元,导致脑微血管发生损坏所致[6]。本研究以我院急性腔隙性梗死患者和未患急性腔隙性梗死患者为研究对象,探究血清Aβ1-40、Aβ1-42水平对脑微出血病的诊断价值。
临床实践发现,高血压、高胆固醇血症、冠心病、动脉粥样硬化、糖尿病、痴呆等与脑微出血有密切关系[7]。30%以上的上述疾病患者都伴有脑梗死、脑淀粉样血管病等脑微出血病[8]。梁若冰等[9]指出,大多数帕金森病患者伴有血管性损伤病变,证明脑微出血是多种脑淀粉样血管病及高血压性脑血管病的危险因素。因此,对脑微血管病及时进行救治,抑制其进一步发展能够有效延缓或避免多种脑淀粉样血管病及高血压性脑血管病的发生。
脑微出血是指患者脑部直径<4 mm的小动脉的白质和中间的灰质发生病变,脑白质由软脑膜动脉的长穿支动脉供血,而脑灰质由脑底部起源的深穿支小动脉供血[10]。一旦脑白质及脑灰质发生病变就会造成缺血性腔隙性梗死,影响患者脑部功能,患者血浆中的Aβ就会发生相应的改变。Aβ即β淀粉样蛋白,由APP序列断裂形成,是一种可溶性二聚体[11]。Aβ是大脑皮质老年斑的主要成分,是引起阿尔茨海默病的重要物质。可溶性Aβ具有诱导细胞凋亡、促进氧自由基形成、诱发钙超载和炎性反应的作用,从而直接作用于神经元产生神经毒性。且Aβ具有强大的血管调节作用,Aβ能够刺激血管内皮细胞生成大量血管舒张因子,保证机体大脑活动所需的血液供应。正常情况下机体内的Aβ由α分泌酶途径和β分泌酶途径产生,其中包含血清Aβ1-40和Aβ1-42,再经细胞外酶降解、血脑屏障清除、血管周围间隙的组织液引流途径进入血液,这样机体内的Aβ1-40和Aβ1-42可以保持动态平衡。血清Aβ1-40和Aβ1-42含量的变化是脑微出血主要病理变化之一,一旦患者脑血管发生病变,脑组织被破坏后,大脑血液正常的血液供应就会受到影响,血管舒张活性变差,缺血和缺氧后β分泌酶会产生更多Aβ,使Aβ炎性反应增强,机体Aβ值也会发生变化[12]。其中Aβ1-40大量增加形成淀粉样蛋白而Aβ1-42水平则明显下降,患者出现严重的血脑屏障障碍。本研究中,观察组患者均有脑微出血,观察组血清Aβ1-40水平明显高于对照组,血清Aβ1-42水平明显低于对照组,此研究结果与国内外脑微出血Aβ-40、Aβ1-42的相关研究一致,具有科学性。
综上所述,血清Aβ1-40和Aβ1-42是脑微出血主要表现,一旦机体脑微出血,血清Aβ1-40会迅速升高,而血清Aβ1-42则会明显下降。因此,检测血清Aβ1-40和Aβ1-42对患者是否发生脑微出血具有极高的特异性和代表性,能够提高脑微出血的检出率,且操作方法简单,价格低廉值得推广应用。
[1] 彭丹涛,许贤豪,孟晓梅,等.老年性痴呆血浆中Aβ1-42、Aβ1-40及p-tau(181P)蛋白的临床诊断意义[J].中国神经免疫学和神经病学杂志,2005,12(4):208-211.
[2] 刘承春,吴芳,张志宏,等.脑出血患者脑脊液Abeta水平检测及其临床意义[J].现代生物医学进展,2016, 16(8):1 472-1 474.
[3] 李晓秋,周中和,徐慧琴,等.淀粉样脑血管病26例尸检标本免疫组化病理研究[J].解放军医药杂志,2014, 26(4):20-23.
[4] 孙梦晗,洪艳,侯训尧,等.FPS-ZM1对糖基化终产物诱导海马区Aβ代谢水平的影响[J].山东大学学报:医学版,2014,52(7):1-6.
[5] 唐银杉,李志刚,陈万顺,等.音乐电针和脉冲电针对快速老龄化SAMP8小鼠行为学和血清Aβ蛋白的影响[J].中医药学报,2014,42(1):87-90.
[6] 李芙,李丽娜,王鑫,等.电针“百会”“涌泉”对APP/PS1双转基因小鼠海马β淀粉样蛋白及低密度脂蛋白受体相关蛋白-1水平的影响[J].针刺研究,2015,40(1):30-34.
[7] 田悦,郭善斌,郭瑶,等.七氟醚后处理对Aβ_(1-40)诱导的大鼠认知功能障碍及海马内Aβ_(1-42)含量的影响[J].中国现代医学杂志,2014,24(23):15-18.
[8] 马涛,辛文锋,张文生,等.三七皂苷R_1对Aβ_(1-42)诱导的SH-SY5Y细胞凋亡的保护作用[J].中国中药杂志,2015,40(2):303-307.
[9] 梁若冰,雷晶,张小宁.帕金森病患者合并认知功能障碍与血清Aβ1-42、胱抑素C、尿酸水平的关系[J].神经损伤与功能重建,2016,11(2):131-134.
[10] 汪琦,徐逸,王伟,等.基质细胞衍生因子-1对阿尔茨海默病脑内可溶性Aβ清除作用的研究[J].卒中与神经疾病,2015,22(3):131-134.
[11] 张明辉,李菲,张玮,等.金钗石斛总生物碱对Aβ25-35所致大鼠海马组织Aβ含量的影响[J].遵义医学院学报,2016,39(1):18-21.
[12] 倪炯,王培军,王国良,等.用RNA干扰沉默P2X7受体抑制小胶质细胞释放炎性介质的探讨[J].中华老年医学杂志,2014,33(6):648-652.
(收稿2016-11-02)
R743.34
B
1673-5110(2017)05-0081-03

