部分或完全低强化型胰腺神经内分泌肿瘤多层螺旋CT的表现特征
许秦风 郭万华
·论著·
部分或完全低强化型胰腺神经内分泌肿瘤多层螺旋CT的表现特征
许秦风 郭万华
目的 探讨部分或完全低强化型胰腺神经内分泌肿瘤(PNENs)多层螺旋CT(MSCT)的影像学特征。方法 回顾性分析44例PNENs患者的临床及术前MSCT资料,主要记录肿瘤直径、部位、边界、密度、内部结构、是否合并胰胆管扩张、有无远处器官转移等信息,并按胰腺期强化特征将其分为完全强化型及部分或完全低强化型进行比较分析。结果 44例PNENs患者中共发现肿瘤56枚,部分或完全低强化型组31枚,完全强化型组25枚,前者肿瘤直径(3.3±2.2)cm,大于后者(1.4±0.9)cm,且形态不规则者居多,肿瘤内可出现囊性成分,两组间的差异具有统计学意义(P<0.05),而患者性别、肿瘤是否有功能、肿瘤的部位、病灶边缘是否清晰、内部是否出现钙化、胰胆管是否扩张、是否出现转移等两组比较差异无统计学意义。增强后完全强化型病灶的强化峰值多出现于动脉期(76.0%,19/25),而部分或完全低强化型病灶的强化峰值多出现于胰腺期(71.0%,22/31),并且在动脉期病灶内可出现增强迂曲的微血管影,差异具有统计学意义(P<0.05)。完全强化型病灶中G1级21例,G2级4例,无G3级病例;部分或完全低强化型病灶G1级18例,G2级5例,G3级8例,两组之间差异有统计学意义(P<0.05)。结论 部分或完全低强化型PNENs与完全强化型PNENs相比,体积较大,形态不规则,内部可含囊性成分,增强后动脉期易出现迂曲的微血管影,强化峰值出现略晚,病理学分级较高。
胰腺肿瘤; 神经内分泌瘤; 体层摄影术,螺旋计算机
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, PNENs)是一种起源于胰腺导管上皮多能干细胞的少见肿瘤,病因仍未明确。目前PNENs发病率逐年增高,达0.32/10万[1]。WHO 2010年分级系统将PNENs根据细胞核分裂象以及细胞增殖指数Ki-67表达分为神经内分泌瘤G1、G2和神经内分泌癌(neuroendocrine carcinoma,NEC)G3级,后者的恶性程度远高于前者[2],因此,对其较为准确的病理学分级是下一步治疗方案选择的前提。目前,多期增强的多层螺旋CT(multi-slice spiral computed tomography,MSCT)检查是无创检查PNENs的主要手段之一,对其定性、定位以及预后判断、术后复查均具有重要作用。本研究回顾性分析PNENs的MSCT平扫及增强的表现特征。
资料与方法
一、一般资料
收集南京鼓楼医院2009年1月至2016年6月经手术或内镜超声引导下细针穿刺活检术病理证实的PNENs患者44例,其中男性18例,女性26例,年龄22~82岁,平均(55±14)岁,中位年龄56岁。21例有反复发作的低血糖病史,进食后迅速缓解;11例出现不同程度的上腹部疼痛;1例因长期腹泻就诊;1例出现明显黄疸症状;余10例患者均无明显症状,因体检发现胰腺占位入院。2例患者出现CA19-9升高,1例患者CA125升高,1例患者CA19-9与CA125同时升高,其余患者肿瘤标志物均正常。
二、病理检查
所有患者均按WHO 2010年PNENs标准进行分级。G1级:核分裂象<2个/10个高倍视野,Ki-67阳性指数≤2%;G2级:核分裂象2~20个/10个高倍视野,Ki-67阳性指数3%~20%;G3级:核分裂象>20个/10个高倍视野,Ki-67阳性指数>20%[2]。
三、多期增强MSCT扫描方法及图像分析
采用GE Lightspeed 16或64排螺旋CT扫描仪进行腹部平扫+增强扫描。患者检查前禁食4 h以上,先行腹部CT平扫,后行3期增强扫描,采用专用高压注射器经肘前静脉团注对比剂欧乃派克1.5 ml/kg体重,分别于注药开始后25、45、90 s行3期扫描获取动脉期、胰腺期和门脉期图像。扫描条件为120 kV,250 mA,重建层厚为3 mm。
由2名具有5年以上腹部CT诊断经验的医师分别进行读片,重点关注的影像学表现包括瘤体的位置、形态、大小、边缘、强化特征,同时注意观察有无血管侵犯、胰胆管扩张、淋巴结肿大等。瘤体大小取横轴位上最大层面的长径; CT值的测量取圆形感兴趣区(region of interest,ROI),注意避开钙化、囊变、血管及肿瘤边缘部分,分别于平扫、动脉期、胰腺期、门脉期进行测量。每次测量同一患者时需保持ROI位置及大小基本相同,同时测量胰腺内正常实质部分作为对照,并参考Hyota等[3]的标准按瘤体胰腺期强化特征分为以下4型:1型为瘤体区域完全明显强化;2型为瘤体区域大部分明显强化,小部分不强化或强化程度低于正常胰腺实质;3型为瘤体区域大部分不强化或强化程度低于正常胰腺实质,小部分明显强化;4型为瘤体区域完全不强化或强化程度低于正常胰腺实质。1型称为完全强化型,2~4型归为部分或完全低强化型。胰腺周围淋巴结直径>1 cm则认为是淋巴结转移。当两人意见不统一时,经讨论达成一致。按强化类型将患者分为完全强化型及部分或完全低强化型两组。
四、统计学分析

结 果
一、PNENs影像学表现
44例PNENs患者共发现胰腺病灶56枚,6例为多发,病灶最多者为4枚,余38例均为单发。完全强化型癌灶共25枚(44.6%),部分或完全低强化型31枚(55.4%),其中2型16枚, 3型10枚,4型5枚。
病灶体积最大的直径为10.0 cm,最小的直径为0.5 cm,>2 cm的病灶25枚(44.6%),≤2 cm的病灶31枚(55.4%)。部分或完全低强化型组的病灶直径(3.3±2.2)cm,完全强化型组的病灶直径(1.4±0.9)cm。与完全强化型组比较,部分或完全低强化型组的病灶直径长,形态不规则者居多,病灶内无囊性成分、强化的微血管影出现率低,两组间差异均有统计学意义(图1,表1)。
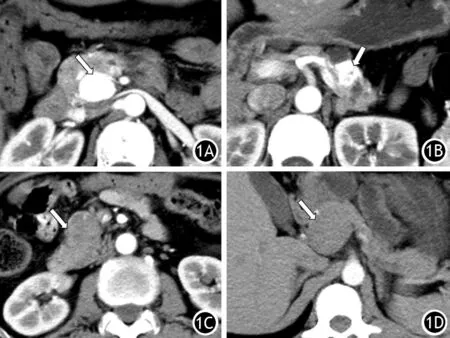
图1 PNENs的强化类型 1A完全强化型 1B大部分强化型 1C少部分强化型 1D完全低强化型
二、PNENs的MSCT增强特征与病理分级的关系
56枚瘤体中39枚为G1级,9枚为G2级,8枚为G3级(NEC)。完全强化型中G1级21枚(80.8%),G2级4枚(19.2%),未见G3级;部分或完全低强化型中G1级18枚(58.1%),G2级5枚(16.1%)、G3级8枚(25.8%)。G1级与G2级组之间的CT强化类型差异无统计学意义,而G1级+G2级组与G3级的组间差异有统计学意义(χ2=5.567,P=0.018)。完全强化型与部分或完全低强化型病灶的实性部分平扫时CT值差异无统计学意义,增强后完全强化型病灶的CT值在动脉期及胰腺期显著高于部分或完全低强化型病灶,差异具有统计学意义(P值均<0.05);而门脉期二者CT值的差异又无统计学意义(表2)。完全强化型病灶的强化峰值多出现于动脉期(19/25),而部分或完全低强化型病灶的强化峰值多出现于胰腺期(22/31),组间的差异具有统计学意义(P<0.001)。此外,56.3%(27/48)G1级+G2级病灶的强化峰值出现于动脉期,87.5%(7/8)G3级病灶的强化峰值出现于胰腺期,两者之间的差异具有统计学意义(P=0.003,表3)。
注:-:Fisher确切概率法
三、PNENs的MSCT增强特征与伴发病变的影像学表现
PNENs的伴随征象包括主胰管扩张、胰腺萎缩、胆总管扩张等,完全强化型组与部分或完全低强化型组间的差异均无统计学意义,其中胆总管扩张的4例均出现于部分或完全低强化型的病灶(表1)。PNENs的转移多见于淋巴结转移(7例,G2级2例、G3级5例)及肝转移(5例,G1级1例、G2级1例、G3级3例),较少见的有1例位于胰头部病灶浸润下段胆管及胆囊(G3级),1例浸润脾脏实质(G1级),1例浸润左肾实质(G3级,图2)。3例患者伴发浆液性囊腺瘤,1例患者伴发胰腺单纯性囊肿。
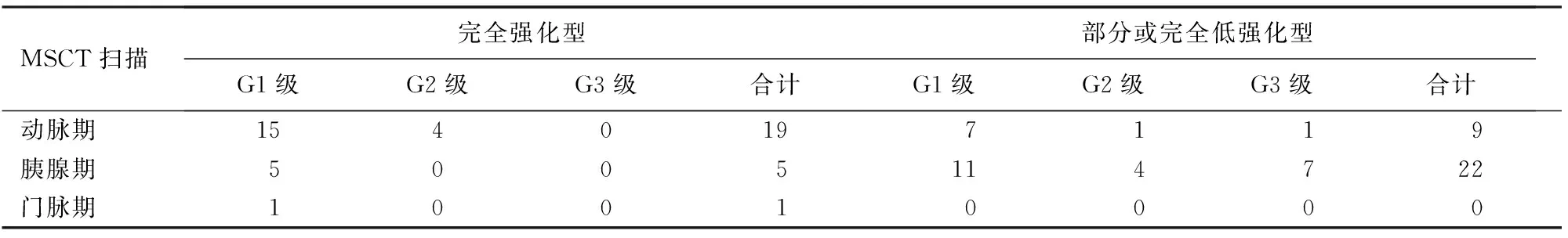
表3 56枚胰腺神经内分泌肿瘤强化峰值与病理分级的关系
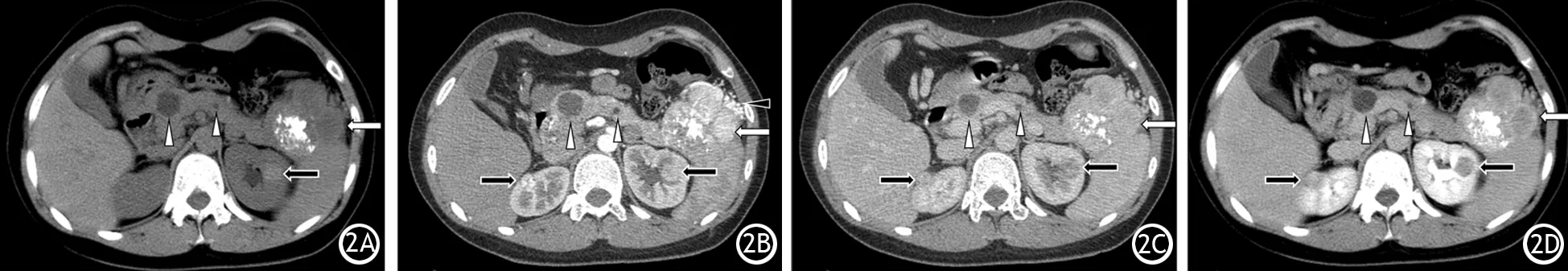
图2 CT平扫见胰尾部分叶状团块(),内部密度不均,有斑片状钙化影及较低密度影,胰腺内另见多发囊性密度结节(△),左肾实质内见高密度小结节影(2A);CT增强胰腺期,可见胰尾部肿块不均匀明显强化(),周围见迂曲扩张的小血管影(▲所示),双肾实质内各见一枚明显强化结节(2B);门脉期(2C)及延迟期(2D)可见胰尾部团块()强化程度迅速下降,中心区域较边缘更为明显,胰腺内囊性占位始终未见明显强化(△),双肾结节强化程度亦呈明显下降趋势()
胰腺薄层多期增强CT是无创检查PNENs的主要手段,对于早期诊断PNENs具有重要意义。PNENs的典型CT表现为等或低密度占位,增强后可见较为明显的强化,但由于其表现多样,亦可以见到部分病灶内部出现强化程度较低或者不强化的区域,一般认为这是由于病灶内部出现出血、坏死或者纤维组织成分较多而导致的,但也有研究认为含囊性成分的病灶是一种特殊类型的神经内分泌肿瘤,与MEN-1密切相关[4-5]。本研究将所有病灶分为部分强化型和部分或完全低强化型,并对其作比较研究。
本研究结果显示,55.4%的PNENs病灶为部分或完全低强化型,略多于既往的研究,其中完全不强化型(4型)占总数的8.9%,表明PNENs病灶含低强化成分并不罕见。通常认为CT强化程度随病理分级的增长而下降[6],本研究结果与之类似,NEC(G3级)100%表现为部分或完全低强化型,而NET (G1级+G2级)仅为47.9%。同时NEC的强化峰值多出现于胰腺期,NET的强化峰值多出现于动脉期,早于前者,部分病灶强化程度甚至近似于腹主动脉,证明NET的血供较NEC丰富。无论是部分强化型还是完全强化型,大多数病灶至少在某一期强化程度高于正常胰腺实质,提示大部分PNENs病灶为富血供病变,部分病灶在动脉期可见内部迂曲的微血管影,尤其以部分强化型更多见,证实了这一观点。值得注意的是,5例完全不强化型病灶均为G1级,其中4例在CT平扫时内部呈均匀一致的实性密度,病理证实均为胰岛细胞瘤,考虑可能由于病灶血供确实并不丰富,亦有可能因为强化峰值出现过早而未能在正确的强化时间点显像,这一现象尚需进一步研究。
PNENs的定位对于后续手术治疗有重要意义,本组病灶位于胰头及胰尾部者较多,但病灶位置与其强化类型关系不大。部分或完全低强化型病灶的体积较完全强化者大,并且形态较为多变,内部出现囊变者较多,这可能因为恶性程度较高的肿瘤生长速度快,瘤体中心供血不足,常导致瘤体内出血坏死,因此体积较大,形态不规则,中心易出现坏死囊变,与之相反,完全强化型病灶多为G1级和G2级,恶性程度较低的肿瘤生长速度较慢,内部细胞形态较为均匀一致,因此体积较小,形态较为规则,血供较为丰富,囊变坏死较少。一项对109例PNENs患者的研究表明,大约21.1%的PNENs病灶会出现钙化[7],本组病例中约17.9%的病灶出现斑点或斑片状钙化,略低于文献报道。有学者认为非功能性PNENs钙化灶出现概率高于功能性PNENs,且病灶中出现钙化通常是提示肿瘤恶性程度较高[8],但本组病例中完全强化型与部分或完全低强化型病灶出现钙化的概率没有明显差异,且病理证实为NEC的8枚病灶均未出现钙化。
PNENs病灶边缘一般都较为清晰,部分病灶增强后可见环形强化,这可能与大多数病灶具有完整包膜有关,且胰周脂肪间隙亦通常较为清晰。一般认为PNENs很少累及胰腺导管及胆管,少部分病灶由于位置和体积的原因会导致胰管或胆管受压、扩张,但胰胆管扩张程度一般较轻,管壁光滑,病灶与胰胆管之间不存在密切联系,通常也不会导致远端胰腺萎缩。本组3例出现胰胆管扩张者均为体积较大的胰头部病灶(>2.0 cm),其中1例的NEC浸润累及胆总管下段及胆囊,CT及MRI均可见局部胆管截断呈杯口状,提示PNENs,特别是NEC具有侵犯胰胆管的能力。PNENs可以发生局部侵犯及远处转移,主要转移至肝、脾及淋巴结等部位,发生转移的多数为G2级及G3级病灶,亦可见G1级肿瘤局部浸润脾脏者。此外,本组病例未见侵犯血管者,仅有部分位于胰腺尾部病灶的患者由于肿瘤体积较大(>5 cm),包绕、压迫脾门血管,此时可出现胰源性门脉高压症。
总之,胰腺内分泌肿瘤含有低强化或不强化成分的并不少见,其恶性程度较高,影像学表现为体积较大,形态不规则,密度不均匀,囊变成分出现较多,增强后动脉期病灶内常出现强化的微血管影,实性成分强化峰值多在胰腺期,病灶病理学分级较高。掌握这些特征以及结合患者临床资料,有助于早期诊断PNENs。
[1] 中华医学会肿瘤学分会胰腺癌学组(筹).胰腺神经内分泌肿瘤诊治专家共识[J].中华肿瘤杂志,2014,36(9):717-720.DOI:10.3760/cma.j.issn.0253-3766.2014.09.017.
[2] 中国胃肠胰神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理学诊断共识[J].中华病理学杂志,2011,40(4):257-262. DOI:10.3760/cma.j.issn.0529-5807.2011.04.010.
[3] Hyodo R, Suzuki K, Ogawa H, et al. Pancreatic neuroendocrine tumors containing areas of iso- or hypoattenuation in dynamic contrast-enhanced computed tomography: Spectrum of imaging findings and pathological grading[J]. Eur J Radiol, 2015, 84(11):2103-2109.DOI: 10.1016/j.ejrad.2015.08.014.
[4] Chen M, Van Ness M, Guo Y, et al. Molecular pathology of pancreatic neuroendocrine tumors[J]. J Gastrointest Oncol, 2012, 3(3):182-188. DOI: 10.3978/j.issn.2078-6891.2012.018.
[5] Ridtitid W, Halawi H, DeWitt JM, et al. Cystic pancreatic neuroendocrine tumors: outcomes of preoperative endosonography-guided fine needle aspiration, and recurrence during long-term follow-up[J]. Endoscopy, 2015, 47(7):617-625. DOI: 10.1055/s-0034-1391712.
[6] Kartalis N, Mucelli RM, Sundin A. Recent developments in imaging of pancreaticneuroendocrine tumors[J]. Ann Gastroenterol, 2015, 28(2):193-202.
[7] Kim JH, Eun HW, Kim YJ, et al. Pancreatic neuroendocrine tumour (PNET): Staging accuracy of MDCT and its diagnostic performance for the differentiation of PNET with uncommon CT findings from pancreatic adenocarcinoma[J]. Eur Radiol, 2016,26(5):1338-1347. DOI: 10.1007/s00330-015-3941-7.
[8] 王铁功,詹茜,刘芳,等.胰腺神经内分泌肿瘤良恶性CT征象分析[J].中华胰腺病杂志,2015,15(4):242-246. DOI: 10.3760/cma.j.issn.1674-1935.2015.04.006.
(本文编辑:冀凯宏)
MSCT features of partially or completely low enhancement of pancreatic neuroendocrine tumors
XuQinfeng,Guowanhua.
DepartmentofNuclearMedicine,NanjingDrum-TowerHospital,Nanjing, 210008China
Guowanhua,Email:wanhuaguo@163.com
Objective To observe MSCT features of partially or completely low enhancement of pancreas neuroendocrine tumors (PNENs). Methods The clinical data and MSCT features before pancreatectomy in 44 patients with confirmed PNENs were retrospectively reviewed. The MSCT findings were evaluated including tumor size, location, margin, density, intratumoral structure, bile duct and pancreatic ductal dilation and distant metastasis. Tumors were classified into complete enhancement type, partially or completely low enhancement type for further comparative analysis based on MSCT enhancement during pancreatic stage. Results A total of 56 PNENs in 44 patients were found, and there were 31 partially or completely low enhanced PNENs and 25 completely enhanced PNENs. The former were larger than the latter [mean tumor size, (3.3±2.2)cmvs(1.4±0.9) cm], and irregular shape and cystic components within tumors were more often observed (allP<0.05). There were no significant differences between the two types of PNENs in terms of gender, the presence of functional tumor, tumor location, clear tumor margin, intratumoral calcification, bile and pancreatic duct dilation and metastasis. 76.0%(19/25) of completely enhanced PNENs reached peak enhancement in arterial phase, and 71.0%(22/31) of low enhancement PNENs reached peak in pancreatic phase. Enhanced intratumoral blood vessels in the arterial phase were more frequent in low enhancement PNENs, and the difference was statistically significant (P<0.05). There were significant differences on pathological grade between the two types of PNENs (G1=21,G2=4,G3=0vsG1=18,G2=5, G3=8), and the difference was statistically significant (P<0.05). Conclusions Compared with complete enhancement PNENs, partially or completely low enhancement PNENs had bigger size, irregular shape, and cystic component. Intratumoral blood vessels in the arterial phase were observed, peak enhancement arrived later and the pathological grade was higher.
Pancreatic neoplasms; Neuroendocrine tumor; Tomography, spiral computed
10.3760/cma.j.issn.1674-1935.2017.03.009
210008 南京,南京鼓楼医院核医学科
郭万华,Email: wanhuaguo@163.com
2016-08-02)

