水通道蛋白在大鼠急性坏死性胰腺炎结肠中的表达及意义
陈影 谢荣理 王金龙 祁梦之 杨之涛 许志伟 费健 毛恩强 陈尔真
·论著·
水通道蛋白在大鼠急性坏死性胰腺炎结肠中的表达及意义
陈影 谢荣理 王金龙 祁梦之 杨之涛 许志伟 费健 毛恩强 陈尔真
目的 观察急性坏死性胰腺炎(ANP)大鼠结肠组织内水通道蛋白(AQP)表达的变化。方法 采用经胰胆管逆行注射牛磺胆酸钠的方法建立ANP大鼠模型。制模后4、8、12、24 h处死大鼠,每个时间点6只,取结肠组织行病理学检查,采用 RT-PCR 法检测近端及远端结肠组织IL-6、TNF-α mRNA和AQP(AQP-3、AQP-4、AQP-8)mRNA的表达;采用免疫组织化学染色方法检测结肠组织中AQP的表达。结果 制模后SD大鼠结肠黏膜连续性被破坏,上皮细胞结构模糊,绒毛断裂、脱落,黏膜下层炎性细胞浸润,病理评分随造模时间延长而升高。除造模后4 h远端结肠组织的AQP-4 mRNA无显著变化外,其他时间点ANP大鼠近端及远端结肠组织的IL-6、TNF-α mRNA表达,AQP-3、AQP-4、AQP-8 mRNA及蛋白表达均较假手术组显著升高,差异有统计学意义(P值均<0.05)。ANP大鼠近端结肠AQP-3、AQP-8的mRNA表达在造模后8 h时达峰值,AQP-4 mRNA表达在24 h达峰值;远端结肠AQP-3、AQP-4 mRNA表达在8 h时达峰值,AQP-8 mRNA表达在24 h达峰值;近端及远端结肠AQP-3、AQP-4、AQP-8蛋白表达在12、24 h时最强。结论 ANP大鼠近端及远端结肠AQP-3、AQP-4、AQP-8 mRNA和蛋白表达均出现不同程度的上调,并随着病程的进展逐步升高,提示其可能参与ANP时结肠的水代谢过程。
胰腺炎,急性坏死性; 水通道蛋白; 结肠; 膜蛋白类
Fund program:This work was supported by the National Natural Science Foundation of China (81600501, 81670581, 81671901, 81571931)
水通道蛋白(aquaporin, AQP)是一类位于细胞膜上的整合膜蛋白,属于主要内源性蛋白(major intrinsic protein,MIP)家族。它在细胞膜上组成“孔道”,控制水在细胞内的进出,且不允许离子或其他小分子物质(包括蛋白质)通过[1-2]。AQP广泛分布于人体各个脏器组织的细胞膜上,参与机体几乎所有的生理与病理过程,与许多疾病的发生和发展密切相关[2-3]。结肠最重要的生理功能之一是液体的吸收与分泌。近年来研究发现,结肠大量表达AQP[4-5],AQP的异常表达可导致结肠对水的吸收与分泌紊乱[6-8]。重症急性胰腺炎(SAP)发病早期释放大量炎症因子,增加毛细血管通透性,导致大量体液渗漏,进而减少有效循环血量,从而影响结肠黏膜上皮的通透性及水代谢。本研究通过构建急性坏死性胰腺炎(ANP)大鼠模型,观察ANP大鼠结肠中AQP的表达,探讨其对ANP时结肠水代谢的影响。
材料与方法
一、实验动物及分组
30只健康Sprague-Dawley(SD)雄性大鼠购于上海斯莱克实验动物公司,清洁级。于上海交通大学医学院附属瑞金医院动物实验中心适应性喂养2周后按数字表法随机分为ANP组(24只)和假手术组(6只)。采用经胰胆管注射5%牛磺胆酸钠溶液(Sigma-Aldrich公司)0.1 ml/100 g体重的方法制备ANP模型[9],制模后4、8、12、24 h分批处死大鼠,每个时间点6只,取结肠组织。假手术组开腹后翻动胰腺和十二指肠组织后关腹,12 h后处死大鼠,取结肠组织。部分结肠组织置4%多聚甲醛液中固定,常规制备石蜡切片;部分结肠组织即刻置液氮中冻存。
二、结肠组织病理学检查
取4%多聚甲醛固定的结肠组织,经脱水、透明、透蜡、包埋、切片后行苏木精-伊红(HE)染色,光镜(100×)下观察组织的病理变化,并参考文献[10]进行病理评分。
三、RT-PCR法检测结肠组织AQP、IL-6、TNF-α mRNA的表达
取小块液氮冻存的大鼠结肠组织,在研钵中加入液氮碾磨,加入500 μl Trizol(Invitrogen公司)反复抽吸混匀,装入DEPC水处理过的1.5 ml离心管中。每管加入预冷的氯仿200 ml,颠倒混匀多次,室温静置5 min后于4℃、12 000 r/min离心15 min,吸取上清,加入等容积异丙醇混匀,室温静置5 min后于4℃、12 000 r/min离心15 min,弃上清。用1 ml预冷的75%乙醇洗涤沉淀后于4℃、8 000 r/min离心5 min,弃上清,置室温下待乙醇完全挥发后加入DEPC水,混匀后于65℃加热5 min以充分溶解RNA。采用生物分光光度法分析RNA纯度及浓度,置-80℃冰箱保存。采用RT-PCR方法检测组织AQP、IL-6、TNF-α mRNA表达,以β-actin为内参。各引物序列见表1,由Invitrogen公司设计并合成。RT试剂盒及荧光定量PCR反应试剂盒均购自TaKaRa公司,严格按说明书操作。

表1 AQP、IL-6、TNF-α基因及内参β-actin的引物序列
四、免疫组织化学染色检测结肠组织中AQP蛋白的表达
采用免疫组织化学试剂盒(Histostain-Plus IHC Kit, Life technologies公司)检测,严格按照说明书操作。兔抗大鼠AQP-3、AQP-4抗体和山羊抗大鼠AQP-8抗体分别购自Abcam公司及Santa Cruz Biotechnology有限公司,工作浓度均为1∶500。以胞质内出现棕黄色颗粒为阳性表达。每张切片在光镜下观察6个高倍镜视野,统计阳性细胞数。
五、统计学处理

结 果
一、大鼠结肠组织的病理变化
假手术组大鼠近端结肠黏膜上皮完整、无明显水肿,上皮细胞排列整齐,黏膜下层见少量炎性细胞浸润(图1A)。ANP 4 h组大鼠结肠上皮病理表现与假手术组基本相似,黏膜上皮基本完整,无明显水肿,上皮细胞偶见结构模糊;8、12 h起病变逐渐加重,上皮细胞排列紊乱,黏膜上皮不完整,绒毛萎缩、断裂、脱落,黏膜下层大量炎性细胞浸润(图1B);造模后24 h的结肠病理损伤最明显。各组大鼠远端结肠病变基本同近端结肠相似,略轻于近端结肠(1C、1D)。造模后8 h起黏膜连续性被破坏,上皮细胞结构模糊,绒毛断裂、脱落,黏膜下层炎性细胞浸润明显,造模后24 h病变最严重。大鼠近端、远端结肠病理评分随造模时间延长而升高,以24 h的评分最高(表2)。
二、各组大鼠结肠组织IL-6、TNF-α mRNA表达水平的变化
ANP大鼠近端及远端结肠组织IL-6 mRNA表达显著高于假手术组(P值均<0.05)。近端结肠IL-6 mRNA表达在24 h达到峰值,其中8、24 h的表达显著高于4 h,差异有统计学意义(P值均<0.05);远端结肠在12 h达到峰值,其中8 h的表达显著高于4 h,差异有统计学意义(P<0.05,表3)。
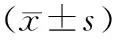
表2 各组大鼠近端及远端结肠组织的病理评分
注:与假手术组比较,aP<0.05;与ANP 4 h组比较,bP<0.05;与ANP 8 h组比较,cP<0.05

图1 假手术组、ANP 12 h组大鼠近端((1A、1B)及远端结肠组织(1C、1D)的病理变化(HE ×100)
ANP大鼠近端及远端结肠组织TNF-α mRNA表达显著高于假手术组(P值均<0.05)。近端结肠TNF-α mRNA表达在24 h达到峰值,但各时间点的差异无统计学意义;远端结肠TNF-α mRNA表达在12 h达到峰值,随后降低,其中12 h的表达显著高于4 h及24 h,8 h的表达显著高于24 h,差异均有统计学意义(P值均<0.05,表4)。
三、各组大鼠结肠组织AQP mRNA表达水平的变化
ANP大鼠近端结肠AQP-3、AQP-8 mRNA表达显著高于假手术组,差异均有统计学意义(P值均<0.05)。AQP-3、AQP-8 mRNA表达在8 h时达峰值,12、24 h时的表达较8 h时显著下降,差异有统计学意义(P值均<0.05),但12 h与24 h间的差异无统计学意义。近端结肠AQP-4 mRNA表达显著高于假手术组,差异有统计学意义(P<0.05),24 h达峰值,但各时间点的差异无统计学意义(表3)。
ANP大鼠远端结肠AQP-3、AQP-8 mRNA表达显著高于假手术组,差异均有统计学意义(P值均<0.05)。AQP-3 mRNA表达在8 h时达峰值,以后开始下降,但各时间点的差异无统计学意义;AQP-8 mRNA表达于24 h达峰值,显著高于其他时间点的水平,差异均有统计学意义(P值均<0.05)。AQP-4 mRNA表达在4 h点略低于假手术组,差异无统计学意义;8 h 时升高达峰值,显著高于假手术组及ANP12、24 h组,而12、24 h的表达仍显著高于假手术组和4 h组,差异均有统计学意义(P值均<0.05,表4)。
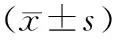
表3 各组大鼠结肠组织IL-6、TNF-α mRNA表达水平的变化
注:与假手术组比较,aP<0.05;与ANP 4 h组比较,bP<0.05;与ANP 24 h组比较,cP<0.05
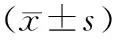
表4 各组大鼠结肠组织AQP mRNA表达水平的变化
注:与假手术组比较,aP<0.05;与ANP 4 h组比较,bP<0.05;与ANP 8 h组比较,cP<0.05;与ANP 12 h组比较,dP<0.05
四、各组大鼠结肠组织AQP蛋白表达水平的变化
AQP蛋白主要表达于结肠上皮细胞胞质,表现为出现棕黄色颗粒。假手术组大鼠近端及远端结肠均可见AQP-3表达;ANP组4、8 h时表达略增加,12、24 h时表达进一步增加(图2)。
假手术组大鼠近端结肠上皮细胞仅少量AQP-4表达;ANP组4、8 h时表达无显著增加,12、24 h表达显著增加;远端结肠上皮细胞AQP-4表达均高于近端结肠,变化趋势同近端结肠(图3)。
假手术组大鼠近端及远端结肠均表达大量 AQP-8,ANP组4、8 h时的表达无明显变化,12、24 h的表达较假手术组增加(图4)。
讨 论
SAP是一种严重的全身性疾病,涉及多器官功能损害。SAP早期,一方面由于大量炎症递质的释放及血容量不足引起肠道缺血缺氧损伤,另一方面由于胰腺的特殊解剖位置,胰周的空肠、回肠及横结肠等为首要受累脏器,发生急性胃肠功能损伤(acute gastrointestinal injury,AGI)[11-12]。本研究结果显示,ANP大鼠的近端、远端结肠由于组织缺血缺氧、炎症打击,出现黏膜、绒毛的断裂、脱落,且结肠上皮细胞IL-6、TNF-α mRNA表达显著增加。结肠平均每日吸收1.3~2 L水[4-5,13],结肠内的水分实际上是逆渗透压梯度从管腔进入血管从而完成吸收这一生理功能的,但其具体机制并不十分明确。以往的研究表明,结肠内水分的吸收属于被动转运,各种溶质(特别是NaCl)主动吸收所产生的渗透压梯度促使水分吸收进入肠上皮细胞[14]。但随着生物化学技术的发展进步,越来越多的证据表明结肠水分的转运不仅仅依赖Na+等溶质的易化扩散方式,还可能存在细胞旁路、载体系统、通道等其他主动转运机制[14-16],它们可能在机体炎症、缺血缺氧等病理状态下对结肠水代谢起不可或缺的作用。近年来研究发现消化道有大量AQP表达[4-5,17],提示经细胞途径的水分吸收机制除了简单扩散外还存在特殊的跨膜转运蛋白的快速水转运机制[4,18]。
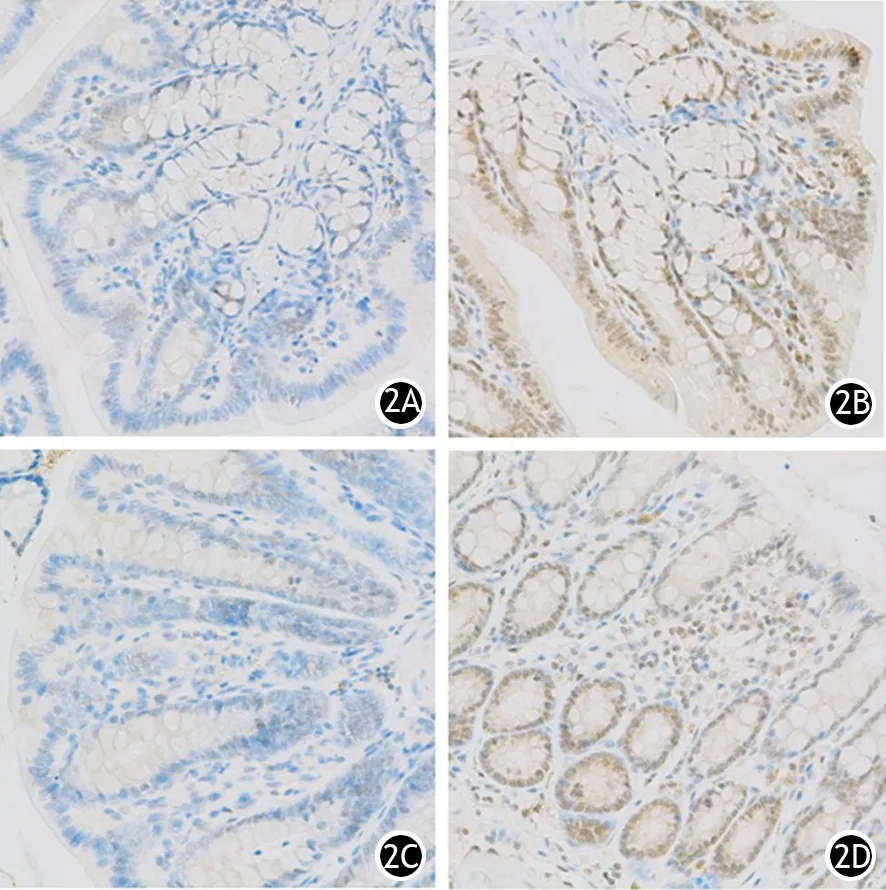
图2 假手术组、ANP12 h组大鼠近端(2A、2B)及远端结肠组织(2C、2D)的AQP-3蛋白表达(免疫组化 ×100)
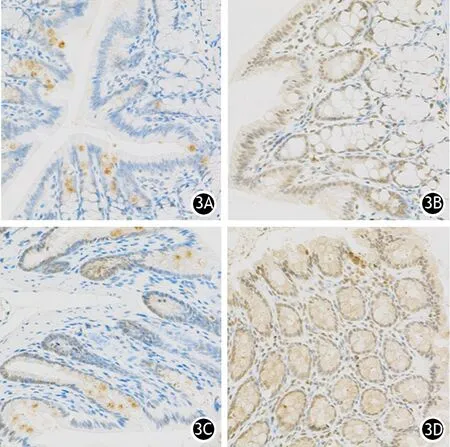
图3 假手术组、ANP12 h组大鼠近端(3A、3B)及远端结肠(3C、3D)的AQP-4蛋白表达(免疫组化 ×100)
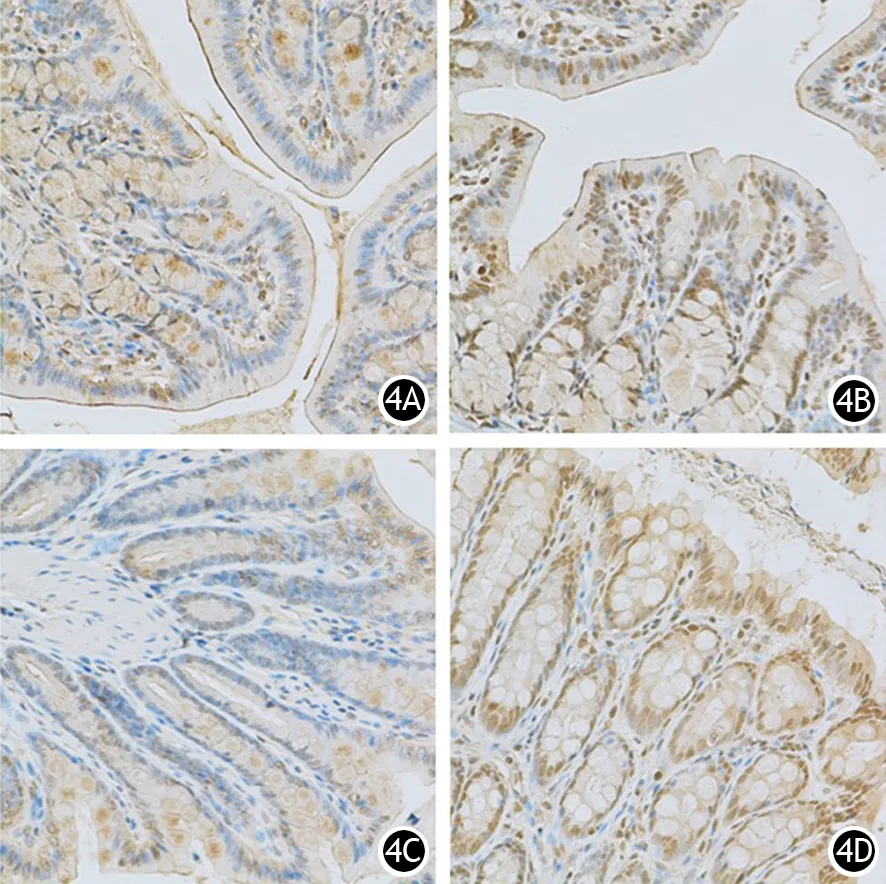
图4 假手术组、ANP12 h组大鼠近端(4A、4B)及远端结肠(4C、4D)的AQP-8蛋白表达(免疫组化 ×100)
Silberstein等[19]最初发现,AQP-3局限在结肠绒毛上皮细胞表达,并优势表达于结肠绒毛上皮细胞的顶膜,提示AQP-3与人类结肠上皮细胞对水分的吸收有一定的相关性。Ikarashi等[20]发现抑制结肠AQP-3功能可引起粪便含水量增加而导致腹泻。此外,有研究显示,腹泻型肠易激综合征患者AQP-8表达下降,导致结肠吸收功能障碍,可能与大便稀溏、腹泻等有关[21]。AQP-4主要表达于人的升结肠,有学者应用AQP-4基因敲除小鼠进行研究,结果发现小鼠结肠对水的通透性与AQP-4在结肠的表达与否及表达量的多少呈正相关。本研究结果显示,正常SD大鼠的结肠,无论近端或是远端,均有AQP-3、AQP-8表达,而AQP-4在近端结肠仅有少量表达。ANP大鼠近端及远端结肠AQP-3、AQP-4、AQP-8 mRNA和蛋白表达均出现不同程度的上调,并随着病程的进展逐步升高,提示AQP可能参与了ANP早期结肠的水吸收与分泌等转运机制。
本课题组在临床治疗SAP患者时观察到灌入患者直肠内的生理盐水均被吸收,每小时吸收的生理盐水可高达500 ml,而心率、血压等指标均有改善,患者每小时尿量亦可达到25~150 ml,且未见患者发生腹腔压力升高以及严重的组织水肿。对ANP大鼠经直肠持续匀速输入生理盐水8 h,大鼠的平均动脉压逐渐升高,并可回复到对照组大鼠的水平[22]。因此笔者认为,在SAP早期由于有效循环血量不足使机体处于“缺水”状态,除通过各种神经-内分泌调节来减少水分丢失外,亦通过一切可能途径吸收水分。经结肠吸收水分可有效地补充血容量,改善血流动力学紊乱,是机体的一种主动调节的自我保护机制。ANP大鼠结肠上皮细胞AQP-3、AQP-4、AQP-8表达上调可能是结肠主动增加水吸收的重要机制之一。
[1] Agre P. The aquaporin water channels[J]. Proc Am Thorac Soc, 2006, 3(1): 5-13. DOI: 10.1513/pats.200510-109JH.
[2] King LS, Agre P. Pathophysiology of the aquaporin water channels[J]. Annu Rev Physiol, 1996, 58: 619-648. DOI: 10.1146/annurev.ph.58.030196.003155.
[3] Agre P, Kozono D. Aquaporin water channels: molecular mechanisms for human diseases[J]. FEBS Lett, 2003, 555(1): 72-78.
[4] Ma T, Verkman AS. Aquaporin water channels in gastrointestinal physiology[J]. J Physiol, 1999, 517(Pt2):317-326. DOI:10.1111/j.1469-7793.1999.0317t.x.
[5] Laforenza U. Water channel proteins in the gastrointestinal tract[J]. Mol Aspects Med, 2012, 33(5-6):642-650. DOI: 10.1016/j.mam.2012.03.001.
[6] Zheng YF, Liu CF, Lai WF, et al. The laxative effect of emodin is attributable to increased aquaporin 3 expression in the colon of mice and HT-29 cells[J]. Fitoterapia, 2014, 96:25-32. DOI: 10.1016/j.fitote.2014.04.002.
[7] Kon R, Ikarashi N, Nagoya C, et al. Rheinanthrone, a metabolite of sennoside A, triggers macrophage activation to decrease aquaporin-3 expression in the colon, causing the laxative effect of rhubarb extract[J]. J Ethnopharmacol, 2014, 152(1):190-200. DOI: 10.1016/j.jep.2013.12.055.
[8] Ikarashi N. The elucidation of the function and the expression control mechanism of aquaporin-3 in the colon[J]. Yakugaku Zasshi, 2013, 133(9): 955-961.
[9] Kahl S, Mayer J, Schuette K, et al. Effect of procainhydrochloride on phospholipase A2 catalytic activity in sodium taurocholate-induced acute experimental pancreatitis in rats[J]. Dig Dis, 2010, 28(2):373-378. DOI: 10.1159/000319417.
[10] Coimbra R, Porcides R, Loomis W, et al. HSPTX protects against hemorrhagic shock resuscitation-induced tissue injury: an attractive alternative to Ringer′s lactate[J]. J Trauma, 2006,60(1):41-51.
[11] Park S, Lee S, Lee HD, et al. Abdominal compartment syndrome in severe acute pancreatitis treated with percutaneous catheter drainage[J]. Clin Endosc, 2014, 47(5): 469-472.
[12] Zhang XP, Zhang J, Song QL, et al. Mechanism of acute pancreatitis complicated with injury of intestinal mucosa barrier[J]. J Zhejiang Univ Sci B, 2007, 8(12): 888-895.DOI: 10.1631/jzus.2007.B0888.
[13] Sutton SC, Evans LA, Fortner JH, et al. Dog colonoscopy model for predicting human colon absorption[J]. Pharm Res, 2006, 23(7): 1554-1563. DOI:10.1007/s11095-006-0252-3.
[14] Curran PF, Schwartz GF. Na, Cl, and water transport by rat colon[J]. J Gen Physiol, 1960, 43(3):555-571.
[15] Iwata G, Iwai N, Nose H. Segmental difference of water and electrolyte transport in rat colon in vivo[J]. J Basic Clin Physiol Pharmacol, 1997, 8(1-2):13-29.
[16〗 Laforenza U, Cova E, Gastaldi G, et al. Aquaporin-8 is involved in water transport in isolated superficial colonocytes from rat proximal colon[J]. J Nutr, 2005, 135(10): 2329-2336.
[17] Mobasheri A. Comment on: cloning and characterization of porcine aquaporin 1 water channel expressed extensively in the gastrointestinal system[J]. World J Gastroenterol, 2006, 12(27): 4437-4439.
[18] Agre P. The aquaporin water channels[J]. Proc Am Thorac Soc, 2006, 3(1): 5-13.
[19] Silberstein C, Kierbel A, Amodeo G, et al. Functional characterization and localization of AQP3 in the human colon[J]. Braz J Med Biol Res, 1999, 32(10):1303-1313.
[20] Ikarashi N, Kon R, Iizasa T, et al. Inhibition of aquaporin-3 water channel in the colon induces diarrhea[J]. Biol Pharm Bull, 2012, 35(6): 957-962.
[21] Wang JP, Hou XH. Expression of aquaporin 8 in colonic epithelium with diarrhoea-predominant irritable bowel syndrome[J]. Chin Med J, 2007, 120(4): 313-316.
[22] Chen Y, Ma L, Song X, et al. Beneficial effects of fluid resuscitation via the rectum on hemodynamic disorders and multiple organ injuries in an experimental severe acute pancreatitis model[J]. Pancreatology, 2015, 15(6):626-634.
(本文编辑:吕芳萍)
Expression and role of aquaporin in the colon of acute necrotizing pancreatitis rats
ChenYing,XieRongli,WangJinlong,QiMengzhi,YangZhitao,XuZhiwei,FeiJian,MaoEnqiang,ChenErzhen.
DepartmentofEmergency,RuijinHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200025,China
XuZhiwei,Email:xzw10800@163.com
Objective To investigate the expression variation of aquaporin in colon tissues in acute necrotizing pancreatitis (ANP). Methods ANP rat model was induced by the retrograde injection of sodium taurocholate into the biliopancreatic duct. The rats were killed at 4 h, 8 h, 12 h and 24 h after modeling with 6 rats for each time point. The pancreas and colon tissues were harvested for pathological examination. The levels of IL-6, TNF-α mRNA expression and AQR (aquaporin-3, aquaporin-4, aquaporin-8) mRNA expression in proximal and distant colon were detected by RT-PCR. The levels of aquaporin protein in colon were examined by immunohistochemistry. Results After the establishment of ANP SD rat model, the integrity of colonic mucosa was continuously damaged, the structure of epithelial cells was unclear and the colonic villus were broken and destroyed, and inflammatory cell infiltration in submucosa was observed. The pathological score increased with the time of modeling. In 4 h, except that the mRNA levels of AQP-4 in distal colon was not obviously changed, mRNA levels of IL-6 and TNF-α, mRNA and protein expression of AQP-3 and AQP-8 in the proximal and distal colon of ANP rats were significantly elevated compared with shame group (P<0.05). AQP-3 and AQP-8 mRNA in proximal colon of ANP rats reached its peak in 8 h after the establishment and AQP-4 mRNA peaked at 24 h. AQP-3 and AQP-4 mRNA in distant colon of ANP rats reached its peak in 8 h after the establishment and AQP-8 mRNA peaked at 24 h. Protein expression of AQP-3, AQP-4 and AQP-8 in proximal and distant colon was strongest in 12 h and 24 h after the establishment. Conclusions With the progression of the ANP, the expression levels of AQP-3, AQP-4 and AQP-8 in both proximal and distal colons were elevated in various degrees, indicating that the aquaporins may participate in water metabolism of colon during ANP.
Pancreatitis, acute necrotizing; Aquaporin; Colon; Membrane proteins
10.3760/cma.j.issn.1674-1935.2017.03.005
200025 上海,上海交通大学医学院附属瑞金医院急诊科(陈影、王金龙、祁梦之、杨之涛、毛恩强、陈尔真),普通外科(谢荣理、许志伟、费健)
并列第一作者:谢荣理
许志伟,Email: xzw10800@163.com
国家自然科学基金(81600501、81670581、81671901、81571931)
2016-11-21)

