两株氢噬胞菌的萘降解特性分析
孟建宇,李 蘅,唐 凯,宋凯凯,冯福应
(内蒙古农业大学 生命科学学院应用与环境微生物研究所,内蒙古 呼和浩特 010011)
两株氢噬胞菌的萘降解特性分析
孟建宇,李 蘅,唐 凯,宋凯凯,冯福应
(内蒙古农业大学 生命科学学院应用与环境微生物研究所,内蒙古 呼和浩特 010011)
对两株分离自内蒙古乌梁素海的氢噬胞菌X32和X12的培养条件和萘降解特性进行研究。实验结果表明:菌株X32和X12的最适生长pH为7.0,最适生长温度为30~35 ℃,最适盐度w(NaCl)为1%;当初始萘质量浓度为3 500 mg/L时,对数生长期的菌株X32对萘的降解活性可达53.9 nmol/(mg·min),而菌株X12可达34.8 nmol/(mg·min);菌株X32在培养48 h后进入稳定期,60 h时萘降解率达91.43%;菌株X12在培养60 h后进入稳定期,90 h时萘降解率达93.93%。氢噬胞菌X32和X12是两株具有较高应用价值的多环芳烃降解细菌。
氢噬胞菌;多环芳烃;萘降解菌;生长条件;降解特性
多环芳烃(PAHs)广泛分布于大气、水体和土壤中,由其造成的污染给生态环境和人类健康带来很大的潜在危害[1-3]。大量的研究证明,在诸多方法中,生物降解法是去除环境中PAHs 的最主要途径[4]。微生物是PAHs降解最主要和最重要的生物类群,以微生物降解和转化为基础的生物修复技术则是解决PAHs污染问题的重要手段[5-6]。因此,PAHs污染的微生物修复技术一直是国内外科学家们的研究热点[7]。
萘是PAHs中分子量最小且结构最为简单的物质,是进行PAHs降解研究的常用典型化合物[8]。目前,以萘作为唯一碳源分离得到的菌种主要包括产碱杆菌属(Alcaligenes sp.)、伯克氏菌属(Burkholderia sp.)、分支杆菌属(Mycobacterium sp.)、假单胞菌属(Pseudomonas sp.)、劳尔氏菌属(Ralstonia sp.)、红球菌属(Rhodococcus sp.)、鞘氨醇单胞菌属(Sphingomonas sp.)、链霉菌属(Streptomyces sp.)和细杆菌属(Microbacterium sp.)等[9-12]。新的高效降解菌株的筛选和研究相对不足[13-15],因此探寻具有较高降解活性的优良菌种在PAHs的环境治理方面就显得格外重要[16]。而可降解PAHs的氢噬胞菌属(Hydrogenophaga sp.)的菌株发现极少,仅见1株由宋昊等[5]分离到的萘降解菌H. Palleronii LHJ38。
本工作考察了分离自内蒙古乌梁素海的两株氢噬胞菌(Hydrogenophaga sp.)的生长特性和萘降解能力,为合理有效利用微生物去除PAHs有害物质提供了高效稳定的菌种来源。
1 实验部分
1.1 试剂和材料
环己烷(分析纯)、Folin-酚试剂:购自美国Sigma公司;其他试剂均为国产分析纯。
萘降解菌实验菌种:两株氢噬胞菌Hydrogenophaga sp. X32和Hydrogenophaga sp. X12(简称菌株X32和X12),由内蒙古农业大学应用与环境微生物研究所分离自内蒙古自治区巴彦淖尔市乌拉特前旗乌梁素海。
微量元素溶液(TES):FeCl30.05 g,H3BO30.01 g,MnSO4·H2O 0.02 g,CuSO4·5H2O 0.01 g,(NH4)6Mo7O24·4H2O 0.02 g,ZnSO40.01 g,CaCl2·2H2O 0.2 g,乙二胺四乙酸(EDTA) 0.5 g,蒸馏水100 mL,pH 7.0。
菌株活化培养基:MgSO4·7H2O 0.1 g,酵母粉 2 g,K2HPO40.2 g,NaCl 5 g,TES 1 mL,蒸馏水1 000 mL,pH 7.0。
无机盐液体培养基:Na2HPO49.0 g,KH2PO41.5 g,NH4Cl 2.0 g,CoCl2·6H2O 15.3 mg,MgSO4·7H2O 0.2 g,MnSO4·7H2O 3.0 mg,ZnSO4·7H2O 0.2 mg,蒸馏水1 000 mL, pH 7.0。碳源萘的添加:用少量丙酮完全溶解实验所需用量的萘,将其滴加至灭菌后的无机盐液体培养基中,加盖密封。
1.2 生长曲线和萘降解曲线的测定
将菌株X32和X12的单菌落分别接种至多个含30 mL萘初始质量浓度为3 500 mg/L的无机盐液体培养基的锥形瓶中,在30 ℃、pH=7.0、摇床转速180 r/min条件下振荡培养,定时取样,测定培养液在650 nm处的吸光度(A650,此值与菌液浓度成正比,可间接表示菌生长量),计算萘的质量浓度。
1.3 最适生长条件的确定
分别考察菌株X12和X32的最适生长pH,最适生长盐浓度和最适生长温度。每个梯度3个平行样,于摇床转速180 r/min条件下振荡培养,定时取样,测定培养液的A650。
1.4 萘降解活性的测定
将菌株X32和X12的培养液离心分离,收集菌体,制成每毫升含1 mg湿菌体的菌悬液。取200 μL萘质量浓度为3 500 mg/L的萘-丙酮溶液溶于30 mL无机盐液体培养基中,接种100 μL菌悬液,立刻用硅胶密封管口,在最适培养条件下振荡3 h。取4mL培养液,加入0.4 mL浓度为1 mol/L的盐酸,终止反应。用4 mL环己烷萃取培养液中剩余的萘,测定萃取液在275 nm处的吸光度(AM)。同时,用4 mL环己烷对4 mL无机盐液体培养基(作为空白)进行萃取,测定萃取液在275 nm处的吸光度(A0)。菌株X32和X12对萘的降解活性(ξ)定义为单位质量的菌体(以蛋白质含量计)在单位时间内降解萘的物质的量[5],单位为nmol/(mg·min),计算公式见式(1)。
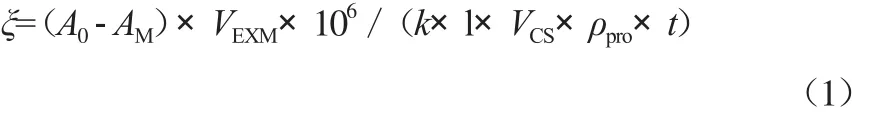
式中,VEXM为环己烷的体积,mL;VCS为菌悬液的体积,mL;k为萘在本实验条件下的摩尔吸光系数,1.260 3×102L/(mol·cm);1为比色皿光程长度,cm;ρpro为菌悬液中蛋白质的质量浓度,mg/ mL;t为反应时间,min。
1.5 分析方法
菌液中蛋白质含量的测定采用Folin-酚试剂法[17]。
萘质量浓度的测定:以环己烷为参比,测定含不同浓度萘的环己烷萃取液在275 nm处的吸光度。在所选择的萘浓度(c,mmol/L)范围(0~0.3mmol/L)内,萘浓度与其相应的吸光度(A)呈直线关系,回归方程为A=0.1260 3c,得出萘在环己烷中的摩尔吸光系数为1.260 3×102L/(mol·cm)。降解液中加入等体积环己烷,剧烈振荡30 min,相分离后用适量环己烷适当稀释萃取液,在275 nm处以环己烷为参比测定其吸光度,计算反应液中萘的浓度,并折算成萘的质量浓度。
2 结果与讨论
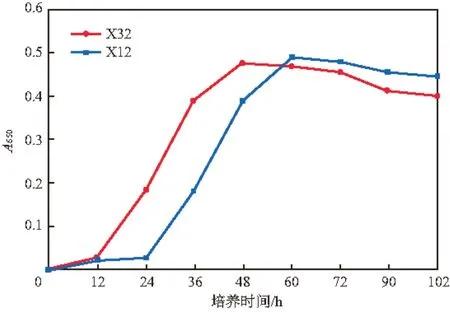
图1 菌株X32和X12的生长曲线
2.1 生长曲线
菌株X32和X12的生长曲线见图1。由图1可见:菌株X32的延滞期为0~12 h,12 h后进入对数生长期,48 h 后进入稳定期;菌株X12的延滞期为0~24h,24 h后进入对数生长期,60 h 后进入稳定期。
2.2 最适生长条件
pH、温度和盐度(w(NaCl),%)对菌株X32和X12生长的影响分别见图2~4。由图2可见,菌株X32和X12在pH 6.5~8.5都可生长,pH 7.0时生长最好,为最适生长pH,与已报道的多数萘降解菌[10,15-16,18-20]相同,但与菌株H. Palleronii LHJ38(最适pH 6.6)[5]有所不同。由图3可见,30~35 ℃为两株菌的最适生长温度范围,这与多种萘降解菌[15-16,18,20]类似,但也与菌株H. Palleronii LHJ38(最适温度28 ℃)[5]有所不同。由图4可见:两菌株在盐度小于2%时,生长良好;盐度为1 %时,生长最好,有一定的耐盐性;当盐度达到3%时,生长受到极大的抑制。
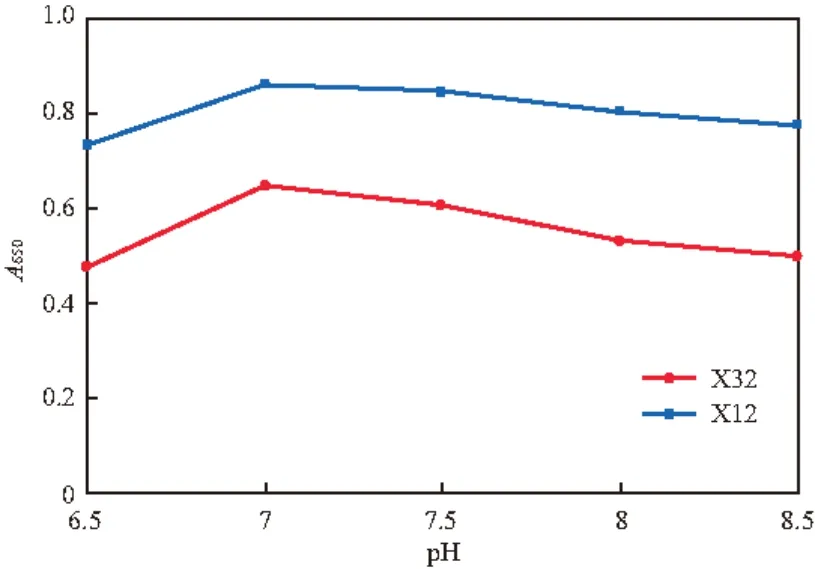
图2 pH对菌株X32和X12生长的影响
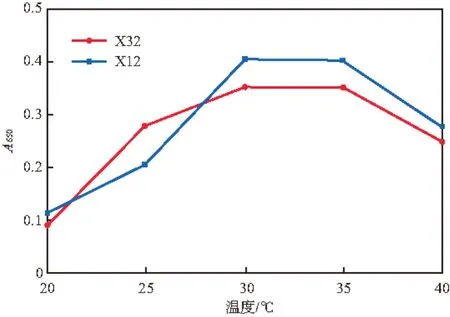
图3 温度对菌株X32和X12生长的影响
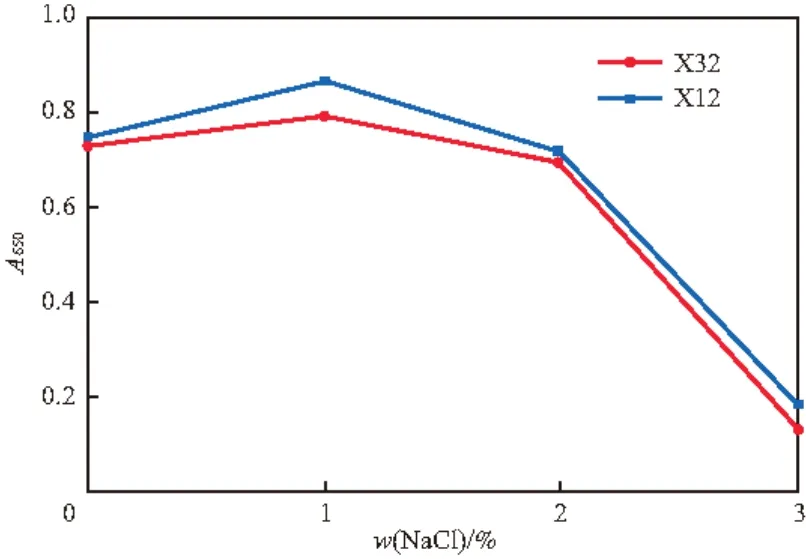
图4 盐度对菌株X32和X12生长的影响
2.3 萘降解曲线及降解活性
在最适条件下,菌株X32和X12对萘的降解曲线见图5。
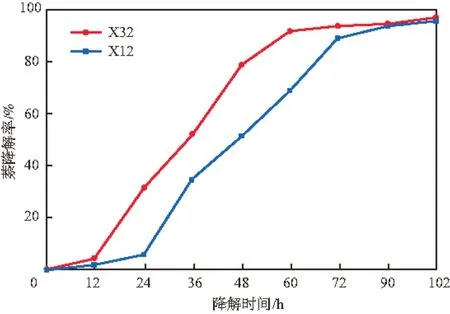
图5 菌株X32和X12对萘的降解曲线
由图5可见:两菌在延滞期的萘降解率均极低,而当细菌进入对数生长期时,即细菌生长速率最快时,萘降解率快速增加;进入稳定期后,两菌的降解曲线出现拐点,菌株X32在培养60 h时萘降解率达91.43%,随后增长趋缓;菌株X12在培养90 h时萘降解率达93.93%,随后增长趋缓。经计算,菌株X32在对数生长期(培养12~48 h)时对萘的降解活性达53.9 nmol/(mg·min),高于菌株H. PalleroniiLHJ38的萘降解活性(47.3 nmol/(mg·min))[5],而菌株X12在对数生长期(培养24~60 h)时对萘的降解活性达34.8 nmol/(mg·min)。
3 结论
a)氢噬胞菌Hydrogenophaga sp. X32的生长延滞期为0~12 h,12~48 h为对数生长期,48 h后进入稳定期;氢噬胞菌Hydrogenophaga sp. X12的生长延滞期为0~24 h,24~60 h为对数生长期,60 h后进入稳定期。
b)菌株X32和菌株X12的最适培养条件为:pH 7.0,生长温度30~35 ℃,盐度1%。
c)在对数生长期时,菌株X32和X12对初始质量浓度为3 500 mg/L的萘的降解活性分别达53.9 nmol/(mg · min)和 34.8 nmol/(mg· min);进入稳定期后,菌株X32在培养60 h时萘降解率达91.43%,菌株X12在培养90 h时萘降解率达93.93%。因此,菌株X32和X12是两株具有很高多环芳烃(PAHs)污染治理应用价值的细菌。对其降解性能和降解机制的深入研究,可为PAHs的微生物修复提供新的可行性途径。
[1] Bonfá M R L,Grossman M J,Mellado E,et al. Biodegradation of aromatic hydrocarbons by Haloarchaea and their use for the reduction of the chemical oxygen demand of hypersaline petroleum produced water[J]. Chemosphere,2011,84(11):1671 - 1676.
[2] 徐胜,王慧,陈玮,等. 土壤中多环芳烃污染对植物生理生态的影响[J]. 应用生态学报,2013,24(5):1284 - 1290.
[3] 童玲,陈伟胜,郑西来,等. 石油污染土壤修复技术的进展[J]. 化工环保,2012,32(4):311 - 315.
[4] Patel V,Patel J,Madamwar D. Biodegradation of phenanthrene in bioaugmented microcosm by consortium ASP developed from coastal sediment of Alang-Sosiya ship breaking yard[J]. Mar Pollut Bull,2013,74(1):199 - 207.
[5] 宋昊,邱森,章俭,等. 高活性萘降解细菌Hydrogenophaga Palleronii LHJ38的研究[J]. 化工环保,2006,26(2):87 - 90.
[6] 姜岩,杨颖,张贤明. 典型多环芳烃生物降解及转化机制的研究进展[J]. 石油学报(石油加工),2014,30(6):1137 - 1149.
[7] 唐婷婷,金卫根. 多环芳烃微生物降解机理研究进展[J]. 土壤,2010,42(6):876 - 881.
[8] 刘文超,吴彬彬,李晓森,等. 一株筛自柴油污染土壤的铜绿假单胞菌对萘的降解特性研究[J]. 环境科学,2015,36(2):712 - 718.
[9] Lin Meng,Hu Xiaoke,Chen Weiwei,et al. Biodegradation of phenanthrene by Pseudomonas sp. BZ-3,isolated from crude oil contaminated soil [J]. Int Biodeter Biodegrad,2014,94:176 - 181.
[10] 汪如婷,雒晓芳,田丹妮,等. 铜绿假单胞茵对萘和菲降解特性研究[J]. 中国酿造,2015,34(10):82 - 85.
[11] 高闯,张全,王继锋,等. 萘降解菌的筛选及其对多环芳烃的降解[J]. 化工环保,2015,35(1):17 - 20.
[12] 王涛,蓝慧,田云,等. 多环芳烃的微生物降解机制研究进展[J]. 化学与生物工程,2016,33(2):8 - 14.
[13] 张子间,刘勇弟,孟庆梅,等. 微生物降解石油烃污染物的研究进展[J]. 化工环保,2009,29(3):193 - 197.
[14] 齐义彬,李红,曹美娜,等. 一株多环芳烃降解菌吉2及其降解能力[J]. 化工学报,2015,66(3):1072 - 1079.
[15] 黄兴如,张彩文,张瑞杰,等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报,2016,43(5):965 - 973.
[16] 杨轩,张威,李师翁,等. 多环芳烃降解菌的分离鉴定及其生理特性研究[J]. 环境科学学报,2012,32(5):1033 - 1040.
[17] 刘箭. 生物化学实验教程[M]. 北京:科学出版社,2004:21 - 22.
[18] 史延华,任磊,贾阳,等. 施氏假单胞菌YC-YH1的萘降解特性及产物分析[J]. 微生物学通报,2015,42(10):1866 - 1876.
[19] 徐中阳,陈雯莉. 萘降解菌的分离、鉴定及降解途径[J]. 华中农业大学学报,2015,34(1):59 - 65.
[20] Xu Peng,Ma Wencheng,Han Hongjun,et al. Isolation of a naphthalene-degrading strain from activated sludge and bioaugmentation with it in a MBR treating coal gasification wastewater [J]. Bull Environ Contam Toxicol,2014,94(3):358 - 364.
(编辑 叶晶菁)
Analysis on naphthalene degradation characteristics of two Hydrogenophaga sp. strains
Meng Jianyu,Li Heng,Tang Kai,Song Kaikai,Feng Fuying
(Institution of Applied and Environmental Microbiology,College of Life Sciences,Inner Mongolia Agricultural University,Hohhot Inner Mongolia 010011,China)
The culture conditions and naphthalene degradation characteristics of Hydrogenophaga sp. X32 and Hydrogenophaga sp. X12,which were isolated from Wuliangsuhai Lake of Inner Mongolia,were studied. The experimental results showed that:The optimal growth pH value was 7.0,the optimal growth temperature was 30-35℃ and the optimal salt concentration was 1%;When the initial naphthalene mass concentration was 3 500 mg/L,the naphthalene-degrading activity of X32 in logarithmic growth phase was 53.9 nmol/(mg·min),while that of X12 was 34.8 nmol/(mg·min);After 48 h of cultivation,the strain X32 was in steady growth phase,and the naphthalene degradation rate was 91.43% in 60 h;After 60 h of cultivation,the strain X12 was in steady growth phase,and the naphthalene degradation rate was 93.93% in 90 h. Hydrogenophaga sp. X32 and Hydrogenophaga sp. X12 were two PAHs-degrading bacterial strains with high application value.
Hydrogenophaga sp.;polycyclic aromatic hydrocarbon;naphthalene-degrading bacteria;growth condition;degradation characteristics
X172
A
1006-1878(2017)03-0300-04
10.3969/j.issn.1006-1878.2017.03.008
2016 - 10 - 08;
2017 - 02 - 17。
孟建宇(1977—),男,内蒙古自治区乌兰察布市人,硕士,副教授,电话 0471 - 6508315,电邮 meng_jianyu@ imau.edu.cn。联系人:李蘅,电话 0471 - 6508315,电邮liheng0123@sina.com。
国家自然科学基金项目 (31460002,31560030);内蒙古自治区自然科学基金项目 (2015MS0355);内蒙古自治区高等学校科学研究项目 (NJZY14084)。

