p-STAT3通过上皮间质转化影响结肠癌的转移性研究*
韩聪孙保存赵秀兰张艳辉古强刘芳赵楠吴丽丽
·基础研究·
p-STAT3通过上皮间质转化影响结肠癌的转移性研究*
韩聪①孙保存①②③赵秀兰①③张艳辉②古强①③刘芳①赵楠①吴丽丽③
目的:研究p-STAT3的活化在结肠癌中的表达与Snail、MMP2的相关性,及其在离体细胞实验中激活受抑后对结肠癌细胞迁移能力的影响并探讨其机制。方法:免疫组织化学染色检测p-STAT3与Snail、MMP2的表达及其相关性,分析三者与TNM分期、远处转移、淋巴结转移及分化程度之间的关系;MTT实验筛选AG490对增殖无影响的浓度和时间,并用该浓度和时间进行后续实验;采用Western blot法检测AG490抑制p-STAT3活化后STAT3、Snail、MMP2蛋白表达情况;划痕实验观察p-STAT3活化受抑后,结肠癌细胞迁移情况。结果:免疫组织化学染色结果表明,p-STAT3的表达与Snail、MMP2均存在相关性,且均与淋巴结转移相关(P<0.05)。在两个结肠癌细胞系中,通过MTT实验,选出10μM作为AG490的最佳作用浓度,并采用该浓度进行后续实验。AG490抑制p-STAT3活化后Snail、MMP2表达明显下降,而STAT3总蛋白表达无明显变化。且当AG490抑制p-STAT3活化后,细胞的迁移能力明显下降。结论:p-STAT3可以通过上皮间质转化(epithelial-mesenchymal transition,EMT)促进结肠癌的转移。
结肠癌 上皮间质转化 p-STAT3 Snai l MMP2 AG490
结肠癌是常见的消化系统恶性肿瘤,严重危害人类生命健康,肿瘤的快速增殖、侵袭和转移是导致患者预后较差的原因。上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤的发生、发展以及侵袭和转移中发挥重要作用。目前较为公认的调控EMT的转录因子主要包括Snail[1]、ZEB1[2]、Twist[3]等,近年来研究发现,信号转录因子和转录激活子3(signal transducer and activatorof transcription 3,STAT3)信号的异常激活也与肿瘤的EMT相关[4]。EMT的发生需要降解细胞外基质,金属基质蛋白酶(matrixmetalloproteinase,MMPs)是降解细胞外基质的关键成员[5]。本研究采用免疫组织化学染色法检测结肠癌组织中p-STAT3与Snail及MMP家族重要成员MMP2蛋白的表达和相关性,分析三者与TNM分期、远处转移、淋巴结转移以及分化程度的关系,并利用细胞学实验进一步阐述阻断p-STAT3活化抑制结肠癌细胞转移的相关机制。
1 材料与方法
1.1 材料
1.1.1 组织标本选取2002年3月至2005年12月于天津医科大学总医院行手术切除,病理诊断为结肠癌且随访资料完整的患者组织标本65例。其中男性28例,女性37例,年龄为28~83岁;Dukes分期A/ B期26例,C/D期39例;淋巴结转移31例,无淋巴结转移34例;远处转移37例,无远处转移28例;TNM分期Ⅰ/Ⅱ期25例,Ⅲ/Ⅳ期40例;高分化18例,中分化27例,低分化20例。所有病例均为手术标本且患者未接受放、化疗。本实验经过医院伦理委员会审核通过,并经全部患者及其家属知情同意。
1.1.2 细胞系人结肠癌细胞株HCT116、HT29细胞系购自中国医学科学院基础医学院细胞资源中心。
1.1.3 实验试剂IMDM(ISCOVE'smodified DMEM)、DMEM/F12(Dulbecco'smodified Eagle'smedium:nutrient mixture F-12)培养基及MTT试剂盒均购自南京凯基生物公司,胎牛血清FBS购自美国Gibco公司。AG490购自美国Selleck公司。兔抗人p-STAT3(Tyr705)抗体购自美国CST公司,鼠抗人STAT3抗体购自美国SantaCruz公司;兔抗人Snail抗体购自美国Abcam公司,兔抗人MMP2抗体购自美国ProteintechTM公司。兔抗人β-actin抗体、山羊抗兔IgG抗体均购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 免疫组织化学染色结肠癌组织石蜡标本连续切片脱蜡水化,使用3%过氧化氢灭活内源性过氧化物酶,微波修复,于室温下血清封闭,一抗置于4℃冰箱过夜,次日常温下孵育二抗,二氨基联苯胺(DAB)显色,苏木素复染细胞核,中性树胶封片。阴性对照一抗用磷酸盐缓冲盐溶液(PBS)代替。采用Mattern积分法[6]判断染色结果,阳性细胞百分率:每例标本随机选取10个代表性的高倍视野(×400)分别计数100个肿瘤细胞的平均值,<10%为0分,10%~25%为1分,25%~50%为2分,50%~100%为3分。染色强度:阴性为0分,淡黄色为1分,深黄色为2分,棕黄色为3分。阳性细胞百分率得分和染色强度得分相加,结果>3为阳性,≤3为阴性。
1.2.2 细胞培养本实验中所有细胞均按照常规贴壁细胞培养模式进行培养,HCT116细胞系培养基为90%IMDM+10%胎牛血清(FBS)+1%双抗(100 U/mL青霉素、100 U/mL链霉素),HT29细胞系培养基为95%DMEM-F12+5%胎牛血清+1%双抗(100 U/mL青霉素、100U/mL链霉素),于37℃、5%CO2、恒温恒湿培养箱中培养。待细胞融合约80%时,胰酶消化传代以保持细胞增殖活力。
1.2.3 MTT实验MTT法检测AG490对HCT116、HT29细胞生长的影响。常规培养HCT116、HT29细胞进入对数期后,配制成5×104/mL的细胞悬液,取3块96孔板,每孔加入100μL细胞悬液,实验组分别加入终浓度为10、20、30、40、50μM的AG490培养液,各组溶液中二甲基亚砜(DMSO)体积分数不超过0.1%;对照组加入等量DMSO溶液,空白对照组仅加入完全培养基,不加细胞悬液。实验组和对照组均设5个复孔,置于37℃、5%CO2饱和湿度的细胞培养箱内分别培养24、48、72 h后,分别加入MTT 50μL继续培养4 h,吸去孔内液体,加入150μLDMSO,置于摇床上低速振荡5min,使紫色结晶物充分溶解,于酶标仪490 nm波长处检测各孔的吸光度(A)值。实验组:HCT116和HT29细胞分别用AG490处理(HCT116-AG490组、HT29-AG490组);对照组:HCT116和HT29细胞加等量的DMSO处理(HCT116组、HT29组)。选出不影响细胞增殖的最适浓度及最佳作用时间进行后续实验。
1.2.4 Western blot检测细胞裂解液RIPA-SDS裂解细胞,提取细胞总蛋白,用12%聚丙烯酰胺凝胶80 V恒压电泳2 h,之后250mA恒流1.5 h将目的蛋白转至PVDF膜,5%脱脂奶粉室温封闭1 h,加入相应一抗,4℃孵育过夜;次日室温孵育1 h,TBST洗膜3次,加入相应二抗室温孵育2 h。TBST洗膜3次,发光液A和B以1:1比例混匀后显影。用Image-J测量每个条带的灰度值,以β-actin为内参,根据目的条带与内参条带灰度值比值表示目的蛋白相对表达量。
1.2.5 划痕实验将对数增长期的HCT116、HT29细胞接种于六孔板,贴壁后,实验组给予10μM AG490处理,对照组加等量的DMSO,作用48 h后,用100μL移液枪头在各孔中央细胞表面垂直划痕,PBS冲洗脱落的细胞,显微镜下拍照记为0,此后24、48 h分别拍照。观察细胞迁移变化情况并测量迁移距离,计算迁移率。
1.2.6 细胞形态观察AG490作用细胞48 h后,倒置显微镜下观察细胞形态,并比较对照组和实验组细胞形态变化。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析,两因素之间相关性采用Spearman相关性分析。符合正态分布的计量资料采用±s表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,不同时间点两两比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结果
2.1 p-STAT3、Snail、MMP2在结肠癌中的表达及其与TNM分期、淋巴结转移、远处转移和分化程度的关系
p-STAT3的阳性染色主要表达于癌细胞核,少量表达于胞浆,而癌组织间质呈现阴性,Snail的阳性染色主要定位于癌细胞核,MMP2的阳性染色主要定位于癌细胞胞浆(图1)。p-STAT3、Snail、MMP2的阳性表达率分别是61.5%、56.9%、53.8%。在65例结肠癌组织中,p-STAT3表达与Snail、MMP2表达存在显著相关性(表1),且p-STAT3、Snail、MMP2与TNM分期、淋巴结转移和远处转移均存在显著相关性,而与肿瘤的分化程度均无相关(表2)。

图1 p-STAT3、Snail、MMP2在结肠癌组织中的阳性和阴性表达(IHC×200)Figure 1 Positive and negative expression ofp-STAT3,Snail,and MMP2 in colorectalcancer tissues(IHC×200)

表1 p-STAT3与Snai l、MMP2的相关性(n=65)Table 1 Correlation among p-STAT3 and SnailaswellasMMP2(n=65)
2.2 不同浓度的AG490对两种结直肠癌细胞增殖的抑制作用
MTT实验结果显示,AG490对HCT116细胞、HT29细胞均具有抑制增殖的作用,且随AG490的浓度增大和作用时间的延长,抑制作用增强。10μM AG490处理24、48 h对细胞生长的抑制作用与对照组比较差异无统计学意义(P>0.05)。且48 h的作用时间更长,故选择10μM的AG490作为后续实验的最适浓度,48 h为最佳作用时间(图2)。
2.3 AG490对HCT116、HT29细胞p-STAT3、STAT3、Snail、MMP-2蛋白表达的影响
AG490处理HCT116、HT29细胞后,与对照组相比p-STAT3、Snail及MMP-2蛋白表达量降低,差异具有统计学意义(P<0.05),而与STAT3蛋白表达量的比较差异无统计学意义(P>0.05)。(图3)。
2.4 AG490对HCT116、HT29细胞迁移能力的影响
划痕实验可以用于评价AG490对HCT116细胞和HT29细胞迁移能力的影响。结果显示,与对照组相比,HCT116-AG490实验组迁移率明显低于HCT116组,HT29-AG490实验组迁移率明显低于HT29组,实验组迁移能力明显减弱,差异具有统计学意义(P<0.05,图4)。
2.5 AG490对结肠癌细胞形态的影响
与对照组相比,加入AG490的HCT116细胞和HT29细胞,细胞形态均发生了不同程度缩短、变粗(图5)。

表2 p-STAT3、Snai l、MMP2与TNM分期、淋巴结转移、远处转移及分化程度的相关性(n=65)Table 2 Correlation ofp-STAT3,Snailand MMP2w ith TNM stage,lymph nodemetastasis,distantmetastasis,and differentiation(n=65)
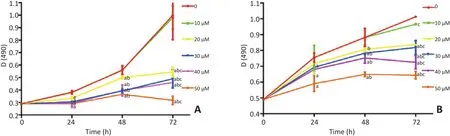
图2 各浓度AG490对结肠癌细胞的生长抑制作用Figure 2 Effectsofdifferent AG490 concentrationson colorectalcancer celllines

图3 Western blot检测AG490作用的结肠癌细胞p-STAT3,STAT3,Snail,MMP2的表达变化Figure 3 Changes in the protein expression ofp-STAT3,STAT3,Snail,and MMP2 in colorectalcancer cellsafter AG490 treatment

图4 AG490抑制p-STAT3活化对结肠癌细胞迁移能力的影响Figure 4 Effects of AG490 treatment on the m igration capacity of colorectalcell lines
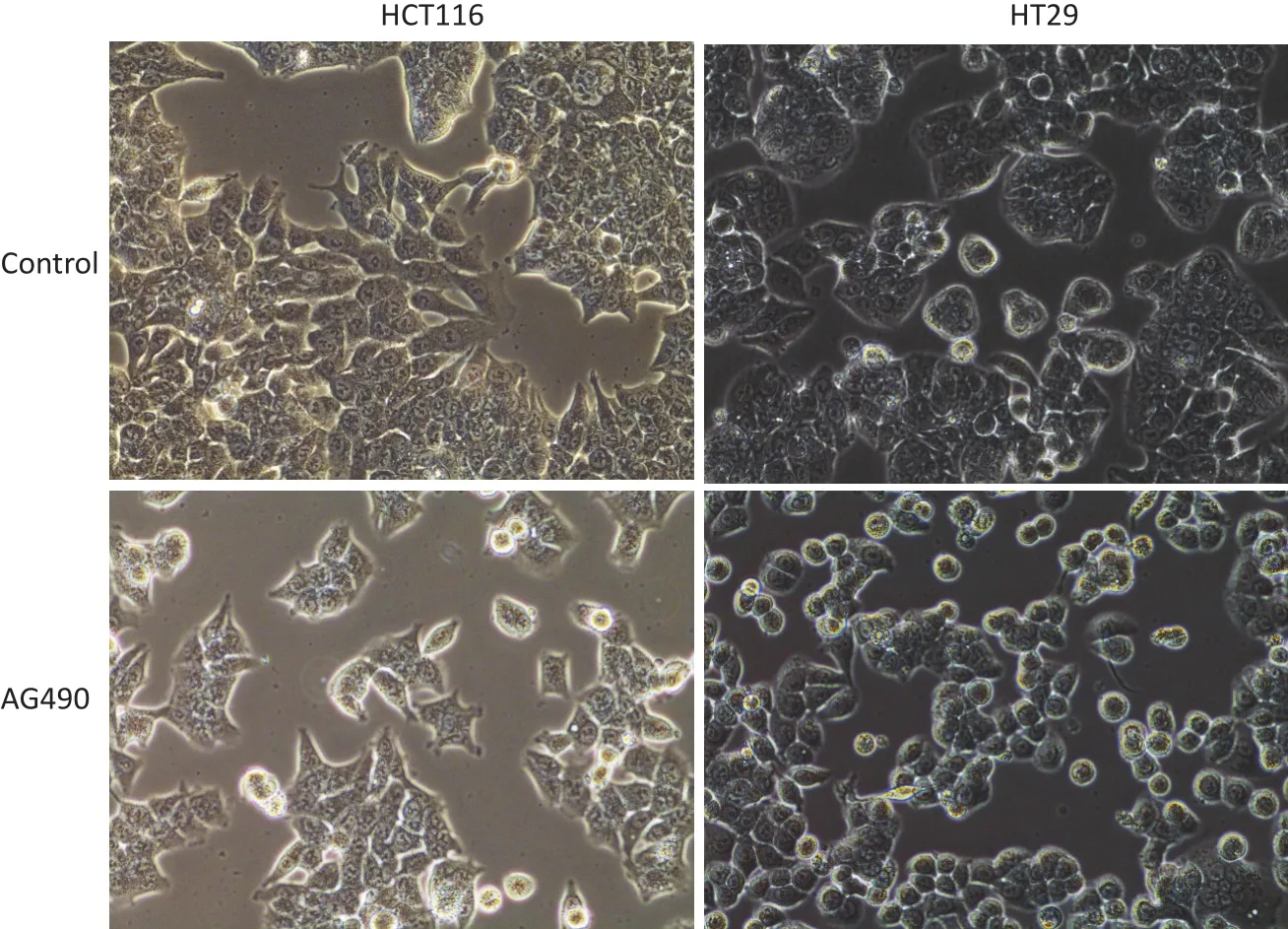
▶图5 HCT116、HCT116-AG490、HT29、HT29-AG490细胞形态学变化(镜像×400)Figure 5 Significant changes in HCT116-control, HCT116-AG490,HT29-control,and HT29-AG490 cells (image×400)
3 讨论
结直肠癌是全球最常见的恶性肿瘤之一,在中国,其发病率和死亡率分别居恶性肿瘤的第3位和第5位,并呈上升趋势[7],严重威胁人类生命健康。其高发病率和死亡率给社会带来了巨大的经济负担。
JAK/STAT信号途径广泛参与人体生理和病理活动,是一条重要的细胞信号转导通路。其在乳腺癌[8]、胃癌[9]、皮肤癌[10]等多种肿瘤中存在异常活化状态。有研究表明,STAT3组成型活化即p-STAT3的异常活化与肿瘤的侵袭转移密切相关[11]。并且JAK/ STAT信号通路的异常活化能够调节多种肿瘤的增殖、凋亡[12]和血管生成[13]及血管生成拟态形成[9]等多种生物学行为。有研究表明,在结肠癌中也存在着p-STAT3的异常活化,并且可能通过影响HIF-1α的转录来影响结肠癌的发生[14]。本研究的免疫组织化学实验结果也同样证明,p-STAT3在结肠癌中存在高表达的现象,且p-STAT3与转录因子Snail、金属基质蛋白酶MMP2的表达存在显著相关性(P<0.05)。并且三者均和结肠癌的淋巴结转移及远外转移相关,差异具有统计学意义(P<0.05)。
EMT是恶性肿瘤细胞获得迁移侵袭能力的一种重要方式,是指上皮来源的肿瘤细胞上皮样表型向间质样细胞表型转变,其重要一环是细胞外基质的降解,而MMP2是导致基质降解,肿瘤细胞获得迁移侵袭能力的一项重要因素[15]。Snail是最早发现的EMT转录因子,它的异常高表达可以诱导EMT发生,促进肿瘤的迁移侵袭[1]。
AG490作为一种JAK激酶竞争性抑制剂,可以有效地抑制STAT3活化[16]。有研究表明,AG490能够抑制肝癌细胞STAT3的活化和Snail的表达来抑制其侵袭转移[17]。在胰腺癌中也有相似的发现,AG490可以抑制胰腺癌细胞的STAT3活化和VEGF表达来抑制其侵袭转移[18]。本研究的Western blot检测结果也有相似的发现,AG490作用于结肠癌细胞HCT116和HT29细胞系时,p-STAT3活化减少,Snail和MMP2的表达下降,通过划痕实验发现细胞的迁移能力下降。同时通过观察细胞形态,AG490使细胞缩短、变粗,抑制了EMT。Western blot检测、划痕实验及细胞形态学观察结果说明AG490可以抑制p-STAT3活化,并通过降低Snail和MMP2的表达来抑制结肠癌的侵袭迁移。
本研究表明,p-STAT3与结肠癌的淋巴结转移及远处转移密切相关。在结肠癌组织和离体细胞培养Western blot检测均发现p-STAT3的活化与Snail和MMP2表达有关。P-STAT3的过度激活可能通过影响Snail和MMP2的表达,诱导EMT发生,进而促进肿瘤的转移。抑制p-STAT3的过度激活可能为结肠癌的诊断和治疗提供新的思路和启示。
[1]Merikallio H,Turpeenniem i-Hujanen T,PääkköP,et al.Snail promotes an invasive phenotype in lung carcinoma[J].Respir Res, 2012,13:104.
[2]Cao LY,Yang J,Fu XG,etal.The M icroRNAm iR-205 inhibitsepithelial-messenchymal transition in HK-2 cells by down-regulating ZEB1 and ZEB2 expressions[J].Nan Fang YiKe Da Xue Xue Bao,2016,36 (12):1700-1705.
[3]LiW,Wang Z,Zha L,et al.HMGA2 regulates epithelial-mesenchymal transition and the acquisition of tumor stem cell properties through TWIST1 in gastric cancer[J].Oncol Rep,2017,37(1):185-192.
[4]HajimoradiM,Mohammad HZ,Ebrahim iM,etal.STAT3 isoveractivated in gastric cancer stem-like cells[J].Cell J,2016,17(4):617-628.
[5]Mao W,Sun Y,Zhang H,et al.A combinedmodality of carboplatin and photodynam ic therapy suppresses epithelial-mesenchymal transition and matrix metalloproteinase-2(MMP-2)/MMP-9 expression in HEp-2 human laryngeal cancer cells via ROS-mediated inhibition of MEK/ERK signalling pathway[J].Lasers Med Sci,2016, 31(8):1697-1705.
[6]BittnerM,Meltzer P,Chen Y,etal.Molecular classification of cutaneous malignant melanoma by gene expression profiling[J].Nature,2000,406(6795):536-540.
[7]Lv Q,Xing SY,Zhao ZH,etal.Research and prospectof colon cancer [J].Chin JLabor Diag,2009,(8):1134-1137.[吕强,邢沈阳,赵志辉,等.结肠癌的研究现状及展望[J].中国实验诊断学,2009,(8):1134-1137.]
[8]Aleskandarany MA,AgarwalD,Negm OH,et al.The prognostic significance of STAT3 in invasive breast cancer:analysisof protein and mRNA expressions in large cohorts[J].Breast Cancer Res Treat, 2016,156(1):9-20.
[9]Song YY,Sun LD,Liu ML,etal.STAT3,p-STAT3 and HIF-1αare associated w ith vasculogenic m im icry and impact on survival in gastric adenocarcinoma[J].Oncol Lett,2014,8(1):431-437.
[10]Suiqing C,Min Z,Lirong C.Overexpression of phosphorylated-STAT3 correlated w ith the invasion and metastasis of cutaneous squamouscellcarcinoma[J].JDermatol,2005,32(5):354-360.
[11]Cui Y,Li YY,Li J,et al.STAT3 regulates hypoxia-induced epithelial mesenchymal transition in oesophageal squamous cell cancer[J]. OncolRep,2016,36(1):108-116.
[12]LiX,Bhaduri-McIntosh S.A central role for STAT3 in gammaherpesvirus-Life cycle and-diseases[J].FrontM icrobiol,2016,7:1052.
[13]Haura EB,Turkson J,Jove R.Mechanisms of disease:Insights into the emerging role of signal transducers and activators of transcription in cancer[J].NatClin PractOncol,2005,2(6):315-324.
[14]Zhang XQ,ShiYL,Jia XY,etal.Expression and clinicalsignificance of p-STAT3 and hypoxia inducible factor in colon cancer[J].Chin J Geront,2014,(15):4121-4123.[张晓芹,史迎莉,贾小云,等.p-STAT3与缺氧诱导因子在结肠癌组织中的表达及其临床意义[J].中国老年学杂志,2014,(15):4121-4123.]
[15]Liu J,Ben QW,Yao WY,et al.BMP2 induces PANC-1 cell invasion by MMP-2 overexpression through ROSand ERK[J].Front Biosci(Landmark Ed),2012,17:2541-2549.
[16]LiCH,Zhao JX,Sun L,et al.AG490 inhibits NFATc1 expression and STAT3 activation during RANKL induced osteoclastogenesis[J].Biochem BiophysResCommun,2013,435(4):533-539.
[17]Zhou JJ,Meng Z,He XY,et al.Hepatitis Cvirus core protein increases Snailexpression and induces epithelial-mesenchymal transition through the signaltransducerand activatorof transcription 3 pathway in hepatoma cells[J].HepatolRes,2017,47(6):574-583.
[18]Yang G,Qiu ZJ,Zhang F,et al.Effect sofactivation and inhibition of Stat3 signaling pathway on invasion of human pancreatic cancer cell[J].Tumor,2009,(7):645-649.[杨光,裘正军,张放,等.激活和抑制Stat3信号途径对胰腺癌细胞侵袭能力的影响[J].肿瘤,2009, (7):645-649.]
(2017-01-23收稿)
(2017-05-10修回)
(编辑:武斌校对:孙喜佳)
p-STAT3 promotes colorectal cancer metastasis by inducing epithelial-mesenchymal transition
Cong HAN1,Baocun SUN1,2,3,Xiulan ZHAO1,3,YanhuiZHANG2,Qiang GU1,3,Fang LIU1,Nan ZHAO1,Lili WU3
1Departmentof Pathology,Tianjin MedicalUniversity,Tianjin 300070,China;2Departmentof Pathology,NationalClinicalResearch Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's ClinicalResearch Center for Cancer;Tianjin 300060, China;3Departmentof Pathology,Tianjin Medical University GeneralHospital,Tianjin 300052,China
Baocun Sun;E-mail:sunbaocun@aliyun.com
Objective:To determ ine p-STAT3 expression in 65 casesof colorectalcancerand its correlationw ith Snailand MMP2 and to explore themechanism ofp-STAT3 activation in colorectalcancer cellsby inhibiting itsactivation in vitro.Methods:Immunohistochemical techniquewasadopted to exam ine the expression levelsof p-STAT3,Snail,and MMP2.MTTassaywasused to explore the effects of diluting AG490,which doesnotaffect cellproliferation.Western blotwasused to exam ine the expression levelsof p-STAT3,STAT3, Snail,and MMP2.Wound healing assaywasemployed to evaluate them igration of colorectalcancer cells.Results:p-STAT3 expression was significantly correlated w ith Snail and MMP2 expression.Moreover,p-STAT3 expression was significantly correlated w ith TNM stage,lymph nodemetastasis,and distantmetastasis in colorectal cancer tissues(P<0.05)but not w ith tumor differentiation.Treatmentw ith 10μM AG490 for 48 h did not significantly affect cellproliferation in the controland experimentalgroups(P>0.05).STAT3 expression wasnot significantly changed when p-STAT3 expression was inhibited by AG490.Meanwhile,the expression levelsof Snail and MMP2 were down-regulated,and them igration ability of colorectal cancer cellswas significantly reduced.Conclusion:p-STAT3 promotescolorectalcancermetastasisby regulating the processofepithelial-mesenchymaltransition.
colorectalcancer,epithelial-mesenchymaltransition,p-STAT3,Snail,MMP2,AG490
10.3969/j.issn.1000-8179.2017.10.079

①天津医科大学病理学教研室(天津市300070);②天津医科大学肿瘤医院病理科;③天津医科大学总医院病理科
*本文课题受国家自然科学基金面上项目(编号:81572872)和国家自然科学基金重点项目(编号:81230050)资助
孙保存sunbaocun@aliyun.com
This work was supported by the NationalNaturalScience Foundation ofChina(No.81572872)and the Key Projectof the NationalNaturalScience Foundation ofChina(No.81230050)
韩聪专业方向为肿瘤病理学。
E-mail:13516296540@163.com

