黏着斑激酶在骨肉瘤中的表达及临床意义*
任可姚楠陆军施鑫吴苏稼马捷王宸
·临床研究与应用·
黏着斑激酶在骨肉瘤中的表达及临床意义*
任可①姚楠②陆军①施鑫③吴苏稼③马捷④王宸①
目的:探讨骨肉瘤组织中黏着斑激酶(focaladhesion kinase,FAK)的表达情况及其与临床病理特征和预后的关系。方法:收集1999年12月至2011年l2月东南大学附属中大医院和南京军区南京总医院收治的经手术病理确诊的骨肉瘤标本113例,免疫组织化学检测病灶中FAK表达量及磷酸化水平,并通过RNA干扰观察改变FAK的表达与激活水平对骨肉瘤细胞增殖、凋亡、迁移及侵袭活动的影响。结果:70例标本(61.95%)FAK过表达,其中42例(37.17%)pFAK阳性。FAK表达谱与性别、年龄、AJCCⅡA/ⅡB期、病灶部位、术式、术前化疗效果等临床病理参数均无显著相关性。生存分析显示FAK的过表达及其磷酸化显著缩短了总生存时间(overallsurvival,OS)和无转移生存时间(metastasis-free survival,mFS),其与术前化疗效果是预测骨肉瘤生存时间和转移早晚的两个独立预后因素。细胞学实验则显示FAK的表达和激活可以促进骨肉瘤细胞的增殖、迁移及侵袭活动,并能抑制凋亡。结论:FAK的过表达及其磷酸化与骨肉瘤恶性程度密切相关,可为生存期及预后判断提供一定参考。
骨肉瘤 黏着斑激酶 预后 迁移 侵袭
骨肉瘤是青少年最常见的原发性恶性骨肿瘤,其侵袭性强,肺转移早,预后差[1-2]。20世纪70年代出现的新辅助化疗是骨肉瘤治疗中里程碑式的进步,但不少患者仍会出现原发或继发性化疗耐药并发生肺转移,而这正是骨肉瘤治疗失败的主要原因[3-4]。所以,探查骨肉瘤的发生发展机制并寻找传统治疗之外的新靶点具有重要意义。
黏着斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸激酶,位于细胞和细胞外基质结合部位整合素(integrin)构成的灶性黏附复合体(focalad⁃hesion complex)上,调控多种细胞活动。397位酪氨酸残基(Tyr397)是FAK主要的自身磷酸化部位,Tyr397磷酸化的FAK可与多种含SH2或SH3结构域的蛋白分子结合,通过整合素、FAK/Ras/MAPK、FAK/ Src/pl30CAS/JNK、FAK/PI3K、FAK-ROCK/RhoA等多条信号通路广泛参与多种细胞学行为[5-7]。
近年来发现FAK与肿瘤细胞的黏附、迁移、侵袭、增殖及凋亡密切相关,并参与肿瘤的生长、复发、转移、血管新生及血管生成拟态[5]。研究显示,FAK在大肠癌、食管癌、子宫癌、乳腺癌和甲状腺癌等恶性肿瘤中表达明显增高并且是疾病的独立预后因素[8-9]。因此,FAK可能作为临床判断肿瘤侵袭及预后的标志,以FAK及其介导的信号转导通路为靶点的靶向治疗也可能成为肿瘤治疗的新方向。
然而,对于骨肉瘤中FAK的功能及其与侵袭、转移和新血管形成等相关性的研究则鲜见报道,尤其缺少大样本临床研究。本研究拟观察FAK表达水平与临床病理特征之间的关系,分析病灶中FAK的表达和磷酸化对骨肉瘤患者生存时间及侵袭转移的影响,初步探讨FAK在骨肉瘤发生、发展中的作用及其与患者预后的关系。
1 材料与方法
1.1 材料
1.1.1 一般资料收集1999年12月至2011年l2月东南大学附属中大医院和南京军区南京总医院收治的经手术病理确诊的113例原发性骨肉瘤患者的存档石蜡标本。纳入标准:1)原发灶位于四肢骨骼;2)美国癌症联合会(AJCC)分期为Ⅱ期;3)组织学亚型为普通型;4)治疗方案为新辅助化疗-根治性手术-辅助化疗;5)具备化疗前活检标本以便用于组织形态学观测。排除标准:1)源发于中轴骨骼、颅骨、骨盆、肋骨和骨外组织的骨肉瘤;2)继发性骨肉瘤;3)骨旁骨肉瘤和骨膜骨肉瘤等其他组织学亚型;4)初诊时发现跳跃性病灶或远处转移灶;5)初诊前已有放疗或化疗史;6)随访期间失访的患者。
通过病历和通信联系,收集记录患者的性别、年龄、原发灶部位、术式(保肢/截肢)、肿瘤最大直径、术前化疗的肿瘤坏死百分率。随访时间截止到2015年12月31日,随访终点为死亡、失访或生存至截止日期,随访期间的失访者算作删失值。自确诊至患者死亡之间的时间定义为总生存时间(overall survival,OS),自手术之日至发生转移之间的时间为无转移生存时间(metastasis-free survival,mFS)。
1.1.2 主要试剂兔抗人FAK多克隆抗体(C-20)购自美国Santa Cruz公司,1:100稀释;兔抗人磷酸化FAK[pY397]单克隆抗体购自美国Invitrogen公司,1:100稀释;Envision试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发公司;CCK-8检测试剂盒及BCA蛋白含量检测试剂盒均购自江苏凯基生物技术股份有限公司;脂质体转染试剂盒LipofectamineTM2000购自美国Invitrogen公司。
1.2 方法
1.2.1 组织形态学观察1)苏木精-伊红(HE)染色113例骨肉瘤标本和22例正常松质骨组织标本以4%的多聚甲醛溶液固定,4%EDTA-2Na溶液脱钙,乙醇逐级脱水,二甲苯透明,石蜡包埋后连续切片,HE染色,在BH-2光学显微镜Olympus下作光镜观察,筛选结构典型的取材部位。2)免疫组织化学染色石蜡标本以4μm厚切片,烤干,于二甲苯溶液及不同浓度的乙醇中脱蜡至水后,微波热修复,修复完毕后加抗人FAK或FAK[pY397]一抗,4℃过夜。根据Elivision plus染色试剂盒要求滴加相应的试剂并孵育,DAB显色,苏木素复染,最后予脱水、透明及封片。采用乳腺癌组织作为阳性对照,以PBS液代替一抗作为阴性对照。3)免疫组织化学结果判定随机选择5个有代表性的高倍镜视野,每个视野记数100个肿瘤细胞。FAK免疫组织化学染色评分标准为:当阳性细胞百分率≥90%且染色强度(不着色、临界着色、着色浅、中等着色和强烈着色分别为0、1、2、3、4分)≥3时,视为FAK过表达和pFAK磷酸化阳性[10-11]。
1.2.2 细胞学试验1)细胞培养人骨肉瘤细胞株143B和MG-63购自美国组织细胞库(Manassas,VA,USA)。细胞复苏后,加入含10%胎牛血清(FBS,Invitrogen)、100 U/mL青霉素和100μg/mL链霉素的DMEM培养基,5% CO2培养箱37℃培养。融合度至90%后消化传代。实验用细胞均在对数生长期。2)细胞转染及Western blot验证设计4条siRNA[12-14],由Qiagen GmbH(Hilden,Germany)公司合成:非特异性(错义)siRNA(5'-AATTCT CCGAACGTGTCACGT-3');FAK siRNA,F1(5'-GGUUC AAGCUGGAUUAUUU-3');FAK siRNA,F2(5'-CCGGTC GAATGATAAGGTGTA-3');FAK siRNA,F3(5'-GGAAA UACAGUUUGGAUCU-3')。确认最佳转染效率后,根据lipo fectamineTM2000试剂盒操作手册对143B和MG-63细胞株进行转染,培养48 h后,细胞悬液加入RIPA裂解液,离心,BCA法稀释,加入上样缓冲液。8%的SDS-PAGE电泳,将蛋白质条带转移至PVDF膜上。含5%脱脂牛奶的TBST缓冲液封闭,依次加入一抗及HRP标记的二抗,暗室曝光后Imageproplus(IPP)软件分析结果,以目的蛋白与GAPDH灰度值的比值进行比较分析。3)细胞增殖实验未转染及转染siRNA的骨肉瘤细胞分别接种于96孔板中,每孔1×105细胞/mL,培养24 h后每孔加入10μLCCK-8,酶标仪在450 nm下测定各孔OD值。4)细胞凋亡检测143B和MG-63细胞悬液以2×105细胞/孔接种于6孔板,24 h后离心收获全部细胞,重悬后加入5μLAnnexin V-FITC和10μLPI,冰孵15min,流式细胞仪分析检测。5)细胞迁移和侵袭实验制备2×105细胞/mL的细胞悬液。Transwell小室的下室加入500μL含5%FBS的DMEM;迁移实验时将200μL细胞悬液加入上室,侵袭实验时先将80μLMatrigel(80μL)(BDBiosciences)加入上室37°C孵育1 h,待形成凝胶后再向上室加入200μL细胞悬液。培养24 h后(MG-63的侵袭实验是48 h),用棉签去除凝胶,4%多聚甲醛固定20min,苏木素室温染色3~5min。显微镜下随机选择6个视野(200倍)计数染色细胞并计算平均值。所有实验均进行5次独立的实验。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,计量资料采用t检验,计数资料应用χ2检验,生存分析采用Ka⁃plan-Meier法,并应用Cox比例风险模型分析独立预后因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 骨肉瘤中FAK的免疫组织化学染色情况及其与临床病理参数之间的关系
113例骨肉瘤患者包括男性71例(62.8%)和女性42例(37.2%);年龄5~56岁,中位年龄20.3岁;随访时间7~160个月,中位随访时间56个月;5年的总体生存率为51.1%。113例骨肉瘤标本中有70例(61.95%)FAK过表达,染色部位主要在瘤细胞的胞浆,胞膜偶有染色(图1);其中42例(37.17%)pFAK染色阳性。正常松质骨标本和阴性对照均未见FAK过表达及磷酸化。统计分析显示,骨肉瘤中FAK或pFAK与患者的性别、年龄、AJCCⅡA/ⅡB期、肿瘤部位、术式(保肢/截肢)、术前化疗的肿瘤坏死百分率等临床病理参数均无显著相关性(表1)。

图1 骨肉瘤与正常松质骨组织的FAK免疫组织化学染色和磷酸化FAK染色Figure 1 Immunohistochem icalstainingof FAK(A,B,E,and G)and pFAK(C,D,F,and H)proteins in osteosarcoma cellsand normalcancellousbone tissues
2.2 FAK的表达与骨肉瘤患者预后的关系
根据骨肉瘤中FAK是否过表达及其磷酸化状态,患者分为3组:FAK-/pFAK-(A);FAK+/pFAK-(B);FAK+/pFAK+(C)。3组的中位OS分别是86、56、39个月,中位mFS则分别是69、45、24个月。相应3组的5年总生存率分别是78.4%、44.9%、25.8%,而5年无转移生存率分别是55.0%、27.6%、16.9%。这提示FAK的过表达及其磷酸化可能预示患者生存时间较短,转移发生较早。
采用Kaplan-Meier生存分析各项临床病理特征,结果证实FAK的过表达及其磷酸化显著缩短了OS和mFS(图2)。进一步行Log-rank成对比较,结果显示OS在A组和B组之间(P=0.016)、B组和C组之间(P=0.012)以及A组和C组之间(P<0.001)均有显著性差异。类似的mFS在A组和B组之间(P=0.042)、B组和C组之间(P= 0.001)以及A组和C组之间(P<0.001)均有显著性差异。另外,Kaplan-Meier生存分析还显示术前化疗效果对患者的OS和mFS亦有显著影响(图2),但其他临床病理特征与患者生存期及转移均无相关(表2)。进一步采用Cox风险比例回归模型分析显示,除FAK分组的B、C两组之间mFS差异不显著之外,FAK的过表达及其磷酸化和术前化疗效果是预测骨肉瘤生存时间和转移早晚的两个独立预后因素(表3)。
2.3 siRNA转染降低了FAK和pFAK的表达
为研究FAK的细胞学效应,MG-63和143B细胞株均分别转染了非特异错义siRNA(阴性对照组)和3种FAK siRNA(干扰组),并通过Western blot检测转染效果。3个干扰组(F1,F2和F3)的MG-63与阴性对照组及空白对照组的MG-63相比,FAK表达降低了62%~70%;Tyr397磷酸化的FAK(pFAK)表达也降低了67%~75%(图3)。143B细胞株FAK和pFAK表达下降情况与MG63相似。
2.4 FAK表达降低对细胞增殖及凋亡的作用
增殖检测结果显示,FAK siRNA(F1,F2和F3)干扰组的MG-63和143B细胞OD值明显低于相应的阴性对照组和空白对照组,而阴性对照组和空白对照组之间OD值无显著差异(表4)。凋亡检测显示,阴性对照组和空白对照组的凋亡率明显低于3个干扰组。这表明抑制FAK的表达可诱导骨肉瘤细胞的凋亡并抑制其增殖(表5,图4)。
2.5 FAK的下调抑制了骨肉瘤细胞的迁移和侵袭
转染FAK siRNA的3个干扰组迁移到Transwell膜上的细胞数明显少于阴性对照组及空白对照组(图5),侵袭实验中也观察到同样的结果(图6),这显示FAK及pFAK的过表达在骨肉瘤细胞的迁移及侵袭中发挥重要作用。

表1 AJCC分期Ⅱ期的骨肉瘤患者FAK表达谱与临床病理特征之间的关系Table 1 Association of clinicopathologicaldataand FAKexpression profiles in patientsw ith stage IIAJCCstage extrem ityosteosarcoma
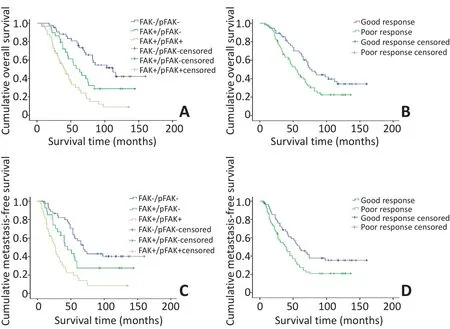
图2 FAK表达水平及术前化疗效果不同的各组患者OS和mFS的Kaplan-Meier单因素分析Figure 2 Kaplan-Meier analysis of overalland metastasis-free survival for patientsw ith different FAKexpression levels and different histological responses to pre-operative chemotherapy

表2 骨肉瘤患者OS和mFS的Kaplan-Meier单因素分析Table 2 Univariate analysesof factorsassociatedw ith OSand MFS

表3 骨肉瘤患者预后的多因素生存分析Table 3 Multivariate analysisof factorsassociated w ith OSand MFS

图3 Western blot检测RNA干扰对于骨肉瘤细胞FAK蛋白表达及磷酸化水平的影响Figure 3 Protein expression and phosphorylation of FAKin siRNA-treated osteosarcoma,control,andmock group cells

表4 FAK的siRNA转染对骨肉瘤细胞增殖的影响Table 4 Effectof FAKsiRNA transfection on cellproliferation

表5 FAK的siRNA转染对骨肉瘤细胞凋亡的影响Table 5 Effectof FAKsiRNA transfection on cellapoptosis

图4 FAK表达对骨肉瘤细胞凋亡的影响Figure 4 Effectof inhibiting FAKexpression on apoptosisofosteosarcoma cells.

图5 FAK表达对骨肉瘤细胞迁移能力的影响Figure 5 Effect of inhibiting FAKexpression onm igration ofosteosarcoma cells

图6 FAK表达对骨肉瘤细胞侵袭能力的影响Figure 6 Effect of inhibiting FAKexpression on invasion of osteosarcoma cells
3 讨论
骨肉瘤缺乏有效的临床预后指标。FAK是调节细胞行为的关键因子,而Tyr397的磷酸化则是其将细胞外基质的刺激转化为迁移、黏附、增殖等下游细胞行为过程中的信号枢纽[5],正是这些细胞活动导致了肿瘤的生长、侵袭、转移和血管生成[15]。现观察到消化道肿瘤、肝癌、肺癌、泌尿系统肿瘤和宫颈癌等FAK的过表达与预后不良之间存在密切关联[8-9,16-17],但骨肉瘤标本中FAK的表达水平与患者的临床病理特征及生存时间的关联尚未得到直接论证。为此,需在组织学和细胞学水平进行探讨。
本研究发现113例骨肉瘤标本中FAK和pFAK的免疫组织化学染色评分差异显著,且pFAK的阳性率明显低于FAK,其原因可能是激活后的FAK与一些蛋白的物理性结合对其抗原产生了掩饰效应,从而降低了免疫反应特性[18-19]。单因素生存分析显示FAK/pFAK表达谱与骨肉瘤患者的OS和mFS密切相关,A组(FAK-/pFAK-)预后最好,C组(FAK+/ pFAK+)最差,B组(FAK+/pFAK-)则居中。这提示FAK的过表达及其磷酸化在骨肉瘤的病程进展中发挥重要作用。而且,Cox比例风险模型分析进一步显示FAK/pFAK表达谱是独立预后因素之一。因此考虑FAK的表达水平及其磷酸化状态具有鉴别高危骨肉瘤患者的潜在临床应用价值。
远处转移是恶性肿瘤的主要死因,而瘤细胞的迁移和侵袭则是转移的重要环节。迁移中的肿瘤细胞需与胞外基质(ECM)往复、协调的进行黏附和解离,黏着斑与肌动蛋白张力纤维的生成正是这一过程的原动力[20]。一方面,当细胞与ECM结合后,β1整合素聚集成簇形成黏着斑,FAK与黏着斑结合发生磷酸化且活性增加,通过FAK/Ras/MAPK等通路介导生长刺激信号,促进细胞骨架的重组,调控迁移。另一方面,整合素介导FAK的Tyr397自动磷酸化后,与Src家族PTK结合,形成FAK/Src复合物,FAK/Src复合物可能通过促进细胞尾部局灶黏附的分解,促进细胞迁移和存活[20-21]。不仅如此,尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)和基质金属蛋白酶(MMP)可通过降解ECM,促进肿瘤细胞的侵袭和转移[22-23]。uPA和MMP的分泌过程也需FAK参与的多种信号传导途径的激活[24]。这些发现可以在一定程度上解释FAK作为骨肉瘤患者潜在预后标记的原因和机理。细胞学实验发现FAK表达量及其磷酸化水平的升高促进了143B和MG-63细胞的迁移和侵袭,用RNAi沉默FAK则产生显著抑制效应。因此,本研究考虑激活后的FAK通过肌动蛋白细胞骨架的重构调控了黏着斑组装和解离之间的动态平衡,并由此构成了骨肉瘤细胞迁移和侵袭的动力学基础,进而加速了骨肉瘤的转移。
既往研究还显示FAK与细胞的生存关系密切。FAK的活化可激活PI3K信号通路,经PKB/AKT途径对抗凋亡[25]。FAK还通过MAPK-ERK通路激活多种转录因子,代替锚定依赖性生存信号,促进肿瘤细胞的增殖和存活[26]。研究表明,ERK的激活可促进c-Fos基因转录,而且MAPK级联反应活化的c-Jun N末端激酶(JNK)可以调节细胞循环G1期。JNK的活化又需要FAK与Src、p130Cas的结合以及与Crk的缔和。活化的JNK进入细胞核,使转录因子c-Jun磷酸化,与c-Fos形成AP-1(activator protein-1)转录因子复合物调节下游基因控制细胞的增殖过程[27]。本研究中,FAK siRNA抑制了143B和MG-63细胞的增殖,促进了凋亡。还有学者观察到抑制FAK活性可诱导另一株骨肉瘤细胞SAOS-2发生凋亡[28]。因此,本研究认为FAK的表达及其磷酸化通过复杂的下游信号途径对骨肉瘤细胞的生存和增殖发挥重要作用,并由此促进了疾病进展。
综上所述,本研究在组织学和细胞学层面初步证实了FAK的过表达及其磷酸化与骨肉瘤的恶性程度存在显著相关性,这可能与其促进骨肉瘤细胞的增殖、迁移及侵袭活动有关。FAK/pFAK表达谱是骨肉瘤的一个独立预后因素,可能为骨肉瘤患者的生存期及预后判断提供一定参考。对FAK的深入研究不仅有助于揭示骨肉瘤发病机制,也可能为其临床治疗提供新方向和新靶点。
[1]Hattinger CM,SerraM.Role ofpharmacogeneticsofdrug-metabolizing enzymes in treatingosteosarcoma[J].ExpertOpin Drug Metab Toxicol, 2015,11(9):1449-1463.
[2]He A,QiW,Huang Y,etal.CD133 expression predicts lungmetastasisand poor prognosis in osteosarcoma patients:A clinicaland experimentalstudy[J].Exp TherMed,2012,4(3):435-441.
[3]Sun R,Shen J,Gao Y,et al.Overexpression of EZH2 is associated w ith the poor prognosis inosteosarcoma and function analysis indicates a therapeutic potential[J].Oncotarget,2016,7(25):38333-38346.
[4]Hattinger CM,Fanelli M,Tavanti E,et al.Advances in emerging drugs for osteosarcoma[J].Expert Opin Emerg Drugs,2015,20(3): 495-514.
[5]Lai IR,Chu PY,Lin HS,et al.Phosphorylation of focaladhesion kinase at Tyr397 in gastric carcinomas and its clinicalsignificance[J]. Am JPathol,2010,177(4):1629-1637.
[6]Cheng YJ,Zhu ZX,Zhou JS,et al.Silencing profilin-1 inhibitsgastric cancer progression via integrinβ1/focaladhesion kinase pathway modulation[J].World JGastroenterol,2015,21(8):2323-2335.
[7]TzenakiN,Aivaliotis M,Papakonstanti EA.Focal adhesion kinasephosphorylates the phosphatase and tensin homolog deleted onchromosome 10 under the controlof p110δphosphoinositide-3 kinase[J].FASEBJ,2015,29(12):4840-4852.
[8]Thanapprapasr D,Previs RA,Hu W,et al.PTEN expression asa predictorof response to focaladhesion kinaseinhibition in uterine cancer[J].MolCancer Ther,2015,14(6):1466-1475.
[9]Zeng XQ,LiN,Ma LL,etal.Prognostic value of focaladhesion kinase (FAK)in human solid carcinomas:AMeta-analysis[J].PLoSOne,2016, 11(9):e0162666.
[10]Golubovskaya VM,Conway-Dorsey K,Edmiston SN,et al.FAKoverexpression and p53 mutations are highly correlated in human breastcancer[J].Int JCancer,2009,125(7):1735-1738.
[11]Lark AL,Livasy CA,Dressler L,et al.High focaladhesion kinase expression in invasive breast carcinomas isassociated with an aggressive phenotype[J].Mod Pathol,2005,18(10):1289-1294.
[12]LiF,Zhang X,Jin YP,etal.Antibody ligation ofhuman leukocyte antigen lass Imolecules stimulates m igration and proliferation of smoothmuscle cells in a focaladhesion kinase-dependentmanner [J].Hum Immunol,2011,72(12):1150-1159.
[13]LiG,Du X,VassWC,etal.Fullactivity of the deleted in liver cancer 1(DLC1)tumor suppressor depends on an LD-likemotif that binds talin and focal adhesion kinase(FAK)[J].Proc Natl Acad SciU SA, 2011,108(41):17129-17134.
[14]Eke I,CordesN.Dualtargetingof EGFRand focaladhesion kinase in 3D grown HNSCCcellcultures[J].RadiotherOncol,2011,99(3):279-286.
[15]Zhao J,Guan JL.Signal transduction by focaladhesion kinase in cancer[J].CancerMetastasisRev,2009,28(1-2):35-49.
[16]Gómez Del Pulgar T,Cebrián A,Fernández-Aceñero MJ,et al.Focal adhesion kinase:predictor of tumour response and risk factor for recurrence after neoadjuvant chemoradiation in rectal cancer[J].J CellMolMed,2016,20(9):1729-1736.
[17]Kong D,Chen F,Sima NI.Inhibition of focaladhesion kinase induces apoptosis in bladder cancer cells via Src and the phosphatidylinositol3-kinase/Aktpathway[J].Exp TherMed,2015,10(5):1725-1731.
[18]Aronsohn MS,Brown HM,Hauptman G,et al.Expression of focal adhesion kinase and phosphorylated focaladhesion kinase insquamous cellcarcinoma of the larynx[J].Laryngoscope,2003,113(11): 1944-1948.
[19]Ding L,Sun X,You Y,et al.Expression of focaladhesion kinase and phosphorylated focaladhesion kinase in human gliomas isassociated w ith unfavorable overallsurvival[J].TranslRes,2010,156(1):45-52.
[20]Kaushik S,RaviA,Hameed FM,etal.Concertedmodulation ofpaxillin dynam ics at focaladhesions by deleted in liver cancer-1 and focal adhesion kinase during early cellspreading[J].Cytoskeleton(Hoboken),2014,71(12):677-694.
[21]Giancotti FG,Ruoslahti E.Integrin signaling[J].Science,1999,285 (5430):1028-1032.
[22]Su SC,Lin CW,YangWE,et al.The urokinase-type plasm inogen activator(uPA)system asa biomarkerand therapeutic target in human malignancies[J].ExpertOpin Ther Targets,2016,20(5):551-566.
[23]SasakiH,Klotz LH,Sugar LM,etal.A combination ofdesmopressin and docetaxel inhibit cell proliferation and invasion mediated byurokinase-type plasminogen activator(uPA)in human prostate cancer cells[J].Biochem BiophysResCommun,2015,464(3):848-854.
[24]Kornberg LJ.Focal adhesion kinase expression in oral cancers[J]. Head Neck,1998,20(7):634-639.
[25]LiY,Chen YM,Sun MM,et al.Inhibition on apoptosis induced by elevated hydrostatic pressure in retinalganglion cell-5 via laminin upregulatingβ1-integrin/focal adhesion kinase/protein kinase B signaling pathway[J].Chin Med J(Engl),2016,129(8):976-783.
[26]Kim WY,Jang JY,Jeon YK,et al.Syntenin increases the invasiveness of smallcell lung cancer cellsby activating p38,AKT,focaladhesion kinaseand SP1[J].Exp MolMed,2014,46:e90.
[27]Chikano Y,Domoto T,Furuta T,et al.Glycogen synthase kinase 3β sustains invasion of glioblastoma via the focal adhesion kinase, Rac1,and c-Jun N-term inalkinase-mediated pathway[J].MolCancer Ther,2015,14(2):564-574.
[28]Wang J,Zu J,Xu G,etal.Inhibition of focaladhesion kinase induces apoptosis in human osteosarcoma SAOS-2 cells[J].Tumour Biol, 2014,35(2):1551-1556.
(2017-01-05收稿)
(2017-05-07修回)
(编辑:杨红欣校对:武斌)
Clinical significance of expression and phosphorylation of FAK in human osteosarcoma
Ke REN1,Nan YAO2,Jun LU1,Xin SHI3,Sujia WU3,Jie MA4,Chen WANG1
1Department of Orthopaedics,Zhongda Hospital,Southeast University,Nanjing 210009,China;2Laboratory of TranslationalMedicine, Jiangsu Province Academy of TraditionalChinese Medicine,Nanjing 210028,China;3Department of Orthopedics,Nanjing GeneralHospital,Nanjing University,SchoolofMedicine,Nanjing 210002,China;4Departmentof Pathology,Nanjing GeneralHospital,Nanjing University,SchoolofMedicine,Nanjing210002,China
ChenWANG;E-mail:chenwang_southeast@126.com
Objective:To exam ine expression patternsof focaladhesion kinase(FAK)and itsactivated form,phosphorylated FAK(pFAK), in human osteosarcoma and to investigate the correlation of FAKexpressionw ith clinicopathologicalparametersand prognosis.Functional consequence ofmanipulating FAKprotein levelswasalso investigated in human osteosarcoma cell lines.Methods:Immunohistochemical stainingwasused to detect FAKand pFAK levels in pathologicallyarchivedmaterials from 113 patientswith primaryosteosarcoma.Kaplan-Meier survivaland Cox regression analyseswere used to evaluate prognoses.The role of FAK in cytologicalbehaviorofMG63 and 143B human osteosarcoma cell lineswasstudied via the FAKprotein knockdown with siRNA.Cellproliferation,m igration,invasiveness,and apoptosiswere assessed using cell counting kit-8,Transwell,and Annexin V/PIstainingmethods.Results:Both FAK and pFAKwere overexpressed in osteosarcoma patients.Tumor cellsexhibited cytoplasm icity and occasionalmembranous immunoreactivity for FAK.A totalof42 cases(37.17%)mainly showed expressed pFAKin cytoplasm ofosteosarcoma cells.No overexpression stainingofanti-FAKand anti-pFAKantibodieswasobserved in normalcancellousbone tissuesornegative controls.Significantdifferenceswere observed in overall survivalbetween FAK-/pFAK-and FAK+/pFAK-groups(P=0.016),FAK+/pFAK-and FAK+/pFAK+groups(P=0.012),and FAK-/pFAK-and FAK+/ pFAK+groups(P<0.001).Allgroupsshowed similarmetastasis-free survival.Cox proportionalhazard analysisshowed that FAKexpression profile isan independent indicatorofboth overallandmetastasis-free survival.siRNA-based knockdown of FAKsignificantly reducedm igration and invasion ofMG63 and 143Bcellsand affected proliferation and apoptosis in osteosarcoma cells.Conclusion:Osteosarcomamalignancies in vitro and in vivo were correlated w ith overexpression and phosphorylation of FAK.These findingssuggest that FAKplaysan important biological role in osteosarcoma carcinogenesis.This study providesa betterunderstanding ofdiagnostic and prognostic relevance of FAK overexpression and phosphorylation in osteosarcoma patients.Therefore,FAKand pFAKcan be used as independent predictorsofoverall andmetastasis-free survivalin osteosarcoma patients.
osteosarcoma,focaladhesion kinase,prognosis,m igration,invasion
10.3969/j.issn.1000-8179.2017.10.019

①东南大学附属中大医院骨科(南京市210009);②江苏省中医药研究院转化医学实验室;③南京军区南京总医院骨科;④南京军区南京总医院病理科
*本文课题受国家自然科学基金项目(编号:81673017)和江苏省自然科学基金项目(编号:BK2012775)资助
王宸chenwang_southeast@126.com
This workk was supported by the National Natural Science Foundation of China(No.81673017)and the Jiangsu Province Natural Science Foundation from the Science and Technology Departmentof Jiangsu Province ofChina(No.BK2012775)
任可专业方向为骨肉瘤血管生成拟态的研究。
E-mail:renke1997@sohu.com

