HDAC5对胃癌SGC-7901细胞增殖和凋亡的影响
张勇 杨晨 王心治 熊玉宝 吴曙华
·基础研究·
HDAC5对胃癌SGC-7901细胞增殖和凋亡的影响
张勇 杨晨 王心治 熊玉宝 吴曙华
目的:探讨HDAC5在胃癌细胞中的表达及其对胃癌SGC-7901细胞增殖和凋亡的影响。方法:通过Western blot检测HDAC5和Twist1在胃癌细胞株及正常胃黏膜上皮细胞中的表达。使用MTT及流式细胞术分别检测HDAC5和Twist1对胃癌SGC-7901细胞增殖和凋亡的影响。结果:HDAC5和Twist1在胃癌细胞株中的表达量均明显高于正常胃黏膜上皮细胞(P<0.05)。沉默HDAC5的表达可使胃癌SGC-7901细胞中Twist1表达降低,并抑制其增殖、促进凋亡;而过表达HDAC5作用相反(P<0.05)。此外,沉默Twist1可抑制SGC-7901细胞的增殖、促进其凋亡(P<0.05)。结论:HDAC5可能通过上调Twist1的表达水平促进胃癌细胞的增殖、抑制凋亡,从而促进胃癌的发生发展。
胃癌 增殖 凋亡 HDAC5 Twist1
胃癌是消化系统常见的恶性肿瘤之一,在全球范围内,其发病率居第4位,死亡率居第2位[1]。有研究显示,2008年全球胃癌新发989 600例,其中大约一半的病例发生于东亚地区,特别是中国[2-3]。胃癌的发生发展是一个多基因、多因素、多阶段的动态演变过程,涉及到多种癌基因的激活、抑癌基因的失活以及由此引起的细胞生物学行为的改变等[4]。目前,早期胃癌主要的治疗方式是手术、化疗和放疗。然而,胃癌根治术后约40%~60%的患者会发生复发或转移,已转移的患者平均生存期不到1年[5-6]。因此,进一步研究胃癌发生发展的分子机制可能为胃癌的早期诊断和治疗提供新的策略,从而改善胃癌患者的预后。组蛋白去乙酰化酶(histone deacetylases, HDACs)是通过调节组蛋白和非组蛋白的乙酰化水平从而调节基因表达和染色质结构的酶[7]。HDACs家族由18个蛋白组成,根据其同源性和结构的不同可分为Ⅰ~Ⅳ类[8]。越来越多的研究表明HDACs家族可通过表观遗传学调节基因表达从而影响肿瘤的发生、发展和转移等[9-10]。HDAC5属于HDACs家族中的第Ⅱ类,其对肿瘤细胞增殖、凋亡及细胞周期等的影响已经在多种肿瘤中被证实,如髓母细胞瘤[11]、肝癌[12]和大肠癌[13]等。然而,HDAC5在胃癌发生发展中的作用目前尚缺乏报道。本实验通过观察HDAC5在细胞中的表达水平及其对胃癌细胞增殖和凋亡的影响,探讨HDAC5在胃癌发生发展中的作用及其机制。
1 材料与方法
1.1 材料
胃癌细胞株(MGC-803、MKN-45、SGC-7901和AGS)及正常胃黏膜上皮细胞(GES-1)均购自中国生命科学研究院上海细胞库。RPMI1640培养液及胎牛血清(FBS)购自美国Gibco公司。蛋白提取试剂盒及ECL发光试剂盒购自江苏凯吉生物公司。HDAC5和Twist1的一抗购自英国Abcam公司,相应的二抗及β-actin的一抗、二抗均购自美国Sigma公司。总RNA提取试剂盒TRIzol购自美国Invitrogen公司,反转录试剂盒购自北京天根公司。pcDNA3.1(+)质粒购自广州锐博生物公司,小干扰RNA si-HDAC5和si-Twist1及RT-PCR的上下游引物由上海生工生物公司设计合成。Lipofectamine2000购自美国Invitro⁃gen公司。噻唑蓝(MTT)试剂盒购自北京鼎国生物技术有限责任公司,碘化丙啶(propidium iodide,PI)购自美国Sigma公司,细胞凋亡试剂盒购自美国eBiosci⁃ence公司。FACScan流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养胃癌细胞株(MGC-803、MKN-45、SGC-7901和AGS)及正常胃黏膜上皮细胞(GES-1)均使用含10%胎牛血清和1%双抗的RPMI1640培养液,置于37℃、含5%CO2的培养箱中进行培养。2~3 d换代1次,取对数期生长的细胞进行实验。
1.2.2 Western blot检测使用RIPA裂解液裂解细胞,提取细胞总蛋白。蛋白定量并煮沸后进行SDSPAGE电泳并转移至PVDF膜,用5%脱脂奶粉封闭1 h。磷酸缓冲盐溶液PBS洗膜3次后分别用HDAC5、Twist1及β-actin的一抗4℃孵育过夜。PBST洗膜3次后二抗常温孵育1h,再次用PBST洗3次后行ECL显影。
1.2.3 质粒构建及细胞转染从胃癌SGC-7901细胞中提取的总RNA通过反转录后获得含有HDAC5片段的cDNA,经过PCR扩增,并将PCR产物进行琼脂糖凝胶电泳,回收后和表达载体pcDNA3.1进行酶切、链接构建pcDNA3.1-HDAC5重组质粒。PCR的引物为:上游5'-GGAATTCATGAAGTTGGAGGTGTT CGTC-3';下游5'-CCTCGAGCGCTACTCAGGCTAGG AGCGTCTCCAC-3'。si-HDAC5和si-Twist1及质粒均利用Lipofectamine2000,按照说明书进行转染,均设有对照组与实验组。
1.2.4 MTT检测细胞增殖转染48h后的SGC-7901细胞用胰酶消化并计数,以3×103个细胞/孔接种于96孔板中,置于37℃、含5%CO2的培养箱中进行培养。分别于0、24、48、72、96 h时加入浓度为0.01mol/L的 MTT 20μL,继续培养4 h后弃掉培养液,并加入150μL二甲基亚砜(DMSO)溶解悬浮颗粒。用酶标仪在450nm波长处测定其吸光度(optical density,OD)值,即0D450。
1.2.5 流式细胞术检测细胞凋亡转染后的细胞用胰酶消化并调整细胞密度后制成单细胞悬液,离心,弃上清;用PBS洗涤沉淀后离心,用1mL 1×Binding Buffer重悬细胞,再次离心,弃上清。加入10μLAn⁃nexin-V(20μg/mL)室温下避光反应30min,再加入5μL PI(50μg/mL)避光反应10min,再加入400μL Bind⁃ing Buffer,立即使用FACScan流式细胞术检测细胞凋亡。实验重复3次。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。所有数据均用x±s表示,组间比较采用t检验或单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 HDAC5和Twist1在胃癌细胞株中的表达情况
通过Western blot检测胃癌细胞株(MGC-803、MKN-45、SGC-7901和AGS)及正常胃黏膜上皮细胞(GES-1)中HDAC5和Twist1的表达情况。结果提示4个胃癌细胞株中HDAC5和Twist1的表达量均明显高于GES-1。胃癌细胞株MGC-803、MKN-45、SGC-7901和AGS中HDAC5表达量相对GES-1平均分别为2.48、3.17、3.70、2.62;Twist1的表达量相对GES-1平均分别为3.72、3.33、3.37、1.72,差异均具有统计学意义(P<0.05,图1)。
2.2 HDAC5对胃癌SGC-7901细胞增殖及凋亡的影响
向胃癌SGC-7901细胞转染小干扰RNA沉默HDAC5(si-HDAC5)及其空白对照(control),并通过Western blot检测转染效率(图2A)。转染后的细胞使用MTT检测细胞的增殖情况,MTT的结果提示转染si-HDAC5使SGC-7901的增殖能力明显降低,从48h开始差异具有统计学意义(P<0.05,图2B)。流式细胞术检测到转染si-HDAC5后SGC-7901细胞的凋亡率较对照组明显增加,平均分别为20.27%和11.18%,差异具有统计学意义(P<0.05,图2C,D)。
2.3 HDAC5对胃癌SGC-7901细胞中Twist1表达量的影响
为了探索HDAC5对Twist1表达量的影响,分别向SGC-7901细胞转染si-HDAC5和HDAC5过表达质粒。转染后收集细胞蛋白行Western blot检测Twist1的表达量。结果提示转染si-HDAC5后Twist1的表达量较对照组明显降低;相反,过表达HDAC5后Twist1的表达量明显高于对照组(图2A)。
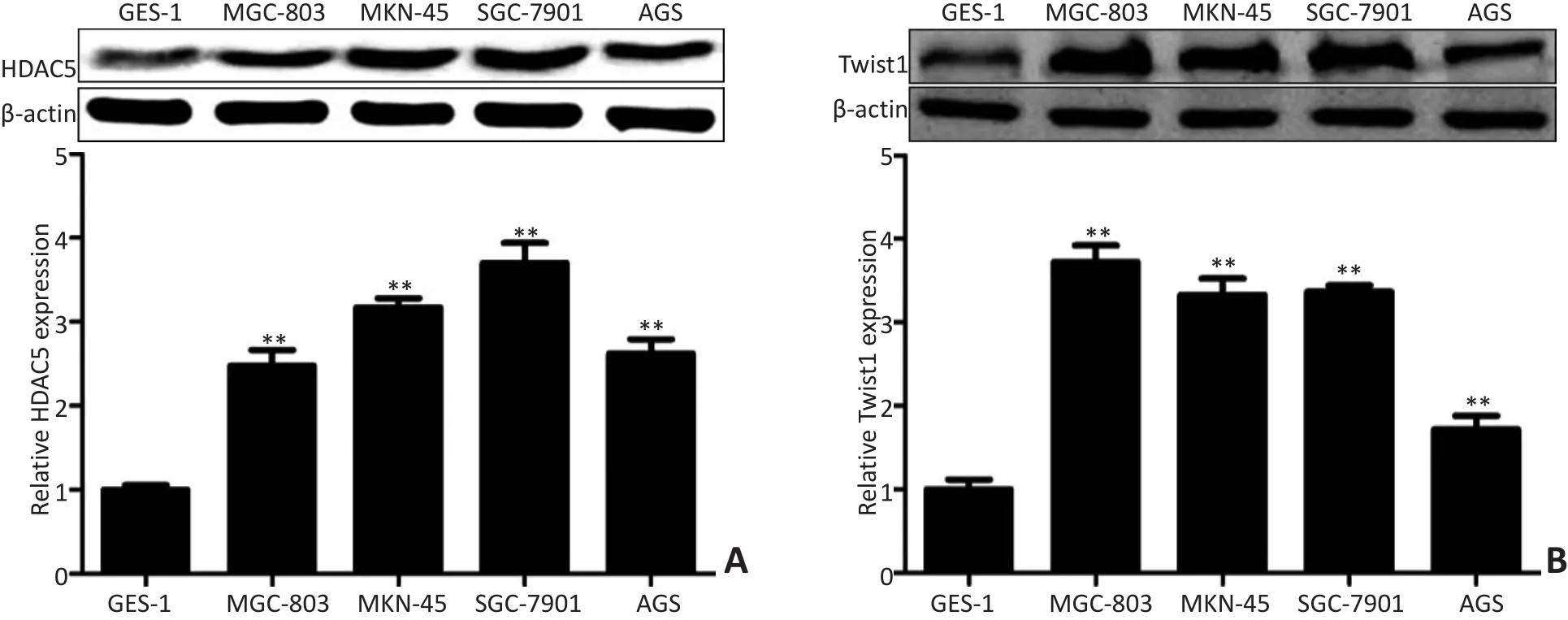
图1 HDAC5和Twist1在胃癌细胞株中的表达Figure 1 Expression ofHDAC5 and Tw ist1 in gastric cancer cell lines

图2 HDAC5对胃癌SGC-7901细胞增殖及凋亡的影响Figure 2 EffectsofHDAC5 on the proliferation and apoptosisof the gastric cancer cell line SGC-7901
2.4 Twist1对胃癌SGC-7901细胞增殖及凋亡的影响
胃癌SGC-7901细胞转染Twist1小干扰RNA(si-Twist1)后行Western blot检测到Twist1的表达量明显降低(图3A)。MTT和流式细胞术检测结果提示沉默Twist1后SGC-7901细胞的增殖能力明显降低、凋亡率增加,差异具有统计学意义。另外,过表达HDAC5使SGC-7901细胞的增殖能力升高、凋亡率降低,差异具有统计学意义(P<0.05、图3B,C,D)。

图3 Twist1对胃癌SGC-7901细胞增殖及凋亡的影响Figure 3 Effectsof Tw ist1 on the proliferation and apoptosisof the gastric cancer cell line SGC-7901
3 讨论
胃癌是中国常见的消化道恶性肿瘤之一,胃癌的发生与多种因素相关,如饮食习惯、环境因素、慢性胃炎和幽门螺杆菌感染等[14]。尽管近年来其治疗手段取得了新的进展,胃癌的死亡率仍然居高不下,主要是因为胃癌的早期诊断率较低[15]。因此进一步研究胃癌发生发展的分子机制将有利于胃癌的早期诊断和治疗。许多研究表明HDAC家族是细胞增殖、凋亡及细胞周期的重要调节因子,其异常表达与肿瘤的发生发展密切相关[16]。进而,多种HDAC的抑制剂被证实可抑制肿瘤细胞的生物学行为,如HDAC抑制剂(S)-8可通过破坏HDAC6-PP1复合物抑制黑色素瘤细胞的生长和促进其凋亡[17];HDAC抑制剂WJ可通过促进c-Cbl的表达抑制肺癌细胞的增殖[18]。作为HDACs家族中的第Ⅱ类,HDAC5在多种肿瘤的发生发展中也发挥了重要的作用。本研究旨在探讨HDAC5在胃癌细胞中的表达情况及其对胃癌SGC-7901细胞增殖和凋亡的影响。首先,通过Western blot检测到4个胃癌细胞株中HDAC5的表达量均明显高于正常胃黏膜上皮细胞,提示HDAC5可能在胃癌的发生发展中起到重要的作用。其次,通过小干扰RNA沉默HDAC5后研究其对SGC-7901细胞增殖和凋亡的影响,结果提示沉默HDAC5使SGC-7901细胞的增殖能力降低、凋亡率增加;相反,过表达HDAC5后可促进SGC-7901细胞的增殖、抑制其凋亡。以上实验结果表明HDAC5可通过促进胃癌细胞的增殖、抑制凋亡从而促进胃癌的发展。
Twist1是一种高度保守的碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子,与肿瘤细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)过程密切相关,在肿瘤进展中发挥重要作用[19-20]。Twist1在肿瘤发展中的作用也被相继报道,如Twist1可通过NF-κB信号通路调节乳头状甲状腺癌的EMT[21];Twist1可促进大肠癌细胞的增殖和抑制凋亡,且Twist1的高表达可使大肠癌患者的预后更差[22]。Twist1在胃癌中的研究也有报道,如Sung等[23]报道了Twist1与胃癌患者的不良预后密切相关;Qian等[24]研究发现Twist1可通过上调FoxM1的表达促进胃癌细胞的增殖。以上研究均表明Twist1在胃癌发生发展中起着重要作用。
本研究首先通过Western blot检测到胃癌细胞株中Twist1的表达量明显高于正常胃黏膜上皮细胞。其次高表达或沉默HDAC5可分别增加或降低Twist1在SGC-7901细胞中的表达量。最后,通过小干扰RNA沉默Twist1可使胃癌SGC-7901细胞的增殖能力减低,凋亡率增加。因此,以上结果表明HDAC5可能通过上调Twist1的表达水平从而促进胃癌SGC-7901细胞的增殖、抑制凋亡,参与胃癌的发生发展。然而,HDAC5在胃癌细胞中上调Twist1的机制尚不清楚,需要进一步的研究来揭示。Twist1作为一个促癌基因,可抑制细胞凋亡、促进细胞增殖和侵袭等,其表达受到多种信号通路的调控,如NF-κB、IGF-1、TGF-β/Wnt信号通路以及MXC2和STAT3[25]。因此,HDAC5可能通过调控NF-κB、IGF-1、TGF-β/Wnt信号通路,或者MXC2和STAT3等上调HDAC5从而发挥其对胃癌细胞增殖和凋亡的影响。
综上所述,HDAC5在胃癌细胞中明显高表达,且其高表达可通过上调Twist1的表达水平促进胃癌细胞的增殖、抑制凋亡,从而促进胃癌的发生发展。本研究结果提示HDAC5可能作为胃癌早期诊断的一个标志物,并可能为胃癌的治疗提供新的策略。然而HDAC5对胃癌细胞迁移和侵袭能力的影响及与胃癌患者预后的相关性还需进一步探讨。
[1]Lin X,Zhao Y,SongWM,et al.Molecular classification and prediction in gastric cancer[J].Comput Struct Biotechnol J,2015,13:448-458.
[2]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer JClin,2011,61(2):69-90.
[3]Ang TL,Fock KM.Clinicalepidemiology of gastric cancer[J].SingaporeMed J,2014,55(12):621-628.
[4]Huang KN,Liu DY,Wang AM,etal.ThemRNAexpression and significance of MCM 2 and PCNA in gastric cancer tissues[J].Shandong Medical Journal,2015,55(31):69-71.[黄克楠,刘冬艳,王爱民,等.胃癌组织中MCM 2、PCNAmRNA表达变化及意义[J].山东医药, 2015,55(31):69-71.]
[5]Yang L,Zhu J,Huang H,et al.PFTK1 promotes gastric cancer progression by regulating proliferation,m igration and invasion[J].PloS One,2015,10(10):e0140451.
[6]Carcas LP.Gastric cancer review[J].JCarcinog,2014,13:14.
[7]Kahali S,Sarcar B,Chinnaiyan P.The emerging role of histone deacetylases(HDACs)in UPR regulation[J].Methods Enzymol, 2011,490:159-174.
[8]De Ruijter AJ,van Gennip AH,Caron HN,et al.Histone deacetylases(HDACs):characterization of the classicalHDAC fam ily[J].Biochem J,2003,370(Pt3):737-749.
[9]Vigushin DM,Coombes RC.Histone deacetylase inhibitors in cancer treatment[J].Anticancer Drugs,2002,13(1):1-13.
[10]Song SH,Han SW,Bang YJ.Epigenetic-based therapies in cancer: progress to date[J].Drugs,2011,71(18):2391-2403.
[11]M ilde T,Oehme I,Korshunov A,et al.HDAC5 and HDAC9 inmedulloblastoma:novelmarkers for risk stratification and role in tumor cellgrow th[J].Clin Cancer Res,2010,16(12):3240-3252.
[12]Feng GW,Dong LD,ShangWJ,etal.HDAC5 promotes cellproliferation in human hepatocellular carcinoma by up-regulating Six1 expression[J].Eur RevMed PharmacolSci,2014,18(6):811-816.
[13]He P,Liang J,Shao T,et al.HDAC5 promotes colorectal cancer cell proliferation by up-regulating DLL4 expression[J].Int JClin Exp Med,2015,8(4):6510-6516.
[14]Shi J,Qu YP,Hou P.Pathogeneticmechanisms in gastric cancer[J]. World JGastroenterol,2014,20(38):13804-13819.
[15]Kamangar F,DoresGM,AndersonWF.Patternsof cancer incidence, mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].JClin Oncol,2006,24(14):2137-2150.
[16]Bolden JE,Peart MJ,Johnstone RW.Anticancer activities of histone deacetylase inhibitors[J].NatRev Drug Discov,2006,5(9):769-784.
[17]Balliu M,Guandalini L,RomanelliMN,et al.HDAC-inhibitor(S)-8 disrupts HDAC6-PP1 complex prompting A375 melanoma cell grow th arrest and apoptosis[J].JCell Mol Med,2015,19(1):143-154.
[18]WeiTT,Lin YC,Lin PH,et al.Induction of c-Cbl contributes to anticancer effects of HDAC inhibitor in lung cancer[J].Oncotarget, 2015,6(14):12481-12492.
[19]Khan MA,Chen HC,Zhang D,et al.Tw ist:amolecular target in cancer therapeutics[J].Tumour Biol,2013,34(5):2497-2506.
[20]Qin Q,Xu Y,He T,et al.Normaland disease-related biological functions of Tw ist1 and underlyingmolecularmechanisms[J].CellRes, 2012,22(1):90-106.
[21]Lv N,Shan Z,Gao Y,et al.Tw ist1 regulates the epithelial-mesenchymaltransition via the NF-kappaBpathway in papillary thyroid carcinoma[J].Endocrine,2016,51(3):469-477.
[22]Zhu DJ,Chen XW,ZhangWJ,et al.Tw ist1 is a potentialprognostic marker for colorectal cancer and associated w ith chemoresistance [J].Am JCancer Res,2015,5(6):2000-2011.
[23]Sung CO,Lee KW,Han S,et al.Tw ist1 isup-regulated in gastric cancer-associated fibroblasts w ith poor clinical outcomes[J].Am J Pathol,2011,179(4):1827-1838.
[24]Qian J,Luo Y,Gu X,et al.Tw ist1 promotesgastric cancer cellproliferation through up-regulation of FoxM 1[J].PloSOne,2013,8(10): e77625.
[25]Yang MH,Wu KJ.TWIST activation by hypoxia inducible factor-1 (HIF-1):implications in metastasis and development[J].Cell Cycle, 2008,7(14):2090-2096.
(2016-10-26收稿)
(2017-05-16修回)
(编辑:武斌校对:杨红欣)
Effects of HDAC5 on the proliferation and apoptosis of the gastric cancer cell line SGC-7901
Yong ZHANG,Chen YANG,Xinzhi WANG,Yubao XIONG,Shuhua WU
Department of Emergency,Second Affiliated Hospital,Suzhou University,Suzhou 215000,China
ShuhuaWU;E-mail:peopledoctor@163.com
Objective:To investigate HDAC5 expression in gastric cancer cell lines and its effects on the proliferation and apoptosis of the gastric cancer line SGC-7901.Methods:The expression patternsof HDAC5 and Tw ist1 in gastric cancer cell linesand normalgastric mucosal cellswere detected byWestern blot.The effects of HDAC5 and Tw ist1 on the proliferation and apoptosis of SGC-7901 cells were analyzed by MTTand flow cytometry,respectively.Results:The expression of HDAC5 and Tw ist1 in gastric cancer cell lineswere significantly higher than that in normalgastricmucosal cells(P<0.05).HDAC5 knockdown significantly down-regulated Tw ist1 expression,inhibited cellproliferation,and induced apoptosis in SGC-7901 cells,whereas HDAC5 overexpression exhibited an opposite effect (P<0.05).Moreover,Twist1 knockdown significantly inhibited cellproliferation and induced apoptosis in SGC-7901 cells(P<0.05).Conclusion:HDAC5may promote cellproliferation and inhibitapoptosis in gastric cancer cellsby upregulating Tw ist1 expression,thus promoting the initiation and developmentofgastric cancer.
gastric cancer,proliferation,apoptosis,HDAC5,Tw ist1
10.3969/j.issn.1000-8179.2017.10.239

苏州大学附属第二医院急诊科(江苏省苏州市215000)
吴曙华peopledoctor@163.com
张勇专业方向为急诊医学的基础和临床研究。
E-mail:hmscsj@yeah.net

