镇肝熄风汤含药血清激活Nrf2/ARE信号通路对6-OHDA诱导PC12细胞氧化应激的保护作用*
赵学梅,徐天娇,董妙先**
(1.齐齐哈尔医学院药学院齐齐哈尔161006;2.齐齐哈尔医学院医药科学研究所齐齐哈尔161006)
镇肝熄风汤含药血清激活Nrf2/ARE信号通路对6-OHDA诱导PC12细胞氧化应激的保护作用*
赵学梅1,徐天娇2,董妙先2**
(1.齐齐哈尔医学院药学院齐齐哈尔161006;2.齐齐哈尔医学院医药科学研究所齐齐哈尔161006)
目的:研究镇肝熄风汤含药血清对6-羟基多巴胺(6-hydroxydopamine,6-OHDA)致PC12细胞氧化应激的保护作用及其相关机制。方法:应用镇肝熄风汤低剂量(8 g·kg-1)、中剂量(16 g·kg-1)和高剂量组(32 g·kg-1)大鼠的含药血清或空白血清预处理PC12细胞1 h后,加100 μM 6-OHDA共孵育24 h后收集细胞。二氯荧光素双醋酸盐(DCFH-DA)荧光探针染色法结合荧光酶标仪检测活性氧(Reactive Oxygen Species,ROS)水平,采用实时定量PCR检测核转录因子E2相关因子2(Nuclear Factor-erythroid 2 Related Factor 2,Nfe2l2))基因Nfe2l2、血红素加氧酶-1(Heme Oxygenase-1,HO-1)、谷氨酸-半胱氨酸连接酶催化亚基(Glutamate-Cysteine Ligase Catalyticsubunit,GCLc)和调节亚基(GCLm)mRNA表达。采用荧光素酶报告基因系统检测抗氧化反应元件(Antioxidant Response Element,ARE)活性。结果:镇肝熄风汤含药血清抑制了6-OHDA诱导的氧化应激,上调了6-OHDA处理细胞中Nfe2l2、HO-1和GCLc mRNA表达,但是对GCLm mRNA表达没有显著影响。结论:镇肝熄风汤含药血清对6-OHDA诱导PC12细胞氧化应激具有保护作用,其机制可能与上调Nfe2l2 mRNA表达,使ARE激活进一步诱导其下游II相解毒酶基因和抗氧化酶基因HO-1和GCLc mRNA表达有关。
镇肝熄风汤6-羟基多巴胺活性氧簇Nfe2l2抗氧化反应元件含药血清
帕金森病(Parkinson's Disease,PD)是以中脑黑质多巴胺(Dopamine,DA)能神经元变性死亡为主要病理改变的运动障碍性疾病[1]。目前黑质多巴胺能神经元变性确切的发病机制还不完全清楚。近期研究表明,PD的多种致病因素均可通过氧化应激这一共同通路造成神经元的损伤,氧化应激反应是PD的发病的重要机制[2,3]。因此,减轻多巴胺能神经元氧化应激是治疗PD的重要策略[4]。许多学者认为某些PD的中草药疗法与其抗氧化作用密切相关,因而从中药方剂中研究基于抗氧化活性的PD治疗药物具有重要意义[5]。中医学认为PD病机为“肝肾阴虚为本,肝风内动为标”[6]。中医通过辨证与辨病相结合治疗PD取得了显著疗效[7]。本课题组前期在附子汤灌胃联合6-OHDA单侧损毁黑质法复制的PD肝阳上亢型大鼠模型上发现镇肝熄风汤具有显著改善PD模型动物行为的作用[8],但其机制尚不清楚。本研究旨在验证“镇肝熄风汤激活Nrf2-ARE抗氧化系统是其抑制PD相关神经毒素致神经元氧化应激的重要机制”的假说。
1 材料和方法
1.1 材料
1.1.1 主要仪器与试剂
Stratagene Mx3005P Real-time PCR仪(美国Agilent公司);Safire2全波长多功能酶标仪(瑞士Tecan公司)。
OXiSelect™细胞内活性氧检测试剂盒(美国Cell Biolabs公司,批号:59342027);Dual-Glo®荧光素酶检测系统(美国Promega公司,批号:0000077661);Fu-GENE®6转染试剂(Promega公司,批号:0000095764);PRL-TK Vector(美国Promega公司,批号:0000078004);PGL4.37[LUC2P/ARE/Hygro]vector(美国Promega公司,批号:0000125536);TRLzol Reagent(美国Ambion公司,批号:87804);untra SYBR Mixture(with Rox)Kit(北京康为世纪公司,批号:00151503);Prime Script™RT reagent kit(日本TaKaRa Bio株式会社,批号:BK4001)。Nfe2l2上游引物5′-TGC CCC TGG AAG TGT CAA A-3′,下游引物5′-GGC TGT ACT GTA TCC CCA GAA GA-3′;HO-1上游引物5′-TGC TCG CAT GAA CAC TCT G-3′,下游引物5′-TCC TCT GTC AGC AGT GCC T-3;GCLc上游引物5′-GGC AAG ATA CCT TTA TGA CCA GTT-3′,下游引物5′-TGC AGC ACT CAA AGC CAT AA 3′;GCLm上游引物5′-AGA CAA AAC ACA GTT GGA GCA G-3′,下游引物5′CAG TCA AAT CTG GTG GCA TC-3′;GAPDH上游引物5′-GAC AAC TTT GGC ATC GTG GA-3′,下游引物5′-ATG CAG GGA TGA TGT TCT GG-3′由生工生物工程(上海)股份有限公司合成。
1.1.2 实验动物
清洁级健康雄性Wistar大鼠40只,体重220-240 g,由维通利华(北京)实验动物科技有限公司提供,用于含药血清和空白血清的制备。
1.1.3 药物
镇肝熄风汤由怀牛膝(批号:130501):代赭石(批号:30301):天冬(批号:13110):生龙骨(批号:130501)∶生白芍(批号:130401)∶生龟板(批号:140701)∶生牡蛎(批号:140701)∶元参(批号:130601)∶茵陈(批号:130201)∶川楝子(批号:140301)∶生麦芽(批号:130501)∶甘草(批号:130601)比例为60∶60∶30∶30∶30∶30∶30∶30∶12∶12∶12∶9,煎煮2次后将药液合并浓缩,中药饮片均购自哈尔滨市盛泰中药饮片加工厂;6-OHDA(Santa Cruz公司,批号:#D2312)。
1.1.4 含药血清制备[9]
大鼠随机分为空白对照组、镇肝熄风汤低(8 g·kg-1)、中(16 g·kg-1)和高剂量组(32 g·kg-1),每组10只。适应性喂养3天后,镇肝熄风汤组大鼠连续7天灌胃给药,每天2次;空白血清对照组则给予等体积生理盐水。大鼠末次给药1h后经戊巴比妥钠麻醉,腹主动脉采血,3 500 r·min-1离心15 min,收集血清,同组大鼠的血清混合。血清在56℃水浴灭活30 min,0.22 μm millex®GP针头式过滤器除菌分装,-20℃冻存。
1.2 实验方法
1.2.1 检测细胞内ROS水平
PC12细胞药物处理24 h后收集细胞,按照OXiSelect™细胞内活性氧检测试剂盒的操作说明,用荧光探针DCFH-DA标记细胞,利用荧光酶标仪在480 nm激发波长和530 nm发射波长下测定DCF的荧光值。
1.2.2 荧光素酶报告系统检测ARE活性
将PRL-TK Vector和PGL4.37[LUC2P/ARE/Hygro] vector用FuGENE®6转染实际共转染于PC12细胞中,24 h后加入10%的镇肝熄风汤含药血清或空白血清1 h后,加100 μM 6-OHDA共孵育24 h,用检测试剂盒Dual-Glo®荧光素酶检测系统,按照说明书利用全自动酶标仪进行萤火虫荧光和海肾荧光检测,计算标准化后荧光素酶的活性。
1.2.3 Real-time PCR检测Nfe2l2、HO-1、GCLc和GCLmmRNA表达
PC12细胞药物处理24 h后,收集细胞。采用TRIZOL方法提取总RNA,采用SYBR法按照untra SYBR Mixture(with Rox)Kit说明书在Stratagene Mx3005P Real-time PCR仪上进行PCR反应。采用2-ΔΔCt方法计算基因相对表达量。
1.2.4 统计分析
应用SPSS 13.0软件包进行数据分析,结果用xˉ±s表示。多组间均数比较采用单因素方差分析,均数间两两比较用SNK检验,以P<0.05为差异有统计学意义。
2 实验结果
2.1 镇肝熄风汤含药血清抑制了6-OHDA诱导PC12细胞氧化应激
DCFH-DA荧光探针染色法检测结果显示:与空白血清对照组比较,模型组ROS水平显著升高(P<0.05);与模型对照组比较,10%的低剂量、中剂量和高剂量镇肝熄风汤含药血清组ROS水平显著降低(P<0.05),且呈剂量依赖性(图1)。
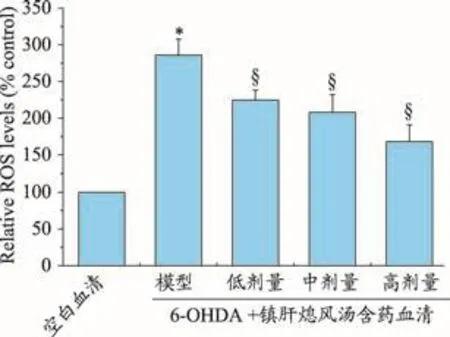
图1 镇肝熄风汤含药血清对6-OHDA处理的PC12细胞中ROS水平的影响
2.2 镇肝熄风汤含药血清上调了6-OHDA处理的PC12细胞中Nfe2l2mRNA表达和ARE转录活性
实时定量PCR检测结果显示:6-OHDA对PC12细胞Nfe2l2 mRNA表达无显著影响,而10%的低剂量、中剂量和高剂量镇肝熄风汤含药血清呈剂量依赖性地上调了PC12细胞Nfe2l2 mRNA表达(P<0.05)(图2A)。荧光素酶报告系统检测结果显示:与空白血清对照组比较,模型组ARE荧光素酶活性代偿性升高(P<0.05)。与模型对照组比较,10%的低剂量、中剂量和高剂量镇肝熄风汤含药血清组呈剂量依赖性的增加了ARE荧光素酶的活性(P<0.05)(图2B)。
2.3 镇肝熄风汤含药血清在转录水平上调6-OHDA处理的PC12细胞中Ⅱ相解毒酶的表达
实时定量PCR检测结果显示:6-OHDA对PC12细胞HO-1、GCLc和GCLm mRNA表达无显著影响,而10%的中剂量和高剂量镇肝熄风汤含药血清呈剂量依赖性地上调了PC12细胞HO-1和GCLcmRNA表达(均P<0.05),10%的低剂量镇肝熄风汤含药血清也上调了PC12细胞GCLc mRNA表达(P<0.05)(图3)。
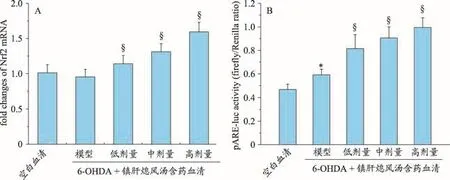
图2 镇肝熄风汤含药血清对6-OHDA处理的PC12细胞中Nrf2-ARE抗氧化系统的影响
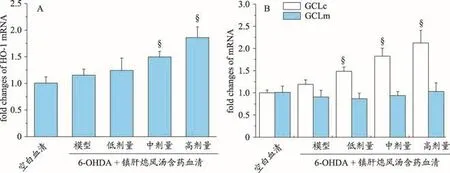
图3 镇肝熄风汤含药血清对6-OHDA处理的PC12细胞HO-1、GCLc和GCLm mRNA表达的影响
3 讨论
PD的发病机制可能涉及遗传缺陷、兴奋性氨基酸毒性作用、环境毒性作用、线粒体功能障碍和氧化应激等因素。已有越来越多的证据提示,氧化应激可能是PD多种致病因素的共同病理基础[10]。本研究的实验结果支持了我们的假说,表明Nrf2-ARE抗氧化系统介导的抗氧化活性可能是镇肝熄风汤抗PD的主要机制。
PD属中医学“颤证”范畴,古代医家多从肝、肾、风方面治疗。例如《素问》云:“肾者,作强之官,伎巧出焉”;《灵枢》有曰:“髓海有余,则轻劲多力,自过其度”。肾藏精生髓,肾精亏虚则脑髓失充,出现肢体运动障碍。肝主筋,肝阴不足,筋脉失濡则拘急痉挛。肝肾阴虚动风,同气相求则震颤抖动。现代多数医家认为,PD病机关键是肝肾阴虚,虚风内动。因此,滋养肝肾、熄风定颤是其治疗大法[11]。
镇肝熄风汤出自清代名医张锡纯的《医学衷中参西录》,功用镇肝熄风,滋阴潜阳,是治疗肝阳化风证的经典方。镇肝熄风汤中牛膝归肝肾之经,补益肝肾。代储石、牡蛎和龙骨降逆潜阳,龟板、天冬、白芍和玄参滋阴潜阳。茵陈和川楝子清泄肝阳,生麦芽敛阴。临床应用镇肝熄风汤可改善阴虚阳亢的客观症状,对PD有一定疗效[12]。
许多学者认为氧化应激是PD发病的核心环节之一[13]。有研究报道自由基损害对多巴胺能神经元的变性发挥重要作用[14]。ROS作为氧化应激的产物,首先出现在线粒体中。当ROS大量累积时就会氧化重要的细胞结构如脂质、蛋白质及DNA,通过线粒体途径引起细胞凋亡,导致PD发生发展[15]。因此,抑制ROS对阻止PD发病具有重要意义。本研究发现镇肝熄风汤含药血清抑制了6-OHDA诱导PC12细胞中ROS产生,表明抗氧化作用可能是其发挥抗PD的机制之一。
Nrf2是调节细胞内抗氧化应激反应的关键转录因子,能够激活内源性抗氧化应答,是细胞抗氧化还原的中枢调节者[16]。ARE是位于抗氧化蛋白和Ⅱ相解毒酶基因上游调节区的一个DNA-启动子结合序列,而Nrf2是这一序列的激活因子[17]。Nrf2通过与ARE相互作用,诱导编码抗氧化蛋白和Ⅱ相解毒酶的表达,在细胞防御保护中发挥重要作用[18]。发现能调控Nrf2及其下游靶基因的中药方剂,从而发挥抗氧化损伤作用,是防治PD的重要策略。本研究在体外采用6-OHDA诱导PC12细胞损伤模型,观察发现镇肝熄风汤含药血清具有激活Nrf2/ARE抗氧化系统,进而诱导诱导了Ⅱ相酶HO-1和GCLc基因的表达,从而减少了6-OHDA诱导PC12细胞氧化应激。
1Ikeda K,Hirayama T,Takazawa T,et al.Transdermal Patch of Rotigotine Attenuates Freezing of Gait in Patients with Parkinson's Disease:An Open-Label Comparative Study of Three Non-Ergot Dopamine Receptor Agonists.Intern Med,2016,55(19):2765-2769.
2Bolner A,Micciolo R,Bosello O,et al.A Panel of Oxidative Stress Markers in Parkinson's Disease.Clin Lab,2016,62(1-2):105-112.
3Lin W C,Chou K H,Lee P L,et al.Brain mediators of systemic oxidative stress on perceptual impairments in Parkinson's disease.J Trans Med,2015,13:386.
4Sarrafchi A,Bahmani M,Shirzad H,et al.Oxidative stress and Parkinson's disease:New hopes in treatment with herbal antioxidants.Curr Pharm,2016,22(2):238-246.
5Witkin J M,Li X.Curcumin,an active constiuent of the ancient medicinal herb Curcuma longa L.:some uses and the establishment and biological basis of medical efficacy.CNS Neurol Disord Drug Targets,2013,12(4):487-497.
6赵俊杰,张伟,李涛,等.帕金森病的中医证候分析.陕西中医,2016,37(3):311-313.
7张俊龙,闫川慧.病证结合辨治帕金森病与帕金森综合征.辽宁中医杂志,2012,39(6):959-961.
8王晓丽,孙影,朱兰芹,等.镇肝熄风汤对帕金森病肝阳上亢证大鼠中脑Akt和GSK-3β磷酸化的影响.世界科学技术-中医药现代化,2016,18(8):1374-1378.
9许应星,吴承亮,吴岩,等.Wnt/β-catenin信号通路相关蛋白在补肾活血颗粒含药血清影响成骨细胞过程中的表达及意义.中国中西医结合杂志,2011,31(4):537-541.
10郑远鹏,鲍秀琦,孙华,等.NADPH氧化酶在帕金森病中的作用.中国新药杂志,2016,25(8):872-877.
11卢静敏,左进红,刘少南,等.熄风定颤丸治疗帕金森病有效性与安全性的系统评价与Meta分析.中药新药与临床药理, 2016,27(4):558-564.
12李哲,胡瀛宇,雒晓东.帕金森病中医治疗进展.世界科学技术-中医药现代化,2014,16(4):908-914.
13 Gaki G S,Papavassiliou A G.Oxidative stress-induced signaling pathways implicated in the pathogenesis of Parkinson's disease.Neuromolecular Med,2014,16(2):217-230.
14 Kidd P M.Parkinson's disease as multifactorial oxidative neurodegeneration:implications for integrative management.Altern Med Rev,2000,5(6):502-529.
15 Zuo L,Motherwell M S.The impact of reactive oxygen species and genetic mitochondrial mutations in Parkinson's disease.Gene, 2013,532(1):18-23.
16 Todorovic M,Wood S A,Mellick G D.Nrf2:a modulator of Parkinson's disease?J Neural Transm(Vienna),2016,123(6):611-619.
17 Zhao J,Shukla SJ,Xia M.Cell-Based Assay for Identifying the Modulators of Antioxidant Response Element Signaling Pathway.Methods Mol Biol,2016,1473:55-62.
18 Aliaghaei A,Khodagholi F,Ahmadiani A.Conditioned media of choroid plexus epithelial cells induces Nrf2-activated phase II antioxidant response proteins and suppresses oxidative stressinduced apoptosis in PC12 cells.J Mol Neurosci,2014,53(4):617-625.
Protective Effects of Zhen-Gan Xi-Feng Decoction-containing Serum on 6-OHDA-induced Oxidative Stress in PC12 Cells through Nrf2-ARE PathwayActivation
Zhao Xuemei1,Xu Tianjiao2,Dong Miaoxian2
(1.College of Pharmacy,Qiqihar Medical University,Qiqihar 161006,China; 2.Institute of Medicine,Qiqihar Medical University,Qiqihar 161006,China)
This paper was aimed to study the protective effects and related mechanisms of Zhen-Gan Xi-Feng(ZGXF) decoction containing serum on 6-OHDA-induced oxidative stress in PC12 cells.The ZGXF decoction containing rat serum with low-,medium-,and high-dose(8,16,or 32 g·kg-1)or blank serum was used to preprocess PC12 cells for 1 h,and cultured together with 100 μM 6-OHDA for 24 h.And then,cells were collected.The fluorescent probe 2',7'-dichlorofluorescin diacetate(DCFH-DA)and fluorescence microplate reader were used to detect the level of reactive oxygen species(ROS).Real-time quantitative PCR was used to analyze the mRNA expressions of nuclear factor erythroid 2-related factor 2(Nrf2),Nfe2l2,heme oxygenase-1(HO-1),glutamate-cysteine ligase catalytic subunit(GCLc),and GCL modulatory subunit(GCLm).The luciferase report gene system was used to detect the antioxidant response element (ARE)activation.The results showed that ZGXF decoction-containing serum inhibited the 6-OHDA-induced oxidative stress,upregulated the Nfe2l2,HO-1 and GCLc mRNA expressions in cells processed with 6-OHDA.However,it has no significant effect on GCLm mRNA expression.It was concluded that ZGXF decoction-containing serum had protective effects on 6-OHDA-induced oxidative stress in PC12 cells.Its mechanism may be correlated with the upregulation on Nfe2l2 mRNA expression,which activated ARE and further induced its downstream gene of phase II detoxifying enzyme, as well as the HO-1 and GCLc mRNA expressions of antioxidant enzyme gene.
Zhen-Gan Xi-Feng decoction,6-hydroxydopamine,reactive oxygen species,Nfe2l2,antioxidant response element,drug-containing serum
10.11842/wst.2017.03.017
R285.5
A
(责任编辑:马雅静,责任译审:王晶)
2017-02-20
修回日期:2017-02-00
*国家自然科学基金委面上项目(81373629):基于PI3K/Akt/GSK-3β信号通路的镇肝熄风法抑制帕金森病氧化应激损伤的机制研究,负责人:董妙先。
**通讯作者:董妙先,主任医师,主要研究方向:中药药理学研究。

