基于抗心肌缺血作用的金花葵制备物药物质量表征分析*
谭立,孔静,冯朵,刘璐,吕珊,张元元,石任兵,2
(1.北京中医药大学中药学院/国家中医药管理局中药经典名方有效物质发现重点实验室北京100102;2.北京市教委中药质量控制技术工程中心北京100102)
基于抗心肌缺血作用的金花葵制备物药物质量表征分析*
谭立1,孔静1,冯朵1,刘璐1,吕珊1,张元元1,石任兵1,2**
(1.北京中医药大学中药学院/国家中医药管理局中药经典名方有效物质发现重点实验室北京100102;2.北京市教委中药质量控制技术工程中心北京100102)
目的:优选金花葵最佳药物制备物形式,为金花葵抗心肌缺血药物的研究开发提供科学依据。方法:建立HPLC-PDA法测定金花葵制备物有效指标性成分的含量。抗心肌缺血作用考察采用垂体后叶素致大鼠急性心肌缺血模型。对金花葵制备物进行基于药学、药效的药物质量表征及关联分析。结果:所建立HPLC含量测定方法通过方法学验证,平均加样回收率在97.04%-102.44%之间;金花葵3种制备物均表现出不同程度的抗心肌缺血作用,其中富集物抗心肌缺血作用最强,而得率最低、药物用量最小,为金花葵抗心肌缺血药物最佳制备物形式。结论:基于药物体系架构的金花葵制备物富集物,有关药物成分的含量较高、相对比值较为合理,呈现优质药物质量表征。因此,基于药物体系导向药物制备,有针对性地提高有关药物成分含量、探寻其最佳组成比例是提升中药药物药效的关键。
金花葵制备物抗心肌缺血质量表征药学-药效关联分析
金花葵(Aurea Helianthus)为一年生草本锦葵科秋葵属植物,具有清利湿热、消炎镇痛之功效[1]。现有研究多集中在其总黄酮上,活性表征为镇痛抗炎、免疫调节、抗氧化、延缓衰老等[2-5]。本课题组前期研究发现了金花葵抗心肌缺血药物体系,并基于酚类特征有效指标性成分进行了药材质量评价研究[6],继而建立了金花葵药物制备物有关指标性成分HPLC含量测定方法,并运用课题组所建立的药物体系导向制备物质量评价模式[7-14],对金花葵药物制备物进行基于主要有效指标性成分的含量、含量相对比值、相对制备量以及出膏率、抗心肌缺血药效作用的金花葵药物制备物质量表征及关联分析,发现绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷为其特性成分及其对抗心肌缺血药效作用的影响,为金花葵优质抗心肌缺血药物的创制及其质量精准控制提供科学依据。
1 材料与方法
1.1 材料
KQ-500DE超声波清洗器(100 W,昆山超声仪器有限公司);Waters 2695自动进样高效液相色谱仪,Waters 2996 PDA检测器,Empower Pro软件系统(美国Waters公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);HH-S型电热恒温水浴锅(北京长风仪器仪表公司);1/100 000电子分析天平(北京赛多利斯仪器有限公司)。
绿原酸(批号:131125)、异槲皮苷(批号:140329),纯度均≥98%,购自北京方程生物科技有限公司;芦丁(批号:YN1103SA14)、金丝桃苷(批号:RA0504FA14)、槲皮素(批号:YA0806YB13)、胞苷(批号:MM0316YA12)、尿苷(批号:TM0313XA13)、腺苷(批号:KM0529CA14),纯度均不低于98%,购自上海源叶生物科技有限公司;甲醇、乙腈均为色谱级(美国Fisher公司);水为娃哈哈纯净水;其余试剂均为分析纯。
1.2 试验药物
复方丹参滴丸(批号:140207,天士力制药集团股份有限公司);垂体后叶素注射液(国药准字H31022259,上海第一生化药业有限公司);肌酸激酶(CK)与乳酸脱氢酶(LDH)试剂盒购自南京建成生物工程研究所。金花葵药材购自山东圣达生物科技有限公司,现存于北京中医药大学中药化学系。
金花葵药物制备物包括按照金花葵药物制备工艺对金花葵药材进行水提取得到的金花葵水提取物、醇提取得到的金花葵醇提取物,及将醇提取物经大孔吸附树脂富集得到的富集物。其中,富集物是指将醇提取物水溶解至一定浓度后,上样于固定径高比大孔吸附树脂柱,经水洗除杂后用醇按最佳流速洗脱一定体积,收集洗脱部分,蒸干。
1.3 实验动物
实验选用SPF级SD大鼠(由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2012-0001)。体重190-210 g,雌雄各半。
2 实验方法
2.1 含量测定方法的建立
2.1.1 对照品溶液的制备
分别取绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷对照品适量,精密称定,甲醇溶解并定容至棕色容量瓶中,制得含绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素浓度分别为0.003 1、0.022 0、0.215 6、0.095 8、0.021 7 mg·mL-1的混合对照品溶液I(酸性系统);20%甲醇溶解并定容至棕色容量瓶中,制得含胞苷、尿苷、腺苷浓度为0.0135、0.0349、0.0208mg·mL-1的混合对照品溶液II(中性系统),摇匀,0.45 μm微孔滤膜滤过,取续滤液即得。
2.1.2 供试品溶液的制备
取金花葵醇提取物适量,精密称定,置10 mL棕色容量瓶中,甲醇溶解并定容(用于酸性系统下的含量测定),20%甲醇溶解并定容(用于中性系统下的含量测定),摇匀,0.45 μm微孔滤膜滤过,取续滤液即得。
2.1.3 色谱条件及系统适应性
酸性系统:WatersSymmetryC18色谱柱(4.6×250mm, 5 μm);检测波长为330 nm(绿原酸)、360 nm(芦丁、金丝桃苷、异槲皮苷、槲皮素);流速:1.0 mL·min-1,柱温:35℃;进样体积:20 μL;运行时间:60 min。流动相:乙腈(A)-0.05%磷酸水(B)梯度洗脱,10%-17%A(0-20 min),17%-22%A(20-50 min),22%-35%(50-60 min)。
中性系统:Waters Xbridge TM shield C18色谱柱(4.6×250 mm,5 μm);检测波长为260 nm;流速:1.0 mL·min-1,柱温:30℃;进样体积:20 μL;运行时间:30 min。流动相:甲醇(A)-水(B)梯度洗脱,0.5%-0.5%A(0-7 min),0.5%-2%A(7-8 min),2%-2%A(8-20 min),2%-9%A(20-23 min),9%-9%A(23-30 min)。
在上述酸性系统和中性系统色谱条件下,各指标性成分在各自检测波长下与其它色谱峰分离度良好(图1、图2)。
2.1.4 线性关系考察
取混合对照品溶液I和II,分别精密进样0、5、10、15、20、25 μL,分别按照“2.1.3”的色谱条件进行检测,以各指标性成分的峰面积(Y)为纵坐标,进样量(X)为横坐标绘制标准曲线,求得回归方程。结果见表1。
2.1.5 精密度考察
取同一供试品溶液,连续进样6次,分别按“2.1.3”酸性系统和中性系统色谱条件进行测定,计算得到绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷峰面积的RSD分别为2.13%、2.06%、1.23%、0.67%、2.33%、1.53%、0.95%、1.22%,表明仪器精密度良好。
2.1.6 稳定性考察
取同一供试品溶液,分别于制备后0、2、4、8、12、24 h进样,分别按“2.1.3”酸性系统和中性系统色谱条件进行测定,计算得到绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷峰面积的RSD分别为2.37%、1.08%、0.93%、1.99%、2.06%、1.71%、1.68%、2.01%,表明供试品溶液在24 h内稳定性良好。
2.1.7 重复性考察
取同一金花葵醇提取物6份,精密称定,按“2.1.2”制备供试品溶液。分别按“2.1.3”酸性系统和中性系统色谱条件进行测定,测得绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷的平均含量分别为0.03%、0.29%、3.46%、1.99%、0.30%、0.11%、0.50%、0.32%,RSD分别为2.06%、1.95%、1.28%、1.98%、2.74%、2.81%、2.93%、2.83%,表明重复性试验符合要求。
2.1.8 加样回收率考察
取已知各指标性成分含量的金花葵醇提取物6份,分别加入一定量的相应对照品,按“2.1.2”制备供试品溶液。分别按“2.1.3”酸性系统和中性系统色谱条件进行测定,计算得绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷的加样回收率分别为97.04%、101.02%、102.44%、100.03%、99.39%、100.87%、99.33%、98.84%,RSD为0.53%、1.06%、1.47%、1.85%、2.08%、2.76%、2.98%、1.39%,表明加样回收率合格。

图1 金花葵酸性系统下HPLC色谱图

图2 金花葵中性系统下HPLC色谱图
2.2 抗心肌缺血药效学实验方法
本研究选用大鼠舌下静脉注射脑垂体后叶素致急性心肌缺血模型[15,16],以金花葵不同制备物等生药量下灌胃给药,给药组灌胃相应药液,空白组和模型组灌胃等体积蒸馏水,连续给药6天。第7天灌胃1 h后除空白组不作处理外,其余各组动物均予以舌下静脉注射脑垂体后叶素4 U·kg-1造模。造模20 min后腹主动脉采血,4℃、3 500 rpm离心10 min,分离血清,比色法测定血清肌酸激酶(Creatine Kinase,CK)和乳酸脱氢酶(Laotic Dehydrogenase,LDH)活力。

表1 测定成分的回归方程、相关系数和线性范围(n=5)
3 结果与讨论
3.1 金花葵制备物药学质量表征
3.1.1 基于含量的质量表征
分别取金花葵3种制备物适量,精密称定,按“2.1.2”制备供试品溶液。金花葵药材供试品溶液由金花葵药材经完全提取后制得,按“2.1.3”酸性系统和中性系统色谱条件分别进行进样分析,测定各有效指标性成分的含量,结果如表2。
3.1.2 基于含量相对比值的质量表征
以芦丁的含量为基准,表征金花葵药材和不同制备物含量相对比值(各有效指标性成分含量与芦丁含量的比值),结果见表3。
3.1.3 基于制备物制备得率(相对于生药量)的质量表征
金花葵3种制备物的制备得率结果及其与富集物的相对比值见表4。
3.1.4 基于相对制备量的质量表征
以药材中各指标性成分含量为1,相对制备量用(含量×得率)表示,在相同生药量下,计算金花葵不同制备物中各有效指标性成分的相对制备量,结果见表5。

表2 金花葵制备物有效指标性成分含量/%

表3 金花葵制备物有效指标性成分含量相对比值

表4 金花葵制备物制备得率及与富集物比值
3.2 基于抗心肌缺血药效的金花葵制备物药效质量表征
按“1.3”项下方法进行金花葵制备物抗心肌缺血药效学实验,采用SPSS17.0统计软件进行分析,结果见表6。模型组两个指标含量均较正常组显著升高,二者有显著性差异(P<0.01),表明造模成功。复方丹参滴丸组和金花葵3种制备物组测得的CK、LDH与模型组相比有显著性差异(P<0.05或P<0.01),显示有抗心肌缺血作用。与金花葵富集物组比较,金花葵醇提物组、水提物组LDH值有显著性差异(分别为P= 0.032、0.047,均P<0.05);CK值水提物显示有差异趋势(P=0.179,0.05<P<0.2),醇提物无显著差异(P>0.05)。复方丹参滴丸组与金花葵富集物组比较LDH、CK值均无显著性差异(P>0.05)。综合以上并结合指标均值所显示的药效作用趋势可知,金花葵三个制备物以富集物抗心肌缺血药效最佳。

表5 金花葵制备物有效指标性成分相对制备量

表6 金花葵制备物抗心肌缺血作用结果(xˉ±s)
3.3 基于抗心肌缺血作用的金花葵提取物药学-药效质量表征关联分析
3.3.1 基于制备物制备得率的质量表征关联分析
由以上金花葵制备物药学质量表征可知,金花葵三种制备物制备得率大小为水提取物>醇提取物>富集物,在相同生药量下,金花葵富集物制备得率比其他制备物形式大幅减小,水提取物、醇提取物分别为其4.51倍、3.00倍。结合药效质量表征可知,富集物得率最低,服药量最小,其药效却最佳。较小的服药量更方便患者服用,可提供更多的剂型选择。
3.3.2 基于含量的质量表征关联分析
比较金花葵三种制备物中有效指标性成分含量变化情况(参比药材中含量),结果如图3所示。有效指标性成分在三种制备物中含量以富集物增幅最为明显,与原药材相比,富集物中有效指标性成分含量增幅为槲皮素(7.47倍)>芦丁(7.38倍)>异槲皮苷(6.46倍)>绿原酸(6.36倍)>腺苷(5.86倍)>金丝桃苷(4.95倍)>尿苷(4.52倍)>胞苷(2.15倍);与水提取物相比,富集物中有效指标性成分含量增幅为槲皮素(58.30倍)>金丝桃苷(17.32倍)>异槲皮苷(14.50倍)>芦丁(9.95倍)>腺苷(5.63倍)>绿原酸(4.09倍)>尿苷(2.85倍)>胞苷(1.94倍);与醇提取物相比,富集物中有效指标性成分含量增幅为腺苷(2.91倍)>槲皮素(2.72倍)>芦丁(2.51倍)>异槲皮苷(2.39倍)>绿原酸(2.26倍)>金丝桃苷(1.81倍)>尿苷(1.73倍)>胞苷(1.71倍)。关联药效分析,富集物中指标性成分含量最大,药效最强,各指标性成分含量较其他两种制备物增加幅度也有不同程度差别,提示各成分对发挥药效作用贡献度不同,在设计提取富集等制备工艺过程中,应关注有效成分的含量,特别是应重点关注增幅大的有效成分,保障其具有较高含量。
3.3.3 基于含量相对比值的质量表征关联分析
以芦丁含量为参比(设为1),将不同制备物中有效指标性成分含量与芦丁含量的比值予以表征,如图4。在金花葵不同制备物中,各有效指标性成分以不同的比例存在。与药材相比,各制备物中有效指标性成分含量相对比值均发生一定程度变化,富集物和醇制备物与水制备物相差较大。关联药效分析,金花葵制备物最佳药效对应制备物各指标性成分含量呈特殊比例。提示在金花葵制备物中,药物体系组成中有效成分之间的比例也是影响药效的重要因素。
3.3.4 基于相对制备量的质量表征关联分析
基于3.1.4项下和图5所示,以药材为参照,金花葵3种制备物中有效指标性成分的制备量比值均小于1,提示其均有不同程度的降低。随着制备工艺过程进行,制备物中各类成分的制备量均有不同程度损失,从原药材到醇提取物到富集物中逐渐降低。指标性成分绿原酸、尿苷制备量醇提物>水提物>富集物,胞苷制备量水提物>醇提物>富集物,其余均为醇提物>富集物>水提物。关联药效分析可知,富集物药效最佳,药物成分制备量在一定制备率范围内的降低,对药物药效未显现出关联影响。

图3 金花葵制备物有效指标性成分含量变化(以药材为参照)

图4 金花葵制备物中有效指标性成分含量相对比值表征
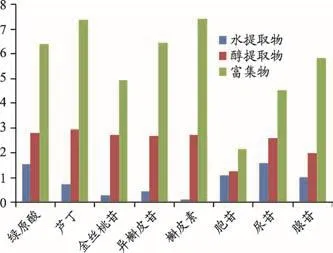
图5 金花葵制备物各有效指标性成分相对制备量的变化
4 结论
本研究分别通过HPLC-PDA法和复制脑垂体后叶素致大鼠急性心肌缺血模型对金花葵制备物药物进行了基于制备得率和主要有效指标性成分绿原酸、芦丁、金丝桃苷、异槲皮苷、槲皮素、胞苷、尿苷、腺苷的含量、含量相对比值、相对制备量以及抗心肌缺血药效作用的药学、药效质量表征,并进行了药学-药效关联分析。最终得出富集物抗心肌缺血药效最好,其药物成分含量较高,各有效指标性成分含量比例独特,且得率低,服药量小,为其药物最佳制备物形式。通过分析金花葵制备物中各有效指标性成分构成及比例可知在金花葵药物制备中,基于药物体系构架有效物质基础,对相关药物成分进行合理富集,有针对性地提高其含量、优化组成比例是提升中药药物质量的关键。本研究首次对金花葵抗心肌缺血制备物药物进行药学-药效表征及其关联分析研究,筛选出其最佳制备物药物形式,探讨了影响其药物质量的重要因素,为金花葵抗心肌缺血药物的创制奠定基础,为金花葵药物开发利用提供了一定思路。由于有效指标性成分并不能等同于制备物药物,所以金花葵抗心肌缺血制备物药物的具体药学-药效关系还有待于进一步结合其中大类类型成分构成进行更深入分析。
1卢丹,贾瑞波.中药金花葵的研究进展.中国药物评价,2015,32(2):90-92.
2吴正平.金花葵花总黄酮镇痛作用的实验研究.宜春学院学报, 2009,31(4):75-76.
3张建.金花葵花总黄酮解热抗炎作用的实验研究.中国医科大学学报,2011,40(8):763-764.
4杨秀松.金花葵粗黄酮提取物的免疫调节作用研究.中国药师, 2013,16(9):1307-1311.
5吴正平.金花葵花总黄酮对衰老模型小鼠抗氧化和免疫功能的影响.中国老年学杂志,2011,31(10):1800-1802.
6冯朵,谭立,彭平,等.基于药物体系的金花葵特征图谱质量表征关联分析研究.北京中医药大学学报,2016,39(4):308-315.
7石任兵,王永炎.自然药学观的相关性思考.北京中医药大学学报, 2012,35(4):221-225.
8石任兵,王永炎,吕松涛.基于自然药学观药物体系的中药药物本质相关性思考.北京中医药大学学报,2015,38(3):149-152.
9石任兵,王永炎,吕松涛.基于自然药学观药物体系的中药药物创新相关性思考.环球中医药,2015,8(3):257-260.
10安琪,唐雪阳,卢广英,等.紫苏方药物制备物的质量表征及其关联分析.北京中医药大学学报,2014,37(6):414-419,428.
11迟蕾,孙雅姝,杨书娟,等.芎芍方药物制备物的质量表征及其关联分析.北京中医药大学学报,2015,38(3):195-200,221.
12张璐,李焕娟,潘婷,等.远志汤药物制备物的质量表征及其关联分析.环球中医药,2015,8(3):260-265.
13梅莹莹,许舒娅,左胜,等.基于药物体系的连翘饮药物制备物质量表征分析研究.北京中医药大学学报,2014,37(5):337-343,366.
14李焕娟,张璐,权建野,等.基于药物体系的开心散药物制备物质量表征关联分析研究.北京中医药大学学报,2015,38(7):539-545,579.
15陈奇.中药药理研究方法学(第1版).北京:人民卫生出版社,1996, 564.
16卢志强,张艳军,崔广智,等.心肌缺血模型的制作方法研究进展.中国药理学通报,2012,28(8):1053-1057.
This study was aimed to select the best preparation form of Aurea Helianthus in order to provide a scientific basis for research and development of anti-myocardial ischemia drugs.The content of effective index components of preparation of Aurea Helianthus was detected using HPLC-PDA.Acute myocardial ischemia rat model introduced by injecting pituitrin was used to investigate the effect of anti-myocardial ischemia.The quality of preparation from Aurea Helianthus was characterized based on pharmacy and efficacy.And the characterized results were given correlation analysis.The results showed that the HPLC method for quantitative determination was verified by methodology.The average recoveries were in the range of 97.04%-102.44%.All three preparations of Aurea Helianthus had the efficacy of anti-myocardial ischemia in varying degrees.The enrichment had the highest effect with lowest extraction rate and the lowest dosage,which was the best form in medicinal-preparation application of Aurea Helianthus.It was concluded that the content of related drug components was higher with unique proportion in enrichment of Aurea Helianthus which was prepared based on drug system proved a high quality medicine.Therefore,the key to the improvement of efficacy was to explore the fittest proportion and improve the content of related pharmaceutical ingredients pertinently according to drug system.
Drug Quality RepresentationAnalysis of Preparations ofAurea Helianthus based onAnti-myocardial Ischemia Effect
Tan Li1,Kong Jing1,Feng Duo1,Liu Lu1,Lv Shan1,Zhang Yuanyuan1,Shi Renbing1,2
(1.Key Unit of Exploring Effective Substances of Classical and Famous Formulas of the State Administration of Traditional Chinese Medicine,School of Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China;2.Quality Control Technology and Engineering Center of Chinese Medicine, Beijing Municipal Commission of Education,Beijing 100102,China)
Preparation of Aurea Helianthus,anti-myocardial ischemia,quality characteristics,pharmacy-efficacy correlation analysis
10.11842/wst.2017.03.022
R282.5
A
(责任编辑:郭嫦娥,责任译审:王晶)
2017-01-15
修回日期:2017-03-14
*北京中医药大学重点学科开放课题(2013-ZDXKKF-23):中药特性化学,负责人:石任兵。
**通讯作者:石任兵,博士,教授,博士生导师,主要研究方向:中药药效物质基础与质量评价。

