橙皮苷对RAW264.7巨噬细胞泡沫化及ICAM-1表达的影响*
傅明明,郭姣
(广东药科大学中医药研究院国家中医药管理局高脂血症调肝降脂重点研究室/脂代谢三级实验室/广东省代谢性疾病中西医结合研究中心广州51006)
橙皮苷对RAW264.7巨噬细胞泡沫化及ICAM-1表达的影响*
傅明明,郭姣**
(广东药科大学中医药研究院国家中医药管理局高脂血症调肝降脂重点研究室/脂代谢三级实验室/广东省代谢性疾病中西医结合研究中心广州51006)
目的:探讨橙皮苷对RAW264.7巨噬细胞泡沫化及细胞间黏附因子-1表达的影响。方法:体外培养RAW264.7巨噬细胞,橙皮苷作用于未经诱导的RAW264.7巨噬细胞及ox-LDL(50 μg·mL-1)诱导后的RAW264.7巨噬细胞,将细胞分为空白对照组、ox-LDL模型组和橙皮苷给药组。MTT法检测不同浓度的橙皮苷对RAW264.7细胞活性的影响;用油红O染色观察橙皮苷对RAW264.7巨噬细胞内脂类堆积与泡沫细胞形成。观察橙皮苷对ox-LDL诱导RAW264.7巨噬细胞泡沫化的影响;免疫印迹法检测RAW264.7巨噬细胞中ICAM-1的蛋白表达。逆转录聚合酶链反应法检测RAW264.7巨噬细胞中ICAM-1的mRNA表达。结果:橙皮苷浓度大于或等于5 μM时,RAW264.7巨噬细胞存活率大于80%。橙皮苷抑制RAW264.7巨噬细胞泡沫化。橙皮苷能减少泡沫细胞的ICAM-1蛋白表达水平。橙皮苷能减少泡沫细胞ICAM-1 mRNA表达水平。结论:橙皮苷能抑制RAW264.7巨噬细胞泡沫化及ICAM-1的蛋白和mRNA表达,提示橙皮苷具有抗动脉粥样硬化临床应用价值。
橙皮苷RAW264.7巨噬细胞ICAM-1泡沫细胞
动脉粥样硬化(Atherosclerosis,AS)是一个复杂的多因素渐进性慢性炎症过程,单核细胞穿过动脉内皮层进入内膜并且吞噬脂质形成泡沫细胞是其形成的重要环节,细胞间黏附因子-1(Intercellular Cell Adhesion Molecule-1,ICAM-1)在这一环节中起着重要作用[1,2]。橙皮苷(Hesperidin)是一种生物类黄酮,主要存在在各种柑橘类水果中,也是中药佛手的主要活性成分[3]。研究表明,橙皮苷能降低人体的胆固醇水平,而且对血管通透性,脆性和对各种创伤和应激也有一定的保护作用[3,4],但橙皮苷对AS的作用及其作用机制未见相关研究报道。因此,本研究旨在通过观察橙皮苷对RAW264.7巨噬细胞泡沫化及ICAM-1表达的影响来探讨其防治AS的作用及可能机制,为临床防治AS提供理论依据。
1 材料与方法
1.1 主要仪器与试药
3111型CO2培养箱(美国Thermo公司);SW-CF-1FD型超净工作台(上海博讯实业有限公司医疗设备厂);940型多功能酶标仪(美国BioTek公司);TC9600-G-230V型多功能梯度PCR仪(深圳市赛泰克生物科技有限公司);3111型PikoReal荧光定量PCR仪(中国赛默飞世尔科技有限公司);BX51TRF型显微镜(日本Olympus公司)。
ICAM-1抗体(美国R&D公司,批号:GRG0216011);DMEM培养基和澳洲胎牛血清(美国Gibco公司,批号:8116107);Trizol RNA提取试剂盒和PrimeScriptTMRT Reagant Kit反转录试剂盒(日本Takara公司,批号:AK3601);ox-LDL(广州奕源生物科技有限公司,批号:160511);橙皮苷(纯度≥97.0%,美国Sigma公司,批号:BCBQ5716V),化学结构式见图1。
1.2 细胞培养与实验分组
实验中所用细胞为RAW264.7巨噬细胞株。细胞用DMEM培养基培养,加入10%胎牛血清(Fatal Bovine Serun,FBS),在含5%CO2的细胞孵育箱中培养。细胞融合达80%时进行细胞传代。将RAW264.7巨噬细胞分为3组:分别是空白对照组、模型组和橙皮苷给药组。用DMSO配制橙皮苷母液,使用前用DMEM培养基稀释至所需浓度;ox-LDL使用前用DMEM培养基稀释到50 μg·mL-1。各组细胞按各自条件CO2培养箱中37℃孵育24 h,进行实验分析。根据橙皮苷给药浓度根据细胞毒性实验结果,将RAW264.7细胞存活率大于80%的最高药液浓度作为橙皮苷给药组的最高浓度。
1.3 MTT法检测橙皮苷对RAW264.7巨噬细胞的存活率的影响
将RAW264.7巨噬细胞接种在96孔板上,分为空白组、对照组和橙皮苷不同剂量(100、50、25、10、5、2.5、1 μM)给药组,每组平行设5个孔,每孔100 uL,置于5%CO2培养箱中37℃孵育24 h后,移去培养上清液,避光加入10 μL MTT溶液(5 mg·mL-1)孵育4 h后除去上清,加入150 μL DMSO溶剂后振荡10 min,使甲臢充分溶解。用酶标仪在490 nm波长测定各孔光吸收值。经统计分析,确定药物安全浓度范围。
1.4 油红O染色
将细胞接种在铺有盖玻片的六孔板中,给药24 h后,移除培养基,PBS冲洗3次,4%多聚甲醛固定10 min。将固定好的细胞用PBS冲洗3次,60%异丙醇润洗1遍。将1%油红O原液与纯水按3∶2比例混合过滤后加入孔中,避光染色15 min,60%异丙醇洗1遍,纯水洗1次,然后用水溶性封片剂封片,光学显微镜下观察拍照。
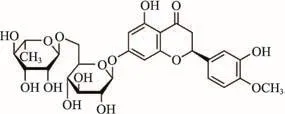
图1 橙皮苷的化学结构式
1.5 免疫印迹法
将处理好的细胞取出培养箱,移去培养基,冰PBS洗3次,加入RIPA裂解液,冰上静置30 min,裂解完成后,用细胞刮板将裂解液尽量刮下,4℃12000 rpm离心30 min,吸取上清移至新管。用BCA蛋白浓度测定试剂盒定量蛋白定量。以最低浓度一组为基准,将蛋白样品调至统一浓度后,加入上样缓冲液,于100℃变性10 min。用10%SDS-PAGE进行电泳;然后转至PVDF膜上,1×TBST洗3次,每次10 min,用5%的脱脂奶粉在室温下封闭1 h,用1×TBST洗3次后加入一抗(ICAM-1抗体,1∶10 000,1×TBST稀释),4℃孵育过夜。次日,加入二抗(辣根过氧化酶标记的兔抗羊(IgG 1∶10 000,1×TBST稀释),室温孵育1 h。孵育结束后,1×TBST洗3次,用化学发光法成像仪曝光成像。
1.6 逆转录聚合酶链反应
RAW264.7巨噬细胞按上述分组作用24 h后,倾去培养液,冰PBS洗3次,Trizol试剂提取细胞总RNA,溶于DEPC水中,-80℃保存。按Takara逆转录试剂盒10 μL体系试剂盒要求进行逆转录反应。选择β-actin作为内参,按Takara要求的加样体系进行RT-PCR反应。引物由苏州泓迅生物科技有限公司设计合成。ICAM-1上游引物:5′-TCCGCTACCATCACCGTGTAT-3′;下游引物:5′-TAGCCAGCACCGTGAATGTG-3′。β-actin上游引物:5′-ATGGAGGGGAATACAGCCC-3′;下游引物:5′-TTCTTTGCAGCTCCTTCGTT-3′。TNF-α上游引物:5'-AGGGTCTGGGCCATAGAACT-3′;下游引物:5′-CCACCACGCTCTTCTGTCTAC-3′。IL-1β上游引物:5′-TGCCACCTTTTGACAGTGATG-3′;下游引物:5′-ATGTGCTGCTGCGAGATTTG-3′。IL-6上游引物:5′-ACCAGAGGAAATTTTCAATAGGC-3′。下游引物:5′-TGATGCACTTGCAGAAAACA-3′。反应程序:预变性:95℃10 min;循环中95℃变性30 s;退火60℃30 s,40个循环,溶解曲线分析,测得的Ct值采用2-△△CT采法进行相对定量分析。
1.7 统计方法
实验数据以xˉ±s表示,采用Graphpad prism 6软件进行单因素方差样本t检验,P<0.05表示有显著性差异。
2 结果
2.1 MTT法确定橙皮苷作用于RAW264.7巨噬细胞的安全用药范围
RAW264.7细胞经不同浓度的橙皮苷处理后,观察药物对细胞的毒性程度,存活率小于80%视为此药物浓度对细胞有毒性[5-7]。图2显示橙皮苷在浓度大于5 μM时,细胞存活率小于80%,对细胞有毒性作用(P<0.01)。橙皮苷在浓度1-5 μM时,细胞存活率大于80%,与空白对照组相比没有显著性差异。因此选取5 μM作为细胞给药最高浓度,并在此浓度基础上用DMEM培养基对橙皮苷倍比稀释,最终确定1 μM、2.5 μM和5 μM作为细胞给药浓度。
2.2 橙皮苷对ox-LDL诱导RAW264.7巨噬细胞泡沫化的影响
油红O染色后在显微镜下观察显示,空白对照组细胞胞质内无脂滴堆积(图3A)。采用50 μg·mL-1ox-LDL诱导RAW264.7巨噬细胞24 h后,模型组细胞出现大量脂质堆积(图3A),符合泡沫细胞的形态特点,与空白组对照组相比有显著性差异(P<0.0001)。相比之下,经过橙皮苷(1-5 μM)处理后的RAW264.7细胞脂滴聚集的现象大幅度减轻,说明橙皮苷可显著抑制ox-LDL诱导的RAW264.7巨噬细胞泡沫化(P<0.05,P<0.01)。
2.3 橙皮苷对ox-LDL诱导RAW264.7巨噬细胞ICAM-1蛋白表达的影响
Western blot检测ICAM-1蛋白表达水平(图5)。结果表明用ox-LDL(50 μg·mL-1)诱导RAW264.7巨噬细胞的24 h后,ox-LDL模型组ICAM-1的蛋白表达高于空白组。但给予橙皮苷(1-5 μM)干预后,能降低ICAM-1蛋白的表达水平(P<0.01,P<0.001),说明橙皮苷能抑制ox-LDL诱导RAW264.7细胞ICAM-1蛋白的表达。
2.4 橙皮苷对ox-LDL诱导RAW264.7巨噬细胞ICAM-1、TNF-α、IL-6和IL-1βmRNA表达的影响
逆转录聚合酶链反应结果表明50 μg·mL-1ox-LDL诱导RAW264.7细胞24 h后,ox-LDL模型组中ICAM-1mRNA的表达高于空白组,统计学有显著差异(P<0.001)。但给予橙皮苷(1-5 μM)干预后能显著降低ICAM-1 mRNA的表达水平,与模型组比较,具有统计学意义(P<0.01,P<0.001)。巨噬细胞泡沫化会释放炎性因子,如TNF-α、IL-1β和IL-6,在组织炎性反应和病理过程中起重要作用,可加速AS斑块的炎性反应[8,9]。实验结果表明,给予橙皮苷(1-5 μM)干预后也能抑制炎性因子TNF-α、IL-1β和IL-6 mRNA的表达(图5B-C)。
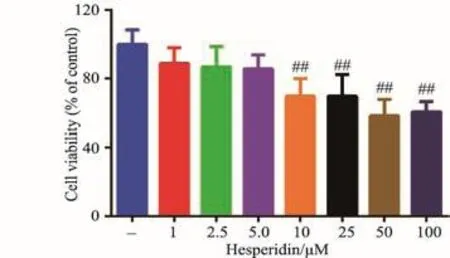
图2 MTT法检测橙皮苷对RAW264.7细胞生长活性的影响
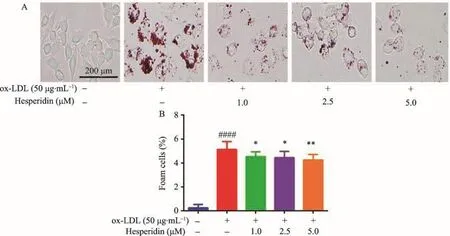
图3 RAW264.7巨噬细胞油红O染色结果(n=3)
3 讨论
在20世纪90年代初,罗斯博士提出了AS的慢性炎症假说[8]。他在1999年更进一步清楚地认为AS是一种炎症性疾病[9]。随着越来越多的炎症细胞和介质不断地被检测到,AS不再被认为是一种脂质沉积到动脉壁上的简单疾病,而是血管壁内的进行性炎症反应[10]。在危险因素如高胆固醇血症、胰岛素抵抗或肥胖等持续作用,内皮细胞中粘附分子表达增加,促使单核细胞与动脉内皮细胞间的粘附能力增强,导致单核细胞转化为具有吞噬作用的巨噬细胞,摄取脂质(主要是ox-LDL)形成泡沫细胞,致使AS早期的脂质条纹形成[11,12]。泡沫细胞坏死释放出脂质形成脂核,进一步形成斑块,被活化的细胞释放促炎症因子,导致慢性炎症和斑块的不稳定性,并进一步发展为斑块破裂和继发性血栓形成,甚至引发急性临床事件,造成严重后果[2,13]。所以,巨噬细胞的泡沫化是AS形成的关键环节,而对巨噬细胞泡沫化过程的干预,可以起到防治AS的效果[14]。
ICAM-1是I型跨膜糖蛋白,属于免疫球蛋白(Ig)超家族。它存在于AS病变中并且参与AS病变的进展。在AS斑块的形成过程中,单核细胞对血管内皮细胞的粘附是前者进入内皮下间隙进而转变为泡沫细胞的关键步骤[1,15]。研究表明ICAM-1在细胞表面上的交联导致信号转导并导致几种促炎症信号级联,进一步加剧炎症反应,引起更加严重的病变[15]。
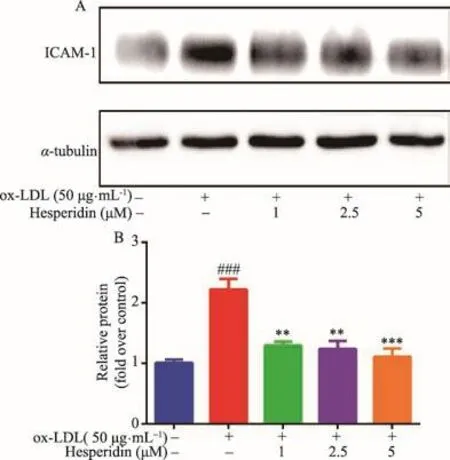
图4 橙皮苷对ox-LDL诱导RAW264.7巨噬细胞ICAM-1蛋白表达的影响
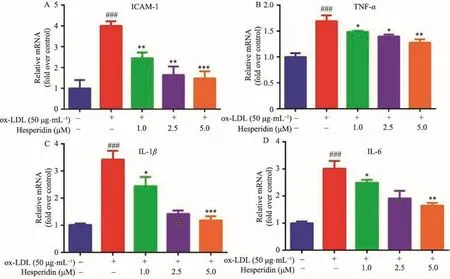
图5 橙皮苷对ox-LDL诱导RAW264.7巨噬细胞ICAM-1、TNF-α、IL-1β和IL-6 mRNA表达的影响
橙皮苷是一种柑橘类水果中含量丰富的生物黄酮类化合物。近年来因其多样的生物活性引起了许多研究者的关注[16]。研究显示橙皮苷具有维持患者渗透压、增强患者毛细血管的韧性、降低胆固醇等方面作用[17,18]。越来越多报道橙皮苷对心血管疾病有改善作用[19-21]。最近研究表明橙皮苷可剂量依赖性地调节高脂血症模型大鼠血脂水平及血液粘滞状态,提示橙皮苷对防治高脂血症具有积极作用[22]。
本实验采用巨噬细胞系RAW264.7细胞作为研究对象,并通过oxLDL刺激活化巨噬细胞。结果显示,橙皮苷(1-5 μM)能有效地抑制巨噬细胞的泡沫化并能明显降低RAW264.7细胞中ICAM-1的蛋白和mRNA水平的表达,从而可能抑制巨噬细胞与内皮细胞间的黏附,减少细胞泡沫化。本研究提示橙皮苷可能通过抑制ICAM-1表达来发挥其抗巨噬细胞泡沫化作用,为深入研究橙皮苷对于AS发病机制和防治提供了新的实验依据。
1Kitagawa K,Matsumoto M,Sasaki T,et al.Involvement of ICAM-1 in the progression of atherosclerosis in APOE-knockout mice.Atherosclerosis,2002 160(2):305-310.
2Libby P,Ridker P M,Hansson G K.Inflammation in atherosclerosis:from pathophysiology to practice.J Am Coll Cardiol,2009,54(23):2129-2138.
3Wang X,Hasegawa J,Kitamura Y,et al.Effects of hesperidin on the progression of hypercholesterolemia and fatty liver induced by high-cholesterol diet in rats.J Pharmacol Sci,2011,117,(3):129-138.
4Assini J M,Mulvihill E E,Huff M W.Citrus flavonoids and lipid metabolism.Curr Opin Lipidol,2013,24(1):34-40.
5López-García J,Lehocký M,Humpolíček P,et al.HaCaT keratinocytes response on antimicrobial atelocollagen substrates:extent of cytotoxicity,cell viability and proliferation.J Funct Biomater,2014,5(2):43-57.
6Mahmoudi M,Hofmann H,Rothen-Rutishauser B,et al.Assessing the in vitro and in vivo toxicity of superparamagnetic iron oxide nanoparticles.Chem Rev,2012,112(4):2323-2338.
7Andresguerrero V,Arangogonzalez B,Ramsay E,et al.Polyesteramide microspheres as carriers in ophthalmology.in vitro toxicity in macrophages,ARPE-19 cells and an organotypic culture of retina.Invest Ophth Vis Sci,2014,55(13):4900.
8Ross R.Atherosclerosis-an inflammatory disease.N Engl J Med,1999, 340(2):115-126.
9Ross R,Glomset J A.The pathogenesis of atherosclerosis--an update. N Engl J Med,1986,314(8):488-500.
10 Williams K J,Tatas I.Atherosclerosis and inflammation.Curr Atheroscler Rep,2002,4(2):92-98.
11 Moore K J,Sheedy F J,Fisher E A.Macrophages in atherosclerosis:a dynamic balance.Nat Rev Immunol,2013,13(10):709-721.
12 Yuan Y,Li P,Ye J.Lipid homeostasis and the formation of macrophagederived foam cells in atherosclerosis.Protein Cell,2012,3(3):173-181.
13 Schulz C,Massberg S.Atherosclerosis-multiple pathways to lesional macrophages.Sci Transl Med,2014,6(239):239ps2.
14 Lind L.Circulating markers of inflammation and atherosclerosis.Atherosclerosis,2003,169(2):203-214.
15 Frank P G,Lisanti M P.ICAM-1:role in inflammation and in the regulation of vascular permeability.Am J Physiol Heart Circ Physiol,2008, 295(3):H926-H927.
16 Pereira-Caro G,Borges G,van der Hooft J,et al.Orange juice(poly)phenols are highly bioavailable in humans.Am J Clin Nutr,2014,100(5):1378-1384.
17 Akiyama S,Katsumata S-i,Suzuki K,et al.Hypoglycemic and hypolipidemic effects of hesperidin and cyclodextrin-clathrated hesperetin in Goto-Kakizaki rats with type 2 diabetes.Biosci Biotechnol Biochem, 2014,73(12):2779-2782.
18 Ahmed R R,Mahmoud A M,Shour M B,et al.Hesperidin protects against diethylnitrosamine-induced nephrotoxicity through modulation of oxidative stress and inflammation.Nat J Physiol Pharm Pharmacol, 2015,5(5):391-397.
19 Agrawal Y O,Sharma P K,Shrivastava B,et al.Hesperidin produces cardioprotective activity via PPAR-γpathway in ischemic heart disease model in diabetic rats.PloS One,2014,9(11):e111212.
20 Morand C,Dubray C,Milenkovic D,et al.Hesperidin contributes to the vascular protective effects of orange juice:a randomized crossover study in healthy volunteers.Am J Clin Nutr,2011,93(1):73-80.
21 Schär M Y,Curtis P J,Hazim S,et al.Orange juice-derived flavanone and phenolic metabolites do not acutely affect cardiovascular risk biomarkers:a randomized,placebo-controlled,crossover trial in men at moderate risk of cardiovascular disease.Am J Clin Nutr,2015,101(5):931-938.
22李雄英,素红,吕圭源.橙皮苷对脂肪乳剂致高脂血症模型大鼠血脂及血液流变学的影响.浙江中医药大学学报,2013,37(3):308-312.
Effects of Hesperidin on RAW264.7 Foam Cell FormationAnd Expression of ICAM-1
Fu Mingming,Guo Jiao
(Key Laboratory of Regulating Liver to Low Lipid for Hyperlipidemia Treatment/Third-level Lipid Metabolism Laboratory,State Administration of Traditional Chinese Medicine,Institute of Chinese Medical Sciences, Guangdong Pharmaceutical University/Guangdong Metabolic Disease Research Center of Integrated Chinese and Western Medicine Institute of Chinese and Western Medicine,Guangzhou 510006,China)
This study was aimed to investigate the effects of hesperidin on the macrophage foam cell formation in RAW264.7 cells and the expression of ICAM-1.RAW264.7 cells were culture in vitro and induced by oxLDL(50 μg·mL-1). Furthermore,cells were separated into the control group,oxLDL model group and hesperidin treatment group.The effect of hesperidin on cell viability in RAW264.7 was assessed by MTT assay.Oil Red O staining was examined by foam cells formation.Effect of hesperidin on protein expression of ICAM-1 was analyzed by western blot.In addition,the effect of hesperidin on mRNA expression of ICAM-1 was assessed by RT-PCR.The results showed that the viability should been over 80%after less than or equal to 5 μM hesperidin treatment.Hesperidin decreased the protein expression of ICAM-1 in RAW264.7 cells.Additionally,hesperidin suppressed the mRNA expression of ICAM-1 in RAW264.7 cells.It was concluded that hesperidin can inhibit foam cell formation and the expression of ICAM-1 in RAW264.7 cells.It suggested that hesperidin protect against atherosclerosis.
Hesperidin,RAW264.7 cells,ICAM-1,foam cells
10.11842/wst.2017.03.015
R285.5
A
(责任编辑:郭嫦娥,责任译审:王晶)
2017-03-11
修回日期:2017-03-17
*广东省科学技术厅2015年度省协同创新与平台环境建设专项资金项目(2015A050502050):基于糖组学技术的组分中药调节糖脂代谢的机制研究,负责人:郭姣;广东省科学技术厅2016年省科技发展专项资金(协同创新与平台环境建设方向)项目(2016B050501003):代谢病中西医结合防治国际合作基地建设,负责人:郭姣。
**通讯作者:郭姣,博士,教授,主要研究方向:中西医结合防治糖脂代谢病研究。

