大黄素诱导自噬改善顺铂导致肾小管细胞损伤机制探索*
刘红,孙伟,顾刘宝
(1.武汉市第一医院武汉430022;2.江苏省中医院南京中医药大学附属医院南京210029;3.江苏省省级机关医院江苏省老年医学研究所南京210024)
大黄素诱导自噬改善顺铂导致肾小管细胞损伤机制探索*
刘红1,孙伟2**,顾刘宝3
(1.武汉市第一医院武汉430022;2.江苏省中医院南京中医药大学附属医院南京210029;3.江苏省省级机关医院江苏省老年医学研究所南京210024)
目的:观察大黄素对顺铂所致的肾小管上皮细胞(NRK-52E)损伤的影响,探讨其可能分子调节机制。方法:观察大黄素对顺铂所致NRK-52E细胞形态学改变的影响;采用Western Blot方法检测顺铂单独处理和加入大黄素共同处理细胞后,凋亡相关蛋白Caspase-3和cleaved Caspase-3的表达情况;用大黄素干预细胞不同的时间点,观察微管相关蛋白1轻链3(LC3)II/I的表达和pmRFP-LC3质粒转染细胞后荧光颗粒的变化情况,同时观察雷帕霉素处理细胞不同时间点后LC3-II/I的表达情况及其对顺铂环境下细胞形态学改变的影响,并观察大黄素对自噬上游通路AMPK的活化和mTOR信号的影响。结果:顺铂可以诱导NRK-52E细胞出现形态学改变,大黄素能够改善顺铂导致的变化。另外,大黄素干预可以下调顺铂导致的cleaved Caspase-3蛋白表达的增多;大黄素处理细胞不同时间点LC3-II/LC3-I的比值明显上升,pmRFP-LC3转染观察到大黄素处理细胞后自噬颗粒明显增多。同时雷帕霉素处理细胞后LC3-II/LC3-I的比值明显上升,其与顺铂共同干预能明显改善顺铂诱导的细胞凋亡;大黄素干预时间的延长,p-mTOR蛋白表达明显下调,p-AMPK的表达明显上调。结论:大黄素可以改善顺铂诱导的NRK-52E细胞凋亡,其作用机制可能是通过调节AMPK/mTOR信号通路诱导自噬来发挥肾保护作用。
大黄素顺铂自噬凋亡肾小管上皮细胞
顺铂是临床常用的治疗多种恶性肿瘤的广谱化疗药物,然而其导致的肾毒性限制了在临床的应用[1,2]。自噬是一个溶酶体依赖性的大分子蛋白质和自身受损的细胞器降解的过程,该过程为细胞修复提供原料与营养,实现细胞器更新[3]。自噬通常在饥饿、氧化应激、缺氧等病理情况下发生。体内外研究[4-6]表明,在顺铂导致的肾小管上皮细胞损伤早期出现了自噬,晚期则出现凋亡,这种自噬被认为是顺铂导致肾损伤的一个防御性保护作用。大黄素是中药大黄的主要有效单体,具有诸多肾保护作用,包括抗肾纤维化、抗氧化、清除自由基、调节血脂异常代谢,以及抑制炎症反应等[7]。研究发现,大黄素作为一种有效的自由基清除剂,对顺铂诱导的人类肾HEK293细胞损伤具有保护作用[8]。近年来有报道称,大黄素可以诱导神经胶质瘤细胞和人血管平滑肌细胞发生自噬[9,10]。郑英等[11]研究表明,在低氧条件下大黄素联合细胞因子可通过增强细胞的自噬对大鼠小肠隐窝上皮细胞(IEC-6)起到保护作用。然而,大黄素是否可以通过自噬途径,对抗顺铂导致的肾损伤起到保护或改善作用,目前还没有相关报道。因此,本研究借助顺铂诱导的肾小管细胞损伤模型,体外用大黄素进行干预,观察大黄素对顺铂环境下细胞损伤的影响及其分子生物学机制。
1 主要仪器与试药
CO2恒温培养箱(日本SANYO公司);CK40型倒置荧光显微镜(日本OYLMPUS公司);蛋白电泳及转移设备(美国BIO-RAD公司)等。
顺铂(用生理盐水溶解并配制成2 mmol·L-1溶液)、大黄素(用二甲基亚砜溶解并配制成10 mmol·L-1溶液)、雷帕霉素(用二甲基亚砜溶解并配制成100 μmol·L-1溶液)均购自美国Sigma-Aldrich公司(批号分别为:P4394、E7881、R0395);Dulbecco’s modified Eagle’s medium/Ham’s F-12(DMEM/F-12培养基)、双抗(青霉素100 U·mL-1,链霉素100 μg·mL-1)、胰蛋白酶(0.25%EDTA)均购自美国Hyclone公司(批号分别为:C113305HB7、15140.22、SH30042.01);胎牛血清(Fetal Bovine Serum,FBS,美国Gibco公司,批号:302220F);pmRFP-LC3质粒(美国Addgene公司,批号:21075);LipofectamineTM2000(美国Invitrogen公司,批号:1464341);兔抗大鼠LC3 A/B(D3U4C)单克隆抗体(批号:12741)、兔抗大鼠Caspase-3抗体(批号:9662)、兔抗大鼠cleaved Caspase-3(Asp175)抗体(批号:9664)、兔抗大鼠phospho-mTOR(Ser2481)抗体(批号:2974)、兔抗大鼠mTOR抗体(批号:2972)、兔抗大鼠phospho-AMPKα(Thr172)抗体(批号:2531)、兔抗大鼠AMPKα抗体(批号:2532)、兔抗大鼠β-actin单克隆抗体(批号:4967)、辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的羊抗兔IgG抗体(批号:7074)均购自美国Cell Signaling Technology公司;蛋白相对分子量Marker(美国Thermo Scientific公司,批号:26616);偏聚二氟乙烯膜和ECL发光液(美国Millipore公司,批号:1409001);X光胶片(美国Kodak公司);显影、定影试剂盒(上海碧云天公司,P0019)。
2 实验方法
2.1 细胞培养及干预措施
传代培养的大鼠肾小管上皮细胞株(NRK-52E)由日本山梨大学北村正敬教授惠赠。细胞用含5% FBS的DMEM/F-12完全培养基(含1%青霉素链霉素),置于37℃、5%CO2恒温孵箱中培养,当细胞生长覆盖率达到80%-90%,以1∶3或1∶4率传代。弃去旧培养基,PBS洗涤2遍,加入0.25%胰酶1 mL,放入恒温孵箱中消化约3 min,加入5 mL完全培养基终止消化,吹打混匀,转移至15 mL离心管中,1 000 rpm离心4 min,弃去上清,加入适量培养基,1/4-1/3隔日传代。取正常生长的NRK-52E细胞,用胰蛋白酶消化制成细胞悬液,以2×105个/孔的密度接种于12孔板中。正常对照组用含5%FBS的DMEM/F-12完全培养基;实验组根据不同刺激条件加入不同终浓度的顺铂(10、50 μmol·L-1)、大黄素(10、50、100 μmol·L-1)和雷帕霉素(100 nmol·L-1)进行干预。
2.2 NRK-52E细胞形态观察
细胞经不同条件处理后,用倒置光学显微镜观察各组NRK-52E细胞形态并拍照。
2.3 细胞转染及pmRFP-LC3荧光颗粒观察
在35 mm培养皿中接种密度为1.5×105/孔的正常生长的NRK-52E细胞,待细胞生长至50%-80%时开始进行转染。将3.5µL待转染重组RFP-LC3质粒加入150µL无血清DMEM/F-12培养基中稀释,将6µL LipofectamineTM2000转染试剂加入150µL无血清DMEM/F-12培养基中稀释,混匀两组稀释液后,室温放置5 min。取出250µL均匀滴入细胞培养皿中进行转染,置于恒温箱中培养,8 h后换液,即得到转染了pmRFP-LC3质粒的细胞。将转染了pmRFP-LC3质粒的细胞重新铺板于24孔板中,继续培养24 h后按各组干预药物浓度进行刺激,荧光显微镜下观察pmRFPLC3荧光颗粒数目的变化。
2.4 Western Blot实验
采用Western Blot实验检测LC3 I/II蛋白、Caspase-3蛋白、cleaved Caspase-3蛋白、p-mTOR和mTOR蛋白、p-AMPKα和AMPKα蛋白的表达。具体步骤如下:细胞经药物处理后,弃去培养板中的液体,用预冷的PBS漂洗2遍,加入裂解液(每孔加入裂解液100 μL),于冰上充分震荡裂解15-30 min,用已高温消毒的抢头快速来回刮每孔的细胞,最后收集于1.5 mL离心管中,置于-80℃保存。实验前将蛋白样品于100℃沸水中煮4 min使蛋白变性,根据目的蛋白相对分子量配制分离胶和浓缩胶,在电泳槽中加入电泳缓冲液,取各蛋白样品20 μL上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacryl-Amide Gelelectrophoresis,SDS-PAGE)电泳分离。电泳完后,将蛋白移电转移至PVDF膜上,用含3%BSA的聚氧乙烯脱水山梨醇单月桂酸酯(Tris Buffered Saline Tween,TBST)缓冲液封闭1 h;孵育一抗(LC3 I/II抗体、Caspase-3抗体和cleaved Caspase-3抗体、p-mTOR和mTOR抗体、p-AMPKα和AMPKα抗体均为1:1 000稀释,β-actin抗体1:2 000稀释),4℃孵育过夜,次日TBST洗膜3次,每次5 min,室温孵育HRP标记的二抗(1:2 000-5 000稀释)1.5 h,TBST再次洗膜3次,每次5 min,将ECL发光液均匀滴在PVDF膜上,进行X光胶片压片、曝光和定影。采用Image-Pro Plus 6.0软件进行半定量分析,结果以LC3 II/LC3 I比值,或以各指标的目的蛋白灰度值/内参β-actin灰度值表示目的蛋白的相对表达量。
2.5 统计学分析
应用SPSS 19.0统计软件对数据进行分析,计量资料用xˉ±s表示,组间差异比较采用独立样本t检验或非参数检验,P<0.05为差异有统计学意义。
3 结果
3.1 大黄素改善顺铂诱导的NRK-52E细胞形态学改变
已经有研究表明,顺铂可以诱导肾小管上皮细胞凋亡[5]。细胞正常生长时形成融合的单层细胞,呈圆形或者多边形贴壁细胞,细胞间紧密连接(图1A),经50 μmol·L-1的顺铂处理24 h后,细胞出现皱缩变圆死亡(图1B)。
以往研究表明,大黄素对顺铂导致的细胞损伤具有保护作用[8,12]。本研究用不同浓度的大黄素(10、100 μmol·L-1)干预细胞24 h后,观察到不同浓度的大黄素干预后,能明显改善单独顺铂处理组导致的细胞皱缩变圆死亡,并且高浓度大黄素干预组改善更明显,差异具有统计学意义(P<0.05)(图1C、图1D)。该结果提示顺铂可以诱导NRK-52E细胞出现形态学改变,大黄素能够改善顺铂导致的这种细胞形态学改变。
3.2 大黄素抑制顺铂上调的cleaved Caspase-3蛋白的表达
为了进一步证明大黄素对顺铂诱导的NRK-52E细胞改变具有保护作用,本研究选择50 μmol·L-1的顺铂处理细胞,Western Blot检测凋亡相关蛋白Caspase-3和cleaved Caspase-3的表达情况。结果显示,当顺铂处理细胞24 h时,与正常对照组相比,Caspase-3蛋白表达量明显下调,cleaved Caspase-3蛋白表达明显上调,100 μmol·L-1浓度的大黄素干预可以逆转顺铂刺激下的Caspase-3和cleaved Caspase-3蛋白的表达,差异具有统计学意义(P<0.05)(图2)。该结果提示,顺铂可以引起细胞损伤,导致细胞凋亡;大黄素能够改善顺铂诱导的NRK-52E细胞凋亡。
3.3 大黄素诱导NRK-52E细胞自噬
微管相关蛋白1轻链3(Microtubule-Associated Protein 1 Light Chain 3,LC3)被认为是自噬形成的标志分子,定位于自噬泡膜表面,LC3存在两种可相互转化的形式即LC3-I和其脂化形式LC3-II,LC3-II/LC3-I的比值大小可以反映自噬活化的强度[13,14]。本研究用100 μmol·L-1大黄素干预细胞不同的时间点(0.5、1、2、6 h);结果显示,LC3-II/LC3-I的比值明显上升,并且在1-2h时间点,LC3-II/LC3-I的比值最大,说明100μmol·L-1大黄素处理细胞在1-2 h时间点自噬最明显(P<0.05)(图3A)。该结果提示大黄素能诱导自噬的发生,并且在1-2 h的干预时间点最明显。本实验应用pmRFPLC3转染技术,在荧光显微镜下观察到用100 μmol·L-1大黄素处理NRK-52E细胞1 h后,细胞内出现红色颗粒状LC3分布,与正常对照组相比,红色自噬颗粒明显增多(图3B),更进一步提示大黄素能诱导自噬的发生。
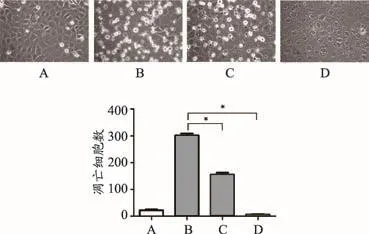
图1 大黄素改善顺铂诱导的NRK-52E细胞形态学改变

图2 大黄素抑制顺铂上调的cleaved Caspase-3蛋白的表达
3.4 雷帕霉素诱导自噬达到改善顺铂引起的NRK-52E细胞凋亡
为了观察自噬是否参与顺铂诱导的细胞凋亡的保护作用,我们选用雷帕霉素,哺乳动物雷帕霉素mTOR靶蛋白的抑制剂,在应激条件下它可以通过抑制mTOR活性而激活自噬[15],有研究表明,雷帕霉素在体内外对肾小管上皮细胞自噬有促进作用[16]。本研究采用雷帕霉素在体外干预细胞,观察其对LC3-II/LC3-I蛋白表达的影响。Western Blot结果显示,100 nmol·L-1雷帕霉素处理细胞0.5、1、2和6 h,与对照组相比,在1 h和6 h时LC3-II/LC3-I的比值明显上升,并且在1 h时间点,LC3-II/LC3-I的比值最大,差异有统计学意义(P<0.05)(图4)。
本实验采用100 nmol·L-1雷帕霉素与50 μmol·L-1顺铂联合干预细胞24 h,倒置显微镜下观察,雷帕霉素与顺铂共同干预能明显改善顺铂诱导的细胞凋亡(图5)。这些结果表明,雷帕霉素可以诱导NRK-52E细胞自噬,改善顺铂诱导的NRK-52E细胞凋亡。
3.5 大黄素通过调节AMPK/mTOR信号通路诱导自噬
为了进一步明确大黄素诱导自噬的机制,本研究观察了大黄素对公认的自噬上游通路AMPK的活化和mTOR信号的影响。用50 μmol·L-1浓度的大黄素干预细胞不同时间点(0.5、1、2、6 h),Western Blot检测pmTOR和p-AMPK的表达情况。结果显示,随着大黄素干预时间的延长,p-mTOR蛋白表达明显下调,p-AMPK的表达在6 h时增加最明显,与没有大黄素干预组相比,差异有统计学意义(P<0.05)(图6)。该结果提示大黄素可能通过调节AMPK/mTOR信号通路诱导NRK-52E发生自噬。

图3 大黄素诱导NRK-52E细胞自噬
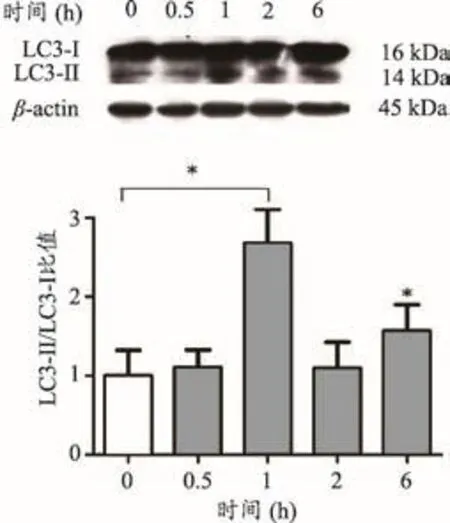
图4 雷帕霉素诱导NRK-52E细胞自噬
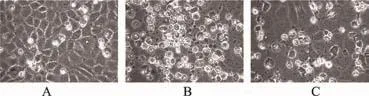
图5 雷帕霉素改善顺铂导致的NRK-52E细胞凋亡
4 讨论
机体正常生理状态下,基础水平的自噬几乎存在于所有的细胞,在细胞生长、增生以及死亡等过程中发挥着重要作用,自噬通过降解长寿命蛋白和细胞器,参与细胞器代谢和生物能量的供给,维持细胞内环境稳定,从而保护细胞[17]。已有研究报道,在肾脏病理生理过程中,它与肾脏固有细胞,如足细胞、肾小管上皮细胞等密切相关[18,19]。还有研究报道研究,在糖尿病肾损伤[20]、肾脏缺血-再灌注损伤[21],以及中毒性肾损伤[22]模型中出现了自噬,表明自噬可能在多种肾脏疾病中起着重要作用。
顺铂的肾毒性主要表现为对肾小管上端损伤,引起急性肾损伤,且与其用药剂量和时间呈正相关,其具体机制可能与导致肾小管细胞的凋亡和坏死,产生氧化应激等有关[23-25]。近年来,顺铂诱导的自噬和凋亡在肾小管上皮细胞中的关系,已成为肾脏疾病领域被越来越广泛研究的热点。Yang等[5]用顺铂干预肾小管上皮细胞后,发现顺铂处理早期有自噬体的形成,自噬的标记物LC3、Beclin-1和Atg5等表达增加,而晚期则出现凋亡。Periyasamy等[4]也发现用顺铂干预后,在小鼠肾小管上皮细胞中出现了自噬囊泡和自噬体,并且早于凋亡,如果用相应的自噬抑制剂将自噬阻断或者通过敲除自噬基因Beclin,能加重顺铂所致的小管上皮细胞凋亡。Rovetta等[19]通过体外培养NRK-52E细胞,发现顺铂处理可以早期诱导自噬,晚期则出现凋亡,并且自噬可以作为一种保护机制减轻顺铂所致的NRK-52E细胞凋亡。
前期研究表明,大黄素对顺铂导致的肾损伤具有保护作用[8,12],另有研究报道大黄素具有抗凋亡的作用,代智等[26]研究表明大黄素可以通过影响细胞周期,从而改善顺铂导致的WI-38细胞凋亡。因此,本研究借助顺铂诱导的肾小管细胞损伤模型,在体外用大黄素进行干预,观察大黄素对顺铂环境下肾小管细胞损伤的作用。同时采用顺铂处理NRK-52E细胞,发现顺铂可以引起细胞损伤,导致细胞凋亡,而加用高低浓度的大黄素干预细胞后,能明显改善顺铂导致的细胞损伤。Western Blot实验结果表明,大黄素干预可以逆转顺铂诱导的凋亡相关蛋白cleaved Caspase-3表达的上调,表明大黄素能够改善顺铂诱导的NRK-52E细胞凋亡。大黄素对顺铂导致的肾损伤保护作用具体的机制需要本课题组进行了进一步的研究。
近年来有研究报道大黄素可以诱导神经胶质瘤细胞和人血管平滑肌细胞发生自噬[9,10]。郑英等[11]研究表明在低氧条件下,大黄素联合细胞因子可通过增强细胞的自噬对大鼠小肠隐窝上皮细胞(IEC-6)起到保护作用。也有研究表明大黄素是一种有效的腺苷单磷酸(AMP)激活蛋白激酶(AMPK)活化剂[27],可以调节哺乳动物雷帕霉素靶蛋白(mTOR)途径[28]。那么大黄素是否可以通过自噬途径,从而起到对抗顺铂导致的肾损伤作用,目前还没有相关报道。LC3蛋白被认为是自噬形成的标志分子,可以用LC3-II/LC3-I的比值来评估自噬活化的强度[13,14]。mTOR是雷帕霉素的靶蛋白,可以调节细胞生长和自噬。在营养充足或无应激状态时,细胞中mTOR被激活,自噬通路受到抑制;然而,当营养缺乏,细胞处于应激状态或是饥饿环境时,mTOR活性受到抑制,自噬通路被激活[29]。在应激条件下雷帕霉素可以特异性结合mTOR,抑制mTOR的蛋白激酶活性,从而诱导自噬发生[30]。本研究用雷帕霉素干预NRK-52E细胞,发现雷帕霉素处理可以上调LC3-II/LC3-I的比值,同时雷帕霉素与顺铂共同干预能明显改善顺铂诱导的细胞凋亡。另外对大黄素干预细胞不同的时间点(0.5、1、2、6 h)进行考察,结果发现,LC3-II/LC3-I的比值也明显上升,说明大黄素具有类似于雷帕霉素诱导自噬的作用,大黄素处理细胞后自噬荧光颗粒也明显增多,进一步证实大黄素能诱导自噬。AMP-依赖性蛋白激酶(AMPK)通路是mTOR上游通路之一,AMPK被活化后可以抑制mTOR,达到增强自噬的目的。大黄素是一种有效的AMPK活化剂[27],结果发现随着大黄素干预时间的延长,p-mTOR蛋白表达明显下调,p-AMPK的表达上调,在6 h时增加最明显。故推测大黄素可能通过调节AMPK/mTOR信号通路诱导了NRK-52E细胞自噬的发生。
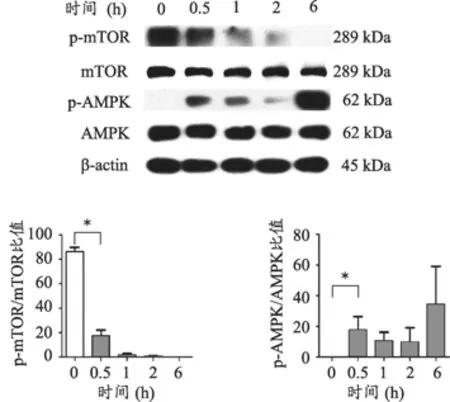
图6 大黄素通过调节AMPK/mTOR信号通路诱导自噬
顺铂可以导致肾小管上皮细胞凋亡从而引起肾损伤,从某种程度上来讲,阻止或延缓肾小管上皮细胞凋亡就可以缓解顺铂的肾毒性。本研究发现,大黄素作为中药大黄的主要生物活性物质,可以改善顺铂诱导的肾小管上皮细胞凋亡,其保护作用机制可能是通过诱导自噬来发挥肾保护作用,该研究结果为大黄素肾脏保护作用的机制提供新的思路。
1Sahni V,Choudhury D,Ahmed Z.Chemotherapy-associated renal dysfunction.Nat Rev Nephrol,2009,5(8):450-462.
2Yao X,Panichpisal K,Kurtzman N,et al.Cisplatin nephrotoxicity:a review.Am J Med Sci,2007,334(2):115-124.
3Mizushima N.Autophagy:process and function.Genes Dev,2007,21 (22):2861-2873.
4Periyasamy-Thandavan S,Jiang M,Wei Q,et al.Autophagy is cytoprotective during cisplatin injury of renal proximal tubular cells. Kidney Int,2008,74(5):631-640.
5Yang C,Kaushal V,Shah S V,et al.Autophagy is associated with apoptosis in cisplatin injury to renal tubular epithelial cells.Am J Physiol Renal Physiol,2008,294(4):F777-F787.
6 Kaushal G P,Kaushal V,Herzog C,et al.Autophagy delays apoptosis in renal tubular epithelial cells in cisplatin cytotoxicity.Autophagy 2008,4 (5):710-712.
7刘红,孙伟,顾刘宝,等.大黄素在肾脏病中药理作用研究进展.临床肾脏病杂志,2014,14(6):378-381.
8Waly M I,Ali B H,Al-Lawati I,et al.Protective effects of emodin against cisplatin-induced oxidative stress in culture human kidney (HEK 293)cells.J Appl Toxicol,2013,33(7):626-630.
9Mijatovic S,Maksimovic-Ivanic D,Radovic J,et al.Anti-glioma action of aloe emodin:the role of ERK inhibition.Cell Mol Life Sci,2005,62 (5):589-598.
10 Wang X,Zou Y,Sun A,et al.Emodin induces growth arrest and death of human vascular smooth muscle cells through reactive oxygen species and p53.J Cardiovasc Pharmacol,2007,49(5):253-260.
11郑英.大黄素联合KGF与HIF-1α在低氧细胞应激损伤中的自噬机制研究.兰州:甘肃中医药大学硕士学位论文,2015.
12 Ali B H,Al-Salam S,Al H I,et al.Abrogation of cisplatin-induced nephrotoxicity by emodin in rats.Fundam Clin Pharmacol,2013,27(2):192-200.
13 Kimura S,Fujita N,Noda T,et al.Monitoring autophagy in mammalian cultured cells through the dynamics of LC3.Methods Enzymol,2009, 452:1-12.
14 Kadowaki M,Karim M R.Cytosolic LC3 ratio as a quantitative index of macroautophagy.Methods Enzymol,2009,452:199-213.
15 He C,Klionsky D J.Regulation mechanisms and signaling pathways of autophagy.Annu Rev Genet,2009,43:67-93.
16 Geissler E K,Schlitt H J.The potential benefits of rapamycin on renal function,tolerance,fibrosis,and malignancy following transplantation. Kidney Int,2010,78(11):1075-1079.
17 Xie Z,Klionsky D J.Autophagosome formation:core machinery and adaptations.Nat Cell Biol,2007,9(10):1102-1109.
18Hartleben B,Godel M,Meyer-Schwesinger C,et al.Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice.J Clin Invest,2010,120(4):1084-1096.
19 Rovetta F,Stacchiotti A,Consiglio A,et al.ER signaling regulation drives the switch between autophagy and apoptosis in NRK-52E cells exposed to cisplatin.Exp Cell Res,2012,318(3):238-250.
20 Wu W H,Zhang M P,Zhang F,et al.The role of programmed cell death in streptozotocin-induced early diabetic nephropathy.J Endocrinol Invest,2011,34(9):e296-e301.
21 Jiang M,Liu K,Luo J,et al.Autophagy is a renoprotective mechanism during in vitro hypoxia and in vivo ischemia-reperfusion injury.Am J Pathol,2010,176(3):1181-1192.
22Inoue K,Kuwana H,Shimamura Y,et al.Cisplatin-induced macroautophagy occurs prior to apoptosis in proximal tubules in vivo. Clin Exp Nephrol,2010,14(2):112-122.
23 Ozkok A,Edelstein C L.Pathophysiology of cisplatin-induced acute kidney injury.Biomed Res Int,2014,2014:1-17.
24 Tsuruya K,Ninomiya T,Tokumoto M,et al.Direct involvement of the receptor-mediated apoptotic pathways in cisplatin-induced renal tubular cell death.Kidney Int,2003,63(1):72-82.
25 Mitazaki S,Hashimoto M,Matsuhashi Y,et al.Interleukin-6 modulates oxidativestressproducedduringthedevelopmentofcisplatin nephrotoxicity.Life Sci,2013,92(12):694-700.
26代智,仲来福.大黄素对抗顺铂引起的WI-38细胞凋亡.中国药理学与毒理学杂志,2003,17(4):276-280.
27 Song P,Kim J H,Ghim J,et al.Emodin regulates glucose utilization by activating AMP-activated protein kinase.J Biol Chem,2013,288(8):5732-5742.
28 Liu K,Park C,Li S,et al.Aloe-emodin suppresses prostate cancer by targeting the mTOR complex 2.Carcinogenesis,2012,33(7):1406-1411.
29 Yang Z,Klionsky D J.Mammalian autophagy:core molecular machinery and signaling regulation.Curr Opin Cell Biol,2010,22(2):124-131.
30Noda T,Ohsumi Y.Tor,a phosphatidylinositol kinase homologue, controls autophagy in yeast.J Biol Chem,1998,273(7):3963-3966.
Mechanism Exploration on EmodinAmeliorates Cisplatin-induced Renal Tubular Cell Injury throughActivation ofAutophagy
Liu Hong1,Sun Wei2,Gu Liubao3
(1.Wuhan No.1 Hospital,Wuhan 430022,China;2.Jiangsu Provincial Hospital of Traditional Chinese Medicine, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine,Nanjing 210029,China;3.Hospital of the Provincial Organization,Jiangsu Province Institute of Geriatrics,Nanjing 210024,China)
This study was aimed to observe the effect of emodin on cisplatin-induced renal tubular epithelial cells(NRK-52E)injury,in order to explore its possible molecular mechanisms.Firstly,effects of emodin on cisplatin-induced morphological changes in NRK-52E cells were observed.Secondly,the apoptosis-related protein expression of Caspase-3 and cleaved Caspase-3 were detected after the treatment of cisplatin alone or cisplatin together with emodin by western blot.Then,the expression of microtubule-associated protein 1 light chain 3(LC3)II/I was detected after the treatment of emodin or rapamycin at different time points by western blot.Changes of pmRFP-LC3 fluorescent particles were observed by fluorescence microscopy.And effects of rapamycin on cellular morphological changes were observed in the environment of cisplatin.Finally,effects of emodin on the activation of AMPK and mTOR signal pathway were further observed,which is considered as the upstream of autophagy signaling pathway.The results showed that cisplatin can induce morphological changes in NRK-52E cell,which was obviously ameliorated by the intervention of emodin. Additionally,the increased protein expression of cleaved Caspase-3 induced by cisplatin was obviously reduced after the intervention of emodin.The LC3-II/LC3-I ratio was significantly increased after the treatment of emodin or rapamycin at different time points.Rapamycin can significantly ameliorate NRK-52E cell apoptosis induced by cisplatin. Simultaneously,the number of pmRFP-LC3 fluorescent particles increased after the treatment of emodin.As the extension of time by intervention of emodin,the protein expression of p-mTOR was significantly reduced.In contrast,the protein expression of p-AMPK was significantly increased.It was concluded that emodin can ameliorate cisplatininduced apoptosis in NRK-52E cells.Its potential mechanism may be attributed to the activation of autophagy by regulating AMPK/mTOR signaling pathway.And thus,it played a role in renal protective effects.
Emodin,cisplatin,autophagy,apoptosis,renal tubular epithelial cells
10.11842/wst.2017.03.023
R285.5
A
(责任编辑:陈宁,责任译审:王晶)
2016-10-17
修回日期:2017-02-25
*江苏省普通高校研究生科研创新计划项目(SJLX15_0445):大黄素通过自噬途径对顺铂致NRK-52E细胞损害的保护及其机制研究,负责人:刘红;国家自然科学基金委面上项目(81373607):基于调控PI3K/Akt通路的大黄附子汤保护肾小管上皮细胞凋亡的研究,负责人:孙伟;江苏省科技厅科技创新与成果转化(生命健康科技)专项资金(BL2012032):基于“肾虚湿瘀”理论延缓慢性肾脏病(CKD3期)进展中西医优化方案研究及推广应用,负责人:孙伟。
**通讯作者:孙伟,本刊编委,主任医师,博士生导师,主要研究方向:慢性肾脏病的发病机制与中医药干预。
——雷帕霉素

