不同加工玄参药材中多元功效成分的含量测定及灰色关联度分析
王胜男,华愉教,邹立思,罗益远,刘训红,刘娟秀,严 颖,徐 力
(1.南京中医药大学,江苏 南京 210023;2.扬州市药品检验所,江苏 扬州 225000)
不同加工玄参药材中多元功效成分的含量测定及灰色关联度分析
王胜男1,华愉教1,邹立思1,罗益远1,刘训红1,刘娟秀1,严 颖1,徐 力2
(1.南京中医药大学,江苏 南京 210023;2.扬州市药品检验所,江苏 扬州 225000)
建立了超高效液相色谱-三重四极杆-线性离子阱质谱(UPLC-Qtrap-MS/MS)同时测定玄参药材中环烯醚萜苷类、苯丙素苷类和有机酸类等12种功效成分的方法,分析了不同加工方法对玄参药材中多元功效成分含量的影响,并采用UPLC-Qtrap-MS/MS技术同时测定其中的12种功效成分含量,用灰色关联度分析法对多元功效成分进行综合评价。结果表明,12种功效成分在一定浓度范围内的线性关系良好,相关系数均大于0.999 0,加标回收率为95.82%~99.35%,相对标准偏差(RSD)小于2.44%;不同加工方法对玄参中多元功效成分含量具有一定的影响,灰色关联度分析结果显示,阴干法和完整药材蒸后烘干的样品综合质量较好。该实验揭示了加工对玄参中多元功效成分的影响,可为优选玄参适宜产地加工方法提供基础资料,同时为玄参药材内在质量的综合评价提供方法参考。
玄参;超高效液相色谱-三重四极杆-线性离子阱质谱(UPLC-Qtrap-MS/MS);多元功效成分;加工方法;灰色关联度分析
玄参系玄参科植物玄参ScrophularianingpoensisHemsl.的干燥根,是大宗常用中药材,具有清热凉血、滋阴降火、解毒散结之功效,用于治疗热入营血、温毒发斑、热病伤阴、舌绛烦渴、津伤便秘、骨蒸劳嗽、目赤、咽痛、白喉、療疬、痈肿疮毒等症[1]。现代研究表明,玄参含有环烯醚萜苷类、苯丙素苷类和有机酸类等多元功效成分[2-4]。环烯醚萜苷类,如哈巴苷、哈巴俄苷等,具有保护神经系统、抗肿瘤、抗炎、保肝、保护心血管系统、治疗糖尿病及其并发症等作用,此外,还具有免疫增强作用,有研究认为是梓醇骨架(九碳7,8-环氧环戊烷骨架)所起的作用[5-7]。苯丙素苷类,如毛蕊花糖苷、安格洛苷C等,具有抗炎、抗菌、保肝及降低玻尿酸水平等作用,此外,还具有较好的抗凝作用和抗肿瘤活性,其与苯环芳氢数和分子中酚羟基数目有关[7-8]。有机酸类,如肉桂酸、咖啡酸、对香豆酸、阿魏酸等,具有抗炎、抑制血小板聚集、抗氧化、抗血栓及诱导肿瘤细胞凋亡等作用[9]。
关于玄参药材的产地加工,《中国药典》规定的加工方法是“发汗”法,即主根晒或烘至半干,堆放3~6天,反复数次至干燥[1]。药材产地加工是药材生产与品质形成的重要环节,通过对各产区玄参生产情况的调查发现,玄参的产地加工方法主要有“发汗”、烘干、阴干、蒸切、煮切等[10-15],但目前尚无统一的标准,存在盲目性与随意性。为了提高玄参药材的质量及为GAP基地的建设提供参考资料,有必要对玄参药材的加工方法进行优选。
目前,关于玄参药材的品质评价及加工方法主要集中于对环烯醚萜苷类、苯丙素苷类及有机酸类成分的分析,但多以单一或单类成分的含量或动态变化为考察指标,尚少见上述多元功效成分同时测定的报道。常用的分析方法有高效液相色谱法(HPLC)[16-17]、高效毛细管电泳法(HPCE)[18]、液相色谱-质谱法(LC/MS)[19-22]等,其中,HPLC法难以解决组分共流出现象;HPCE法的定量检测重现性相对较差;而LC/MS法具有灵敏度高、选择性强、定量准确、分析速度快等优点。
本工作以浙江道地产区产玄参(浙玄参)为研究对象,采用超高效液相色谱-串联四极杆-线性离子阱质谱法(UPLC-Qtrap-MS/MS)同时测定环烯醚萜苷类(哈巴苷、哈巴俄苷、梓醇、桃叶珊瑚苷)、苯丙素苷类(毛蕊花糖苷、安格洛苷C)、有机酸类(肉桂酸、咖啡酸、对香豆酸、阿魏酸、对甲氧基肉桂酸、反式丁烯二酸)等12种功效成分的含量,并采用灰色关联度法[23-27]对不同加工玄参药材进行综合评价,揭示加工方法对玄参中多元功效成分的影响,希望为优选玄参适宜的加工方法提供基础资料,同时也为玄参药材内在质量的综合评价和全面控制提供方法参考。
1 实验部分
1.1 仪器
UPLC-20ADXR系列液相色谱仪:日本Shimadzu公司产品,配有溶剂脱气装置、自动进样器;API 4000四极杆-线性离子阱质谱仪:美国AB Sciex公司产品,配有离子喷雾接口;KQ-500B超声波清洗机(超声功率500 W,40 kHz):昆山超声仪器有限公司产品;BSA2245型电子分析天平(十万分之一)、ME36S型电子分析天平(百万分之一):德国赛多利斯公司产品;H1650-W高速离心机:湖南湘仪实验室仪器开发有限公司产品。
1.2 材料与试剂
哈巴苷(批号:111729-201405)、哈巴俄苷(批号:111730-201307)、阿魏酸(批号:110773-201012)、梓醇(批号:110808-200508)、桃叶珊瑚苷(批号:111761-200601)、肉桂酸(批号:786-9001)、咖啡酸(批号:110885-200102):纯度均大于99%,购自中国药品生物制品检定所;安格洛苷C(批号:141112):纯度大于99%,购自成都克洛玛生物科技有限公司;毛蕊花糖苷(批号:A0280):纯度大于99%,购自上海永叶生物科技有限公司;对香豆酸(批号:YY90143)、对甲氧基肉桂酸(批号:YY14321):纯度均大于99%,购自上海源叶生物科技有限公司;反式丁烯二酸(批号:T20 110623):纯度大于99%,购自国药集团化学试剂有限公司;水为超纯水;甲醇、乙腈:均为色谱纯,德国默克公司产品;其余试剂均为分析纯。12种目标功效成分的化学结构简式示于图1。
玄参药材为2014年11月份采自浙江省缙云县,经南京中医药大学刘训红教授鉴定为玄参科植物玄参ScrophularianingpoensisHemsl.的干燥根,留样凭证存放于南京中医药大学中药鉴定实验室。实验样品按不同的加工方法进行加工处理:S1为完整药材晒干法,S2为切片药材晒干法,S3为完整药材烘干法,S4为切片药材烘干法,S5为阴干法,S6为微波真空干燥法,S7为完整药材蒸后烘干,S8为切片药材蒸后烘干,S9为“发汗”加工法。
1.3 实验条件
1.3.1 色谱条件 色谱柱:BDS HYPERSIL C18(250 mm×4.6 mm×5 μm);流动相:水(A相)-乙腈(B相);梯度洗脱:0~1 min、5%B,1~10 min、5%~20%B,10~14 min、20%~35%B,14~16 min、35%~75%B,16~18.1 min、75%~5%B,18.1~22 min,5%B;柱温35 ℃;流速1.0 mL/min;进样量2 μL。
1.3.2 质谱条件 Turbo V离子源,ESI电离负离子模式,多反应监测(MRM)扫描方式,离子化温度(TEM)650 ℃,喷雾电压-4 500 V,雾化气(GS1)流速65 L/min,辅助气(GS2)流速65 L/min,气帘气(CUR)流速30 L/min。优化的质谱条件参数列于表1。
1.4 对照品溶液的制备
分别称取12种化合物对照品适量,加纯水配制成各对照品储备液。取各对照品储备液适量,制成反式丁烯二酸、咖啡酸、梓醇、桃叶珊瑚苷、对香豆酸、阿魏酸、哈巴苷、肉桂酸、对甲氧基肉桂酸、毛蕊花糖苷、安格洛苷C、哈巴俄苷的质量浓度分别为709.00、22.25、175.50、914.00、53.00、128.00、569.00、126.80、426.00、1 744.00、470.00、198.00 mg/L的混合对照品溶液,并逐级稀释,得到一系列不同浓度的12种多元功效成分混合对照品溶液,待分析。
1.5 供试品溶液的制备
精密称定1.0 g玄参粉末(过80目筛),置于100 mL具塞锥形瓶中,加入20 mL 70%甲醇,称质量,于室温下超声提取60 min后取出,静置冷却;以70%甲醇补足质量损失,摇匀,提取液以12 000 r/min离心10 min,取上清液;经0.45 μm微孔滤膜过滤,即得供试品溶液。

图1 玄参中12种功效成分的结构简式Fig.1 Chemical structures of twelve active constituents in Scrophulariae Radix

表1 优化的质谱条件参数Table 1 Optimized MS/MS parameters
1.6 分析方法
采用BDS HYPERSIL C18色谱柱对色谱分离条件进行优化,按照优化的条件进行UPLC-Qtrap-MS/MS分析,并做方法学考察,用外标法计算各样品中12种功效成分的含量。根据含量测定结果,用灰色关联度法对不同加工玄参药材进行综合评价。
2 结果与讨论
2.1 色谱-质谱条件的优化
通过研究12种功效成分在电喷雾正负离子模式下的响应特点,发现其在负离子模式下均有较强的离子响应,提取离子流图及MRM图示于图2;但在正离子模式下,安格洛苷C、毛蕊花糖苷、反式丁烯二酸、对甲氧基肉桂酸、咖啡酸、桃叶珊瑚苷、哈巴苷、哈巴俄苷和梓醇成分的离子响应值较弱或没有响应。因此,本研究选用负离子模式进行分析,12种功效成分的全扫描质谱图示于图3。
通过比较不同流动相溶液(甲醇-水溶液、甲醇-0.1%甲酸水溶液、乙腈-水溶液、乙腈-0.1%甲酸水溶液)下12种功效成分的色谱峰形和离子化效率,本研究选用乙腈-水溶液作为流动相。

注:1.反式丁烯二酸;2.咖啡酸;3.梓醇;4.桃叶珊瑚苷;5.对香豆酸;6.阿魏酸;7.哈巴苷;8.肉桂酸;9.对甲氧基肉桂酸;10.毛蕊花糖苷;11.安格洛苷C;12.哈巴俄苷图2 混合对照品(a)和样品(b)的提取离子流图及12种功效成分的MRM图(c)Fig.2 Extracted ion chromatograms (EIC) of reference substances (a), sample (b) and multi-reaction monitoring (MRM) of 12 active constituents (c)
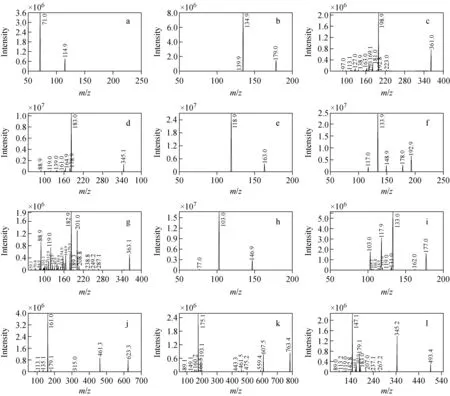
注:a.反式丁烯二酸;b.咖啡酸;c.梓醇;d.桃叶珊瑚苷;e.对香豆酸;f.阿魏酸;g.哈巴苷;h.肉桂酸;i.对甲氧基肉桂酸;j.毛蕊花糖苷;k.安格洛苷C;l.哈巴俄苷图3 负离子模式下,12种功效成分的全扫描质谱图Fig.3 Full scan mass spectrums of 12 active constituents in negative mode
2.2 提取方法的优化
本实验对提取溶剂(50%、60%、70%、80%、90%、100%甲醇),料液比(1∶20、1∶40、1∶60、1∶80),提取方法(回流、超声处理)和提取时间(15、30、45、60、75 min)进行了单变量考察。结果表明:70%甲醇作为提取溶剂可以提取出更多待测物;超声提取效果比回流提取好,且方便易行。因此选择70%甲醇作为提取溶剂,超声提取作为提取方法。优化后的料液比和提取时间分别为1∶20和60 min。
2.3 方法学考察
2.3.1 标准曲线、检测限和定量限 精密吸取1.4节的不同浓度系列对照品溶液及混合对照品储备液各2 μL,在1.3节条件下测定,以对照品的峰面积(y)对相应的浓度(x)进行线性回归,得到回归方程、相关系数和线性范围;按信噪比(S/N)为3计算检测限,S/N为10计算定量限,结果列于表2。
2.3.2 精密度实验 精密吸取一定浓度的混合对照品溶液,连续进样6次,测定各对照品峰面积,12种功效成分对照品的峰面积相对标准偏差列于表3。结果表明,仪器精密度良好,符合实验要求。
2.3.3 稳定性实验 取同一玄参样品供试品溶液,分别在0、2、4、8、12、24 h进样分析,12种功效成分峰面积的相对标准偏差列于表3。结果表明,供试品溶液在24 h内具有较好的稳定性。

表2 12种功效成分的线性方程、相关系数、检测限和定量限Table 2 Liner equations, correlation coefficients, limits of detection and limits of quantification of 12 active constituents

表3 12种功效成分的精密度、重复性和稳定性Table 3 Precisions, repeatabilities and stabilities of 12 active constituents
2.3.4 重复性实验 分别称取6份同一玄参样品,每份1.0 g,精密称定,按1.5节方法制备供试液,进样测定,12种功效成分含量的相对标准偏差列于表3。结果表明,该方法的重复性良好,符合实验规定。
2.3.5 回收率实验 取0.500 0 g已知含量的玄参样品3份,精密称定,分别加入3个不同水平(80%、100%、120%)的标准品中,每个水平平行测试3次。按1.5节方法制备加样回收供试品溶液,并进行测定,计算回收率和相对标准偏差,结果列于表4。
2.4 实际样品测定
将供试品溶液注入液相色谱-质谱联用仪,按1.3节条件测定,根据相应的线性关系计算供试样品中12种功效成分的含量,结果列于表5。
2.5 灰色关联度分析
2.5.1 样品数据集的建立 以12种多元功效成分为指标性成分,建立玄参药材质量灰色模式识别数据集,结果列于表6。
2.5.2 原始数据规格化处理 设有n个样品,每个样品有m项评价指标,即组成评价单元序列{Xik}(i=1,2,3,…n;k=1,2,3,…m;本实验中n=11,m=10)。由于评价指标之间存在测试单位不统一的问题,因此,按照式(1)对原始数据进行规格化处理,结果列于表7。
Yik=Xik/Xk
(1)
式中:Yik为规格化处理后的数据;Xik为原始数据;Xk为n个样品第k个指标的均值。

表4 12种功效成分的加标回收率Table 4 Recoverises of 12 active constituents

续表4
续表4

表5 实际样品的测定结果(μg/g,n=2)Table 5 Determination results of actual samples (μg/g, n=2)

表6 样品数据集Table 6 Sample dataset

表7 原始数据规格化处理结果Table 7 Result of data standardization
2.5.3 关联度计算 用灰色关联度进行评价时,应选择参考序列,设最优参考序列和最差参考序列分别为{Xsk}和{Xtk}(k=1,2,3,…m)。设最优参考序列的各项指标是n个样品对应指标的最大值;最差参考序列的各项指标是n个样品对应指标的最小值。按照式(2)和式(3)对原始数据进行规格化处理;按照式(4)和式(5)计算各评价单元序列相对最优(差)参考序列的差值;按照式(6)和式(7)计算各评价单元相对于最优(差)参考序列的关联度;按照式(8)计算各样品的相对关联度,并按ri大小排序,结果列于表8。
Ysk=Xsk/Xk
(2)
式中:Ysk为规格化处理后的数据;Xsk为原始数据;Xk为n个样品第k个指标的均值。
Ytk=Xtk/Xk
(3)
式中:Ytk为规格化处理后的数据;Xtk为原始数据;Xk为n个样品第k个指标的均值。
最优参考序列,关联系数
(4)
式中:Δmin=min∣Yik—Ysk∣,Δmax=max∣Yik—Ysk∣,i=1,2,3,…n,k=1,2,3,…m。
最差参考序列,关联系数
(5)

(6)
(7)

(8)

表8 各样品相对关联度质量优劣排序Table 8 Quality sequencing of the samples
3 讨论
本实验测定的各个加工玄参样品中哈巴苷和哈巴俄苷的总量均大于0.45%,符合《中国药典》2015版标准规定;不同加工方法对玄参中多元功效成分含量有一定的影响,但由于各多元功效成分存在差异,难以直观评价,因此采用灰色关联度分析法对其多元功效成分进行综合评价。结果显示,阴干(S5)、完整蒸后烘干(S7)及微波真空干燥(S6)样品的综合质量较好,说明这些方法对玄参中多元功效成分的综合影响较小;其中,微波真空干燥法是新型的干燥加工技术,具有干燥速度快、加热均匀、产品质量高等优点,对药材有效成分的影响较小,具有一定的推广价值。烘干样品(S3,S4)的综合质量较差,目前国内部分产区采用烘干法加工新鲜玄参,虽然耗时较短、生产效率较高,但对其有效成分有一定的影响。传统认为,玄参“发汗”加工的药材质量好,但关于传统“发汗”加工方法的科学内涵,功效成分分析只是其中一个方面,其他深层次的因素还有待进一步的药效学研究。
4 结论
本研究建立了UPLC-Qtrap-MS/MS法同时测定玄参中环烯醚萜苷类、苯丙素苷类和有机酸类等12种多元功效成分的含量,探讨了不同加工方法对玄参中各功效成分的影响,并采用灰色关联度法对其进行综合评价。该方法可以为优选玄参适宜产地加工方法提供基础资料,同时为玄参药材内在质量的综合评价和全面控制提供方法参考。
[1] 国家药典委员会. 中华人民共和国药典2015年版(一部)[M]. 北京:中国医药科技出版社,2015:117.
[2] 许福泉,许旭东,陈士林,等. 玄参化学成分及药理活性研究进展[J]. 中国现代中药,2013,15(9):752-759.
XU Fuquan, XU Xudong, CHEN Shilin, et al. Progress in chemical constituents and bioactivities ofScrophularianingpoensis[J]. Modern Chinese Medicine, 2013, 15(9): 752-759(in Chinese).
[3] 谢小艳,夏春森. 中药玄参的化学成分及药理研究进展[J]. 亚太传统医药,2010,6(5):121-124.
XIE Xiaoyan, XIA Chunsen. Advances in studies on chemical constituents and pharmacological activities ofScrophularianingpoensisHemsl[J]. Asia-Pacific Traditional Medicine, 2010, 6(5): 121-124(in Chinese).
[4] LI J, HUANG X, DU X, et al. Study of chemical composition and antimicrobial activity of leaves and roots ofScrophularianingpoensis[J]. Natural Product Research, 2009, 23(8): 775-780.
[5] GOUSIADOU C, KOKUBUN T, MARTINS J, et al. Iridoid glucosides in the endemicPicconiaazorica(Oleaceae)[J]. Phytochemistry, 2015, 115: 171-174.
[6] HUA J, QI J, YU B Y. Iridoid and phenylpropanoid glycosides fromScrophularianingpoensisHemsl. and theirα-glucosidase inhibitory activities[J]. Fitoterapia, 2014, 93(3): 67-73.
[7] 李医明,曾华武,贺祥,等. 玄参中环烯醚萜甙和苯丙素甙对LTB4产生及血小板聚集的影响[J]. 第二军医大学学报,1999,20(5):301-303.
LI Yiming, ZENG Huawu, HE Xiang, et al. Iridoid and phenylpropanoid glycosides ofScrophularianingpoensisinhibit the formation of LTB4and platelet aggregation[J]. Acad J Sec Mil Med Univ, 1999, 20(5): 301-303(in Chinese).
[8] 黄才国,李医明,贺祥,等. 玄参中苯丙素苷对大鼠肝损伤细胞凋亡的影响[J]. 中西医结合肝病杂志,2004,14(3):160-161.
HUANG Caiguo, LI Yiming, HE Xiang, et al . Effect of phenylpropanolid glycosides ofScrophularianingpoensison hepatocellular apoptosis in rats with acute liver injury[J]. Chinese Journal of Integrated Traditonal and Western Medicine on Liver Diseases, 2004, 14(3):160-161(in Chinese).
[9] 汤喜兰,刘建勋,李磊,等. 中药有机酸类成分的药理作用及在心血管疾病的应用[J]. 中国实验方剂学杂志,2012,18(5):243-246.
TANG Xilan, LIU Jianxun, LI Lei, et al. Pharmacological effects of organic acids in chinese herbs and its application in cardiovascular diseases[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(5): 243-246(in Chinese).
[10]罗园. 玄参传统炮制方法的探讨[J]. 现代医药卫生,2004,20(21):2 282.
LUO Yuan. Study of the traditional processing methods of Scrophulariae Radix[J]. Modern Medicine & Health, 2004, 20(21): 2 282(in Chinese).
[11]陈林伟,秦昆明,朱艳汇,等. 中药材产地加工的研究现状及展望[J]. 中国中药杂志,2015,40(4):603-606.
CHEN Linwei, QIN Kunming, ZHU Yanhui, et al. Research status and prospect of primary processing of traditional Chinese medicinal materials[J]. Chin J Chin Meter Med, 2015, 40(4): 603-606(in Chinese).
[12]段金廒,宿树兰,吕洁丽,等. 药材产地加工传统经验与现代科学认识[J]. 中国中药杂志,2009,34(24):3 152-3 157.
DUAN Jin’ao, SU Shulan, LV Jieli, et al. Traditional experiences and modern cognition on primary processing of traditional Chinese medicinal materials[J]. Chin J Chin Mater Med, 2009, 34(24): 3 152-3 157(in Chinese).
[13]李会伟,刘培,钱大玮,等. 不同干燥方法及其影响因子对玄参药材初加工过程品质形成的影响[J]. 中国中药杂志,2015,40(22):4 417-4 423.
LI Huiwei, LIU Pei, QIAN Dawei, et al. Effect on quality of Scrophulariae Radix with modern drying technology[J]. Chin J Chin Meter Med, 2015, 40(22): 4 417-4 423(in Chinese).
[14]聂诗明,孙晓静,陈璇,等. 不同干燥方法对玄参品质的影响[J]. 中药材,2010,33(1):33-35.
NIE Shiming, SUN Xiaojing, CHEN Xuan, et al. The effects of the quality of Scrophulariae Radix by different drying methods[J]. J Chin Med Mater, 2010, 33(1): 33-35(in Chinese).
[15]王建华,谢丽华,刘洪宇,等. 玄参不同加工品中哈巴俄苷与肉桂酸的HPLC含量测定[J]. 中国药学杂志,2000,35(6):375-378.
WANG Jianhua, XIE Lihua, LIU Hongyu, et al. HPLC determination of harpagoside and cinnamic acid in Xuanshen after processed in different methods[J]. Chin Pharm J, 2000, 35(6): 375-378(in Chinese).
[16]杨宪,杨水平,张雪,等. HPLC-UV-ELSD同时测定玄参中5种成分的含量[J]. 中国中药杂志,2009,34(1):68.
YANG Xian, YANG Shuiping, ZHANG Xue, et al. Determination of five compounds inScrophularianingpoensisby HPLC-UV-ELSD[J]. China J Chin Mater Med, 2009, 34(1): 68(in Chinese).
[17]CAO G,CONG XD,CAI H,et al. Simultaneous quantitation of eight active components in crude and processed Radix Scrophulariae extracts by high performance liquid chromatography with diode array detector[J]. Chin J Nat Med, 2012, 10(3): 213-217.
[18]韩乐,许虎,刘训红,等. 高效毛细管电泳测定玄参中6种指标成分的含量[J]. 中国药学杂志,2012,47(7):555-559.
HAN Le, XU Hu, LIU Xunhong, et al. Simultaneous determination of six index components inScrophularianingpensisby HPCE[J]. Chin Pharm J, 2012, 47(7): 555-559(in Chinese).
[19]JING J, CHAN CO, XU L, et al. Development of an in-line HPLC fingerprint ion-trap mass spectrometric method for identification and quality control of Radix Scrophulariae[J]. J Pharm Biomed Anal, 2011, 56(4): 830-835.
[20]CHEN Y H, QI J, HUA J, et al. Structural characterization and identification of major constituents in Radix Scrophulariae by HPLC coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Chin J Nat Med, 2014, 12(1): 47-54.
[21]ZHU Z W, LI J, GAO X M, et al. Simultaneous determination of stilbenes, phenolic acids, flavonoids and anthraquinones in Radix Polygoni multiflori by LC-MS/MS[J]. J Pharm Biomed Anal, 2012, 62(2): 162-166.
[22]王洪允,刘明,胡蓓,等. 超高效液相色谱-串联质谱法测定人血浆中罗匹尼罗浓度[J]. 质谱学报,2015,36(4):296-301.
WANG Hongyun, LIU Ming, HU Bei, et al. Determination of ropinirole in human plasma by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chinese Mass Spectromery Society, 2015, 36(4): 296-301(in Chinese).
[23]李峰,张振秋,康廷国. 灰关联度法评价鹿鞭药材质量研究[J]. 中药材,2008,31(2):189-192.
LI Feng, ZHANG Zhenqiu, KANG Tingguo. Studies on quality evaluation of Peniset Testis Cervi by grey incidence degree method[J]. J Chin Med Mater, 2008, 31(2): 189-192(in Chinese).
[24]罗君,卿娟,赵琳珺,等. 续断酒炙前后无机元素含量及其灰关联度对比分析[J]. 中国实验方剂学杂志,2015,21(5):79-82.
LUO Jun, QING Juan, ZHANG Linjun, et al. Comparative analysis of inorganic elements on Dipsaci Radix before and after processed by grey relational grade analysis[J]. Chin J Exp Tradit Med Form, 2015, 21(5): 79-82(in Chinese).
[25]李玉娇,李清,赫宇霏,等. 虎杖提取物指纹图谱与其体外抗氧化作用的灰关联度分析[J]. 中国实验方剂学杂志,2014,20(14):76-79.
LI Yujiao, LI Qing, HE Yufei, et al. Grey relational analysis on fingerprints of extracts from Polygoni Cuspidati Rhizoma et Radix and antioxidant capacity in vitro[J]. Chin J Exp Tradit Med Form, 2014, 20(14): 76-79(in Chinese).
[26]李倩,梁宗锁,董娟娥,等. 丹参品质与主导气候因子的灰色关联度分析[J]. 生态学报,2010,30(10):2 569-2 575.
LI Qian, LIANG Zongsuo, DONG Juane, et al. Grey correlation for main climatic factors and quality of Danshen (SalviamiltiorrhizaBunge)[J]. Acta Ecologica Sinica, 2010, 30(10): 2 569-2 575(in Chinese).
[27]李峰,张振秋,丁冠华,等. 水蛭商品药材灰关联度质量评价研究[J]. 中华中医药学刊,2013,31(2):239-241.
LI Feng, ZHANG Zhenqiu, DING Guanhua, et al. Studies on quality evaluation of Hirud by grey incidence degree method[J]. China Arch Tradit Chin Med, 2013, 31(2): 239-241(in Chinese).
Determination of Multiple Active Constituents of Scrophulariae Radix with Different Processed Products and Grey Relational Analysis
WANG Sheng-nan1, HUA Yu-jiao1, ZOU Li-si1, LUO Yi-yuan1, LIU Xun-hong1, LIU Juan-xiu1, YAN Ying1, XU Li2
(1.NanjingUniversityofChineseMedicine,Nanjing210023,China;2.YangzhouInstituteforDrugControl,Yangzhou225000,China)
Scrophulariae Radix is one of the most popular traditional Chinese medicines (TCMs). Primary processing of Scrophulariae Radix is an important link which closely related to the quality of products in this TCM. A method of ultra high performance coupled with triple quadrupole liner ion trap mass spectrometry (UPLC-Qtrap-MS/MS) was established for the determination of iridoid, phenylpropanoid glycosides and organic acids in Scrophulariae Radix. The goal of the method was to investigate the influences on multiple active constituents with different processing methods of Scrophulariae Radix. Twelve multiple active constituents in Scrophulariae Radix with different processing methods were simultaneous determined by UPLC-Qtrap-MS/MS, and grey incidence degree method analysis was performed to evaluate the different processed samples according to the contents of twelve multiple active constituents. The analysis was carried out on an BDS HYPERSIL C18 column (250 mm×4.6 mm×5 μm), with elution of acetonitrile-water as mobile phase at a flow rate of 1.0 mL/min. The column temperature was 35 ℃. The target compounds were analyzed by the negative ion multiple reaction monitoring (MRM) mode. The results show that twelve multiple active constituents have good linearity (r≥0.999 0) in the range of the tested concentration. The average recoveries of the twelve components are 95.82%-99.35% with the relative standard deviations less than 2.44%. There are differences in multiple active constituents of Scrophulariae Radix with different processing methods and the processing method of air drying method and complete root by oven drying after steaming had a better quality. The method is useful for the overall assessment on quality of Scrophulariae Radix, and this study may provide the foundation and support for processing method of Scrophulariae Radix in normalization and standardization.
Scrophulariae Radix; ultra high performance coupled with triple quadrupole liner ion trap mass spectrometry (UPLC-Qtrap-MS/MS); multiple active constituents; processing methods; grey relational analysis
2016-04-20;
2016-07-04
江苏高校优势学科建设工程项目(ysxk-2014)资助
王胜男(1993—),女(汉族),江苏海门人,硕士研究生,中药鉴定专业。E-mail: jshmwsn@163.com
刘训红(1959—),男(汉族),江苏滨海人,教授,从事中药鉴定与品质评价研究。E-mail: liuxunh1959@sohu.com
O657.63
A
1004-2997(2016)03-0328-14
10.7538/zpxb.youxian.2016.0059

