基于UPLC-Q-TOF MS的吴茱萸致肝毒性部位及入血成分分析
李文兰,孙向明,陈 晨,刘 悦,宋 辉,丁晶鑫,徐蓓蕾,阎新佳
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076;2.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;
基于UPLC-Q-TOF MS的吴茱萸致肝毒性部位及入血成分分析
李文兰1,孙向明2,陈 晨1,刘 悦1,宋 辉2,丁晶鑫2,徐蓓蕾1,阎新佳1
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076;2.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;
利用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)法分析鉴定吴茱萸肝毒性部位的化学成分和给大鼠灌胃毒性部位后的血中原形成分及代谢产物。在优化的色谱和质谱条件下,采用正离子扫描模式对质量范围m/z50~1 200的化合物进行数据采集,分析时间仅为12 min。通过UNIFI软件与人工相结合的方式对采集的数据进行分析,根据高分辨质谱提供的母离子与碎片离子的精确质量信息,初步推测了化合物的分子组成;结合标准品和参考文献数据,共鉴定了肝毒性部位中的29个化学成分,其中包括9个吲哚类生物碱、10个喹诺酮类生物碱、5个三萜、3个黄酮、1个其他类生物碱和1个有机酸。进一步比较了体内外样品的基峰离子色谱图,结合质谱数据和化合物裂解规律,共鉴定出21个入血成分,包括15个原形成分和6个代谢产物(1个为未知成分),并推测了代谢产物的代谢途径。该方法可为揭示吴茱萸肝毒性成分提供可靠的数据支持。
吴茱萸;肝毒性部位;成分分析;代谢产物;超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)
吴茱萸是芸香科植物吴茱萸(Euodiarutaecarpa(Juss.) Benth.)、石虎(Euodiarutaecarpa(Juss.) Benth. var.officinalis(Dode) Huang)或疏毛吴茱萸(Euodiarutaecarpa(Juss.) Benth. var.bodinieri(Dode) Huang)的干燥近成熟果实[1],具有散寒止痛、降逆止呕、助阳止泻等功效。迄今为止,科研工作者已经从吴茱萸中分离出大量的化学成分,包含生物碱、三萜类、挥发油、黄酮类等[2-5],其中,生物碱作为吴茱萸的主要效应成分显现出多种生物活性[6-8]。
历代中国本草专著中记载吴茱萸“有毒”或“小毒”。有报道[9]称,有人因大剂量服用吴茱萸出现视物模糊、头痛、胸闷、剧烈腹痛等症状。近年来,关于吴茱萸具有肝毒性的报道日益增多,其对人类造成的肝毒性影响受到学者们的广泛关注[10-12]。本课题组前期的吴茱萸致肝毒性部位筛选的实验结果表明:给小鼠连续灌胃吴茱萸的50%乙醇提取物14 d,可导致小鼠的肝体系数、血清中谷丙转氨酶、谷草转氨酶显著升高,确定50%乙醇提取物为吴茱萸发挥致肝毒性的有效部位。目前的研究仅局限于吴茱萸肝毒性及其机制[13-16],尚未见吴茱萸致肝毒性的物质基础和作用形式的报道。因此,存在严重的用药安全隐患,限制了其临床的应用和拓展。
肝脏的病理状态会影响药物在体内的代谢过程。本工作以吴茱萸致肝毒性后的大鼠为研究对象,采用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)法对吴茱萸的肝毒性部位化学成分和血中的代谢产物进行鉴定,并推测其可能的代谢途径,以期发现吸收入血的成分及代谢产物,为揭示吴茱萸肝毒性的化学物质基础提供理论依据。
1 实验部分
1.1 仪器、试剂与材料
Acquity UPLC I-Class超高效液相色谱与Xevo G2-S Q-TOF四极杆飞行时间质谱联用仪:美国Waters公司产品;XW-80A涡旋混合器:上海宇工机械有限公司产品;Allegra 64R低温高速离心机:美国贝克曼库尔有限公司产品。
吴茱萸:购自哈尔滨三棵树药材市场,经哈尔滨商业大学张德连教授鉴定为吴茱萸Evodiarutaecarpa(Juss.) Benth;辛弗林、绿原酸、芦丁、金丝桃苷、柠檬苦素、吴茱萸碱、吴茱萸次碱对照品:均购自中国药品生物制品检验所;纯净水:屈臣氏公司产品;甲醇、乙腈、甲酸均为色谱纯;其余试剂均为分析纯。
雄性Wistar大鼠(质量为(250±20) g,批号:SCXK-(吉)2003-2004):购自长春国家生物产业基地实验动物中心。
1.2 灌胃和供试品溶液的制备
1.2.1 灌胃溶液的制备 取吴茱萸粗粉适量,用50%乙醇浸泡12 h后加热回流提取,溶剂用量及提取时间为8倍量120 min(1次)、7倍量90 min(1次),合并2次提取液,减压浓缩,得到浸膏,储存于冰箱中,备用。给药前,用蒸馏水溶解成约1.4 g/mL生药材的灌胃药液,备用。
1.2.2 体外药材溶液的制备 称取浸膏适量(相当于0.5 g生药材),用甲醇充分溶解,定容至25 mL容量瓶中;精密吸取1 mL,用甲醇稀释10倍,过0.22 μm微孔滤膜,备用。
1.2.3 对照品溶液的制备 称取辛弗林、绿原酸、芦丁、金丝桃苷、柠檬苦素、吴茱萸碱、吴茱萸次碱各1 mg,用甲醇溶解并定容至10 mL容量瓶中,过0.22 μm微孔滤膜,备用。
1.3 给药与样品收集
将大鼠随机分为空白组和给药组,每组6只,适应性喂养一周,期间自由饮水。以35 g/(kg·d)(按生药计)的剂量给大鼠灌胃,每天1次,连续灌胃给药14 d(本课题组前期的实验结果表明,给药14 d对大鼠肝脏有一定的蓄积毒性作用);空白组大鼠每天给予同体积的蒸馏水,于第13天灌胃给药后禁食(自由饮水),末次给药60 min后,以2 mL/kg的剂量腹腔注射水合氯醛(10%)进行麻醉,肝门静脉取血7 mL,室温放置30 min,待充分凝血后,以3 000 r/min离心15 min,小心吸取上清液,即为待测血清。
1.4 生物样品的制备
取3.0 mL血清样品,加入12.0 mL甲醇,于离心管中充分涡旋混匀1 min,再以14 000 r/min离心10 min,小心吸取上清液,氮气吹干;用微量移液器精密加入0.5 mL甲醇,充分溶解残留物,过0.22 μm微孔滤膜,得血清供试品溶液。
1.5 实验条件
1.5.1 色谱条件 色谱柱:HSS T3(100 mm×2.1 mm×1.8 μm);柱温40 ℃;检测波长300 nm;流动相:A为0.1%甲酸-水溶液,B为0.1%甲酸-乙腈溶液;梯度洗脱程序:0~0.3 min(1%B),0.3~2 min(1%~15%B),2~4 min(15%~25%B),4~6 min(25%~55%B),6~8 min(55%~70%B),8~12 min(70%~99%B);流速0.5 mL/min;进样量0.2 μL。
1.5.2 质谱条件 离子化模式:大气压电喷雾正离子扫描模式(ESI+);毛细管电压2.5 kV;源温度120 ℃;雾化气温度500 ℃;雾化气流速800 L/h;锥孔气流速10 L/h;采集模式:MSE;质量扫描范围m/z50~1 200;低碰撞能量4.0 eV,高碰撞能量20.0~45.0 eV;数据采集时间12 min。实验采用UNIFI 1.7软件结合天然产物数据库进行数据处理。
2 结果与讨论
2.1 肝毒性部位化学成分的UPLC-Q-TOF MS分析
应用UPLC-Q-TOF MS法对吴茱萸肝毒性部位进行定性分析,共表征了29个化学成分,其色谱图示于图1。通过与对照品的保留时间和一、二级质谱信息进行比较,可以确定辛弗林、绿原酸、芦丁、金丝桃苷、柠檬苦素、吴茱萸碱、吴茱萸次碱7个化合物的化学结构。利用UNIFI1.7软件与人工相结合进行分析,通过准分子离子峰的质荷比(m/z)可以初步判断化合物的元素组成和经验分子式,并与已知化合物进行匹配,参考化合物的裂解规律,由碎片离子做进一步的验证。根据上述解析原则,结合数据库检索、各级质谱信息和文献报道,对化学成分进行结构推测[2-4,17-21],结果列于表1。检测到的29个化合物中包括9个吲哚类生物碱(化合物3、8~9、12、15~19),10个喹诺酮类生物碱(化合物20~29),5个三萜类(化合物4、10、11、13~14),3个黄酮类(化合物5~7),1个其他类生物碱(化合物1)和1个有机酸(化合物2)。
每类化合物的解析举例如下:化合物8为[M+H]+m/z302.130 1,推断其分子式为C19H15N3O,碎片离子m/z286.097 8与母离子相差16.032 3 u,为母离子丢失N-14位的CH3后形成[M+H-CH3+H]+碎片离子,此碎片进一步中性丢失1个CO基团(28.008 4 u),产生m/z258.089 4[M+H-CH3+H-CO]+碎片离子,推测为去氢吴茱萸碱;化合物20为[M+H]+m/z286.216 6,推断其分子式为C19H27NO,母离子中性丢失1个C4H8产生m/z230.125 8[M+H-3CH2-CH3+H]+碎片离子,丰度较高的是喹诺酮类生物碱常见的m/z186.092 1和m/z173.084 3碎片离子,主要是由碳链上电子重排和化学键断裂而丢失部分侧链结构形成的稳定共轭结构,这两种离子在质谱中有较高的丰度,推测为1-甲基-2-壬基-4(1H)喹诺酮;化合物11为[M+H]+m/z485.180 3,推断其分子式为C26H28O9,碎片离子m/z439.173 3与母离子相差46.007 u,为1个CH2O2,产物为[M+H-CO2-H2]+,母离子在高能量碰撞下断裂,丢失C16H19O7碎片形成特征离子m/z161.059 5,推测为吴茱萸内酯醇;化合物5为[M+H]+m/z611.160 8,推测其分子式为C27H30O16,碎片离子m/z465.100 8与母离子相差146.06 u,恰好为母离子丢失寡糖链末端的鼠李糖基,m/z303.049 7为母离子丢失整个寡糖链获得的碎片离子,与标准品一致,推测为芦丁;化合物1为[M+H-H2O]+m/z150.091 3,在一级质谱中未见[M+H]+峰,可见此结构不稳定,侧链的羟基易发生断裂,失去1个H2O形成m/z150.091 3碎片离子,此碎片发生α断裂,脱掉侧链的1个CH3形成m/z136.067 5[M+H-CH3+H]+碎片离子,与标准品一致,推测为辛弗林[22];化合物2为[M+H]+m/z355.101 4,推测其分子式为C16H18O9,m/z163.039 1和m/z193.063 2为母离子在高能量碰撞下前体离子酯键断裂产生的碎片离子,与标准品一致,推测为绿原酸。各代表化合物及标准品的二级质谱和结构示于图2。
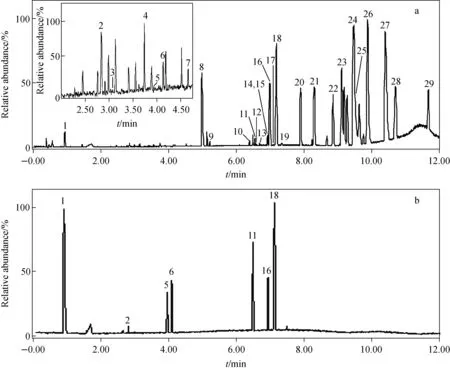
图1 正离子模式下,吴茱萸肝毒性部位(a)和7个混合对照品(b)的基峰离子色谱图Fig.1 Base-peak ion (BPI) chromatograms of Euodia rutaecarpa hepatotoxic part (a) and 7 mixture standards (b) in positive ion mode
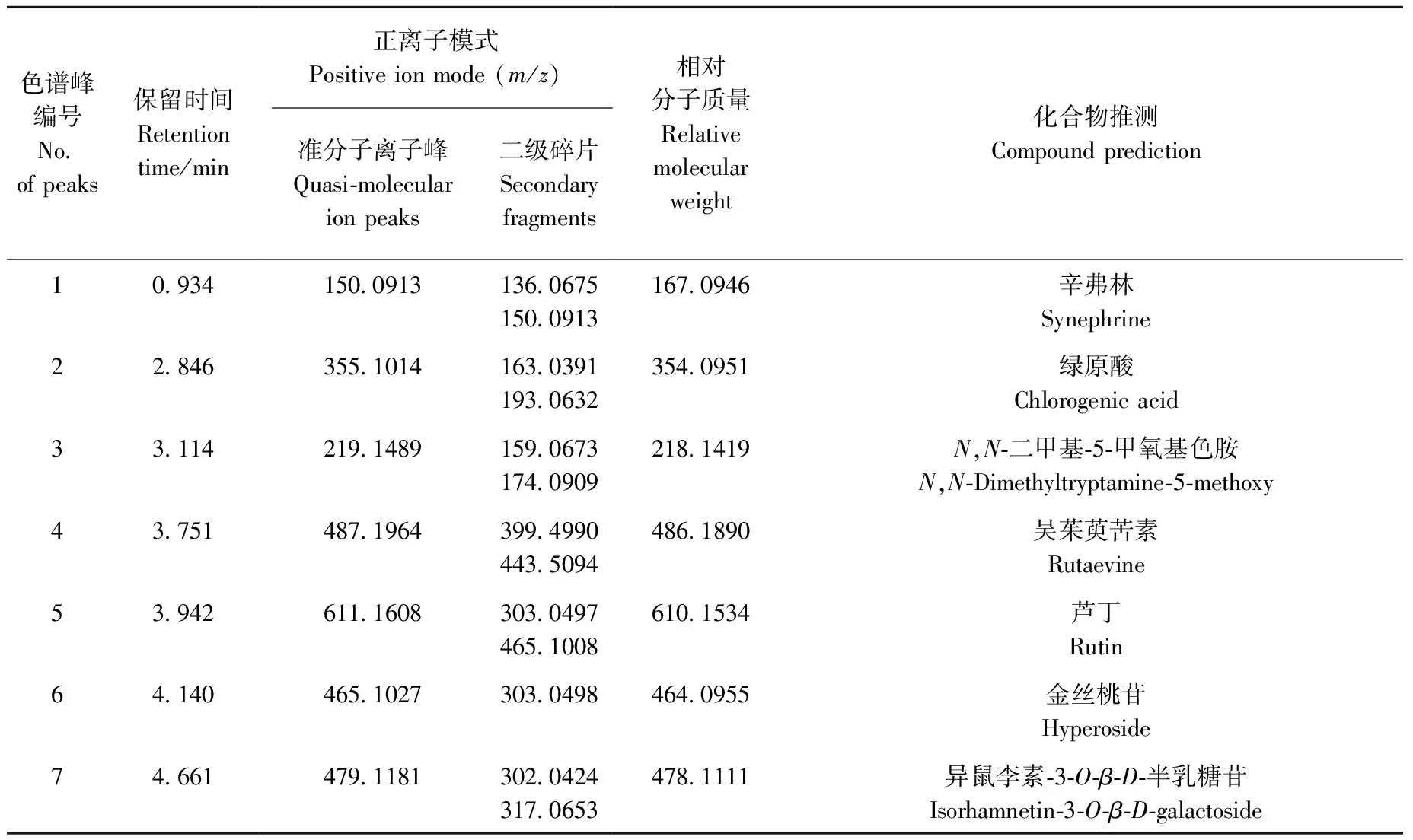
表1 吴茱萸肝毒性部位的UPLC-Q-TOF MS数据及化学成分识别Table 1 UPLC-Q-TOF MS data and chemical compositions of Euodia rutaecarpa hepatotoxic part
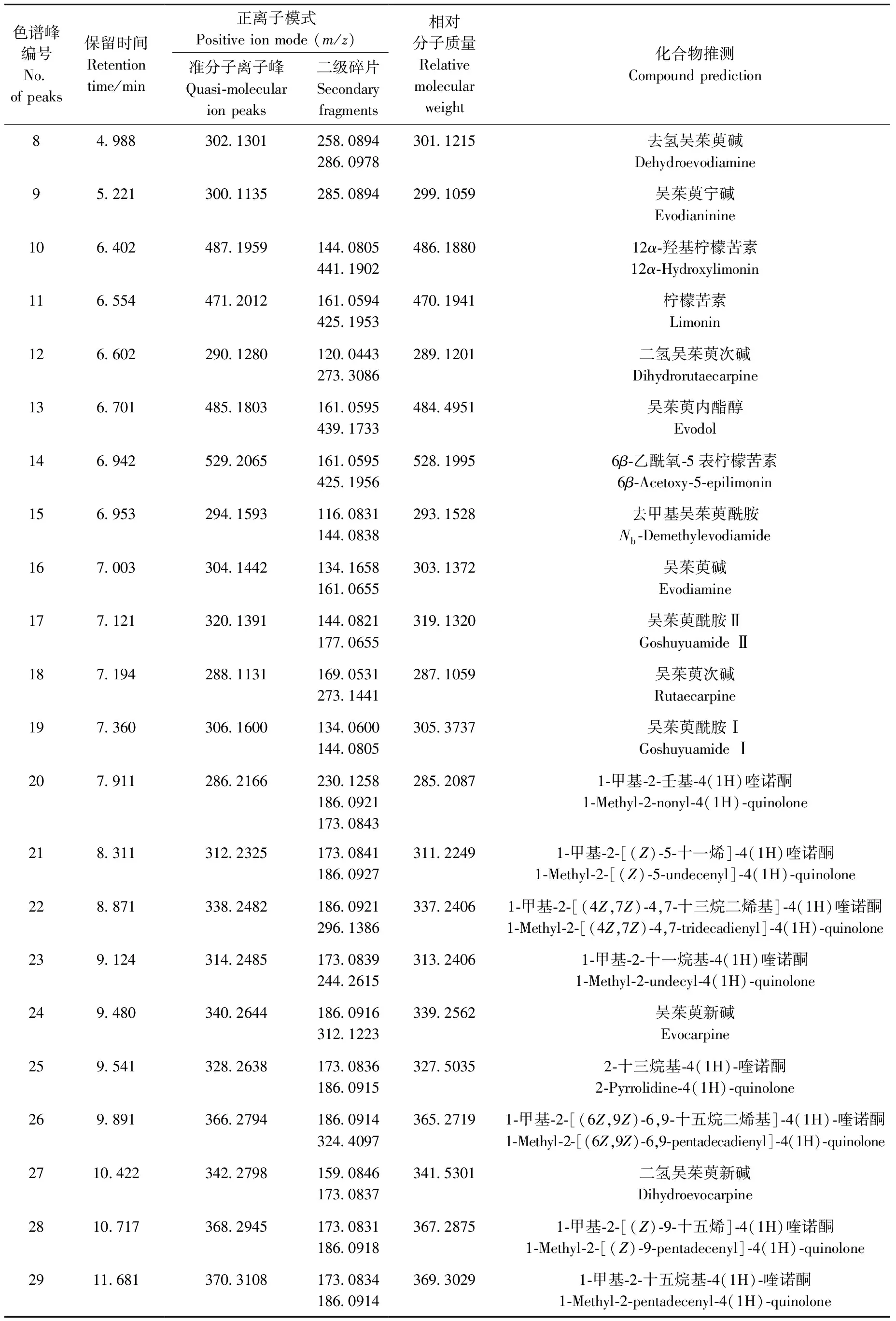
续表1
2.2 肝毒性部位入血成分的UPLC-Q-TOF MS分析
采用UPLC-Q-TOF MS法对灌胃吴茱萸肝毒性部位后的大鼠血清及空白血清进行分析,共检测到21个入血成分,通过与肝毒性部位各化学成分的保留时间和质谱数据比对,发现其中15个成分为原形成分,6个成分为代谢产物(a~f号峰),示于图3和表2。
代谢产物的鉴定过程如下[23-27]:化合物a为未知结构化合物;化合物b为[M+H]+m/z318.123 2,推断其分子式为C19H15N3O2,碎片离子m/z302.128 7与母离子相差15.994 5 u,为母离子中性丢失1个O产生[M+H-OH+H]+,此结构进一步失去1个CH4形成[M+H-CH4]+m/z286.097 8碎片离子,推测为羟基去氢吴茱萸碱;化合物c为[M+H]+m/z288.323 3,推测其分子式为C18H13N3O,碎片离子m/z274.295 9与母离子相差14.027 4 u,为母离子中性失去1个CH2产生[M+H-CH3+H]+,碎片离子m/z260.313 2与母离子相差28.010 1 u,为母离子丢失1个CO,推测为去甲基去氢吴茱萸碱;化合物d为[M+H]+m/z318.351 0,推断其分子式为C19H15N3O2,母离子具有—N—CHO结构,该结构中的羰基吸电子加大了碳氮键偶极矩,断裂形成了m/z290.339 1碎片离子,母离子环己烯结构在高能量碰撞下发生RDA断裂,产生m/z171.048 4、m/z144.139 1碎片离子,推测为14-甲酰基二氢吴茱萸次碱;化合物e为[M+H]+m/z304.108 6,推断其分子式为C18H13N3O2,碎片离子m/z288.112 2与母离子相差15.996 4 u,为母离子失去1个O产生[M+H—OH+H]+,此结构的环内叔胺碳氮键断裂丢失1个NH产生[M+H-NH]+m/z273.144 3碎片离子,推测为羟基吴茱萸次碱;化合物f为[M+H]+m/z320.139 5,推断其分子式为C19H17N3O2,m/z187.217 8、m/z134.155 2为母离子的环己烯结构在质谱碰撞电压轰击下发生RDA断裂形成的特征碎片离子,推测为羟基吴茱萸碱。各代谢产物的二级质谱和结构示于图4。
2.3 代谢产物的代谢途径分析
吴茱萸肝毒性部位的多数成分以原形入血,推测有4个原形成分入血的同时发生了Ⅰ相和Ⅱ相代谢,产生了5个代谢产物(2.2节中提到的6个代谢产物中有1个未知产物未能鉴定),示于图5。去氢吴茱萸碱通过去甲基化和羟基化代谢产生了去甲基去氢吴茱萸碱和羟基去氢吴茱萸碱。推测14-甲酰基二氢吴茱萸次碱可能为二氢吴茱萸次碱的甲酰基化产物。吴茱萸次碱和吴茱萸碱在体内可能发生了甲基化,代谢为羟基吴茱萸次碱和羟基吴茱萸碱。

图2 代表化合物及对应标准品的二级质谱图和结构图Fig.2 Secondary mass spectrograms and structures of representative compounds and corresponding standards

图3 吴茱萸肝毒性部位(a)、含药血清(b)和空白血清(c)的基峰离子色谱图Fig.3 Base-peak ion (BPI) chromatograms of Euodia rutaecarpa hepatotoxic part (a), medicated serum (b) and blank serum (c)

表2 大鼠血清中肝毒性部位的原形及代谢成分Table 2 Prototype and metabolic components of hepatotoxic part in rat serum

续表2
注:A表示原形成分,B表示代谢成分
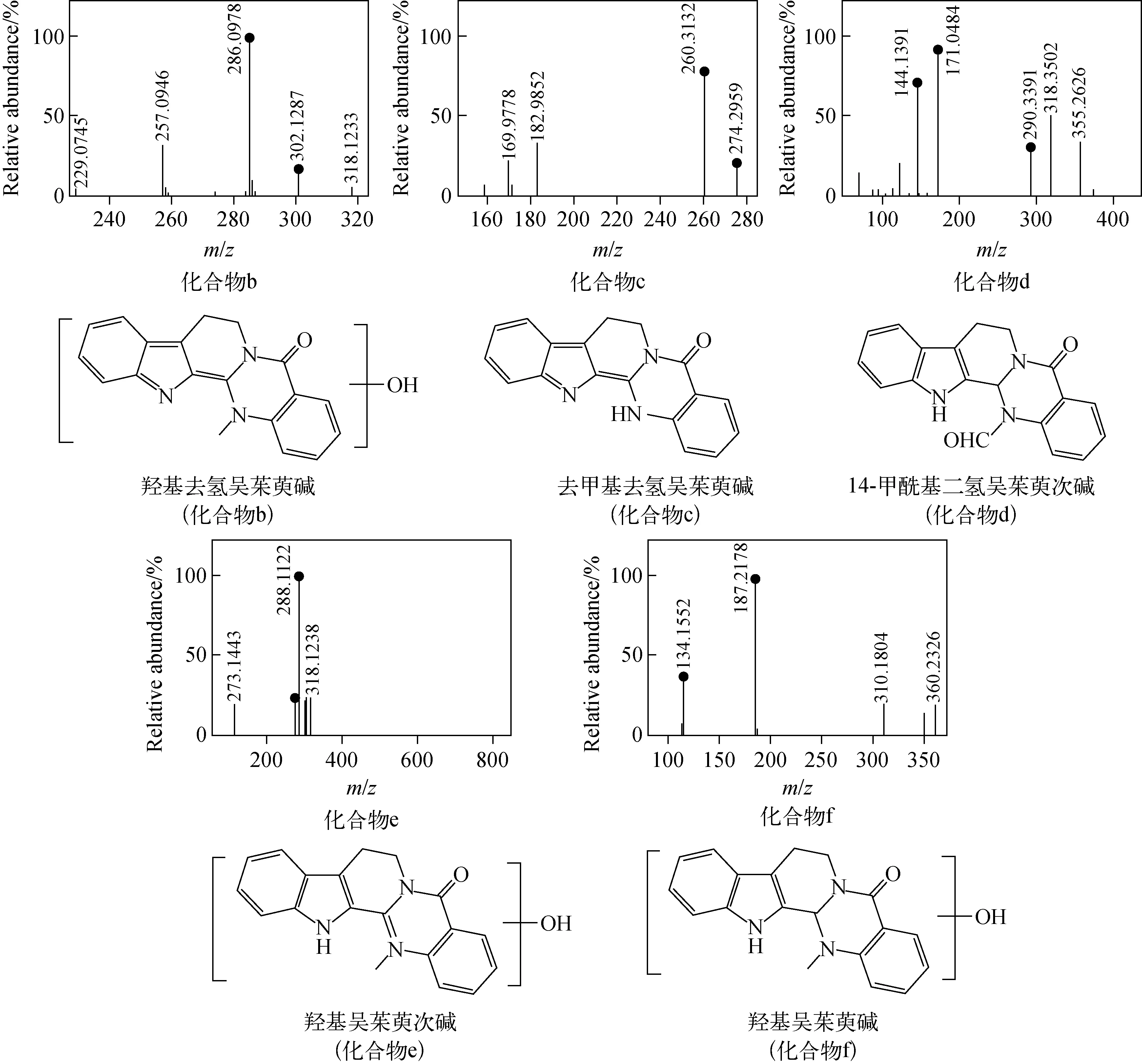
图4 代谢产物的二级质谱图和结构图Fig.4 Secondary mass spectrograms and structures of metabolites
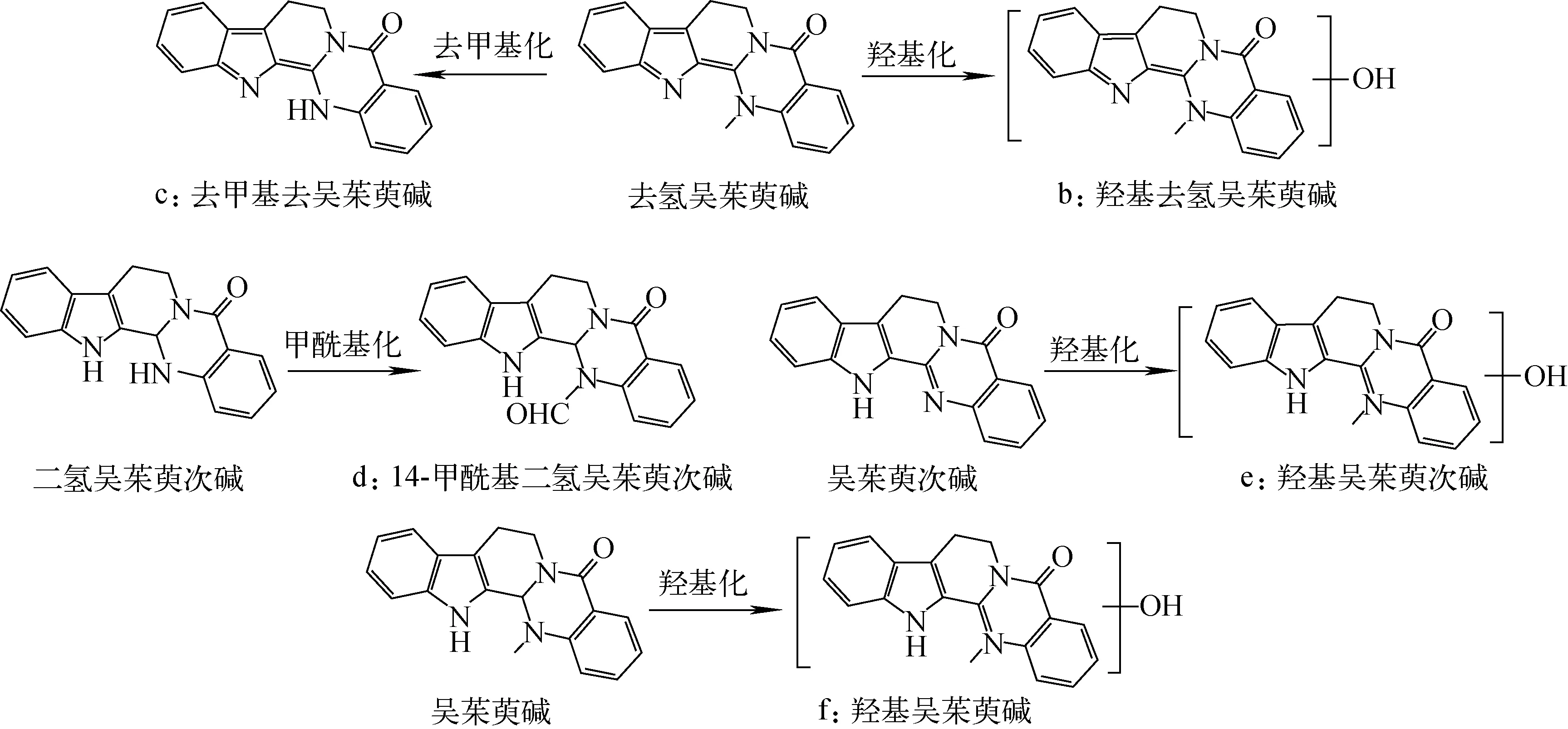
图5 吴茱萸在大鼠血浆中的代谢途径Fig.5 Metabolic pathways of Euodia rutaecarpa in rat serum
3 结论
采用UPLC-Q-TOF MS法对吴茱萸肝毒性部位及其入血成分进行分析,在肝毒性部位中检测并鉴定了29个化学成分,在含药血清中检测到21个入血成分,包括6个代谢产物(其中一个为未知成分),并推测其代谢途径。这为阐明吴茱萸致肝毒性的物质基础提供了参考,也为吴茱萸的临床应用提供了依据。
[1] 中国药典委员会. 中华人民共和国药典(一部)[M]. 北京:化学工业出版社,2010.
[2] SUGIMOTO T, MIYASE T, KUROYANAGI M, et al. Limonoids and quinolone alkaloids fromEvodiarutaecarpaBentham[J]. Chemical and Pharmaceutical Bulletin, 1988, 36(11): 4 453-4 461.
[3] TANG Y Q, FENG X Z, HUANG L. Quinolone alkaloids fromEvodiarutaecarpa[J]. Phytochemistry, 1996, 43(3): 719-722.
[4] TANG Y Q, FENG X Z, HUANG L. Studies on the chemical constituents ofEvodiarutaecarpaBenth[J]. Journal of Chinese Pharmaceutical Sciences, 1996, 31(2): 151-155.
[5] CAI G X, HUANG D, LI S X, et al. Comparative analysis of essential oil components ofEvodiarutaecarpa(Juss.) Benth. var. officinalis (Dode) Huang andEvodiarutaecarpa(Juss.) Benth[J]. Natural Product Research, 2012, 26(19): 1 796-1 798.
[6] XU Y, LIU Q, XU Y, et al. Rutaecarpine suppresses atherosclerosis in ApoE-/- mice through upregulating ABCA1 and SR-BI within RCT[J]. Journal of Lipid Research, 2014, 55(8): 1 634-1 647.
[7] WEN Z, FENG S, WEI L, et al. Evodiamine, a novel inhibitor of the Wnt pathway, inhibits the self-renewal of gastric cancer stem cells[J]. International Journal of Molecular Medicine, 2015, 36(6): 657-663.
[8] ZHAO N, LI Z L, LI D H. Quinolone and indole alkaloids from the fruits of Euodia rutaecarpa and their cytotoxicity against two human cancer cell lines[J]. Phytochemistry, 2015, 109: 133-139.
[9] 蔡雪映,孟楠,杨冰. 服用吴茱萸过量致中毒1例分析[J]. 北京中医药,2006, 25(3): 171-172.
CAI Xueying, MENG Nan, YANG Bing. Analysis of one poisoning case caused by excessiveEvodiaefructus[J]. Beijing Journal of TCM, 2006, 25(3): 171-172(in Chinese).
[10]COHEN S M, HEYWOOD E. Hepatotoxicity associated with the use of white flood, a nutritional supplement[J]. Practical Gastroenterology, 2012, 10: 45-48.
[11]TESCHKE R, WOLFF A, FRENZEL C, et al. Review article: herbal hepatotoxicity-an update on traditional Chinese medicine preparations[J]. Aliment Pharmacol Ther, 2014, 40(1): 32-50.
[12]周绮,张茜,金若敏. 吴茱萸致小鼠肝毒性时效、量效关系研究[J]. 中国实验方剂学杂志,2011,17(9):232-235.
ZHOU Qi, ZHANG Qian, JIN Ruomin. Time-effect and dose-effect ofEvodiarutaecarpaon hepatotoxicity in mice[J]. Chin J Exp Tradit Med Formulae, 2011, 17(9): 232-235(in Chinese).
[13]黄伟,李晓骄阳,孙蓉. 吴茱萸水提组分多次给药对小鼠肝毒性的“量-时-毒”关系研究[J]. 中国中药杂志,2012, 37(15): 2 223-2 227.
HUANG Wei, LI Xiaojiaoyang, SUN Rong. “Dose-time-toxicity” relationship study on hepatotoxicity caused by multiple dose water extraction components ofEvodiaefructusto mice[J]. China Journal of Chinese Materia Medica, 2012, 37(15): 2 223-2 227(in Chinese).
[14]李晓宇,吴晓文,窦立雯,等. 吴茱萸挥发油多次给药致小鼠肝毒性氧化损伤机制研究[J]. 中国药物警戒,2015,12(1):16-19.
LI Xiaoyu, WU Xiaowen, DOU Liwen, et al. Research of oxidative damage mechanism on hepatotoxicity caused by volatile oil fromEvodiafructusin mice[J]. Chinese Journal of Pharmacovigilance, 2015, 12(1): 16-19(in Chinese).
[15]CAI Q, WEI J, ZHAO W, et al. Toxicity ofEvodiaefructuson rat liver mitochondria: the role of oxidative stress and mitochondrial permeability transition[J]. Molecules, 2014, 19(12): 21 168-21 182.
[16]廖文强,李波,李莉,等. 吴茱萸致小鼠肝毒性分子机制研究[J]. 中国中药杂志,2014,39(24):4 865-4 868.
LIAO Wenqiang, LI Bo, LI Li, et al. Study on molecular mechanism ofEuodiaefructuson liver toxicity in mice[J]. China Journal of Chinese Materia Medica, 2014, 39(24): 4 865-4 868(in Chinese).
[17]CHEN Y, MONSHOUWER M, FITCH W L. Analytical tools and approaches for metabolite identification in early drug discovery[J]. Pharmaceutical Research, 2007, 24(2): 248-257.
[18]CASTRO-PEREZ J M. Current and future trends in the application of HPLC-MS to metabolite identification studies[J]. Drug Discovery Today, 2007, 12(5/6): 249-256.
[19]SHOJI N, UMEYAMA A, IUCHI A, et al. Two novel alkaloids fromEvodiarutaecarpa[J]. Journal of Natural Products, 1989, 52(5): 1 160-1 162.
[20]邱时祎. 吴茱萸中生物碱的分离纯化和质谱表征[D]. 上海:华东理工大学,2013.
[21]高鹏,王灵芝,邬瑞光,等. 吴茱萸碱和吴茱萸次碱电喷雾-离子阱质谱裂解途径研究[J]. 药物分析杂志,2012,32(5):772-774.
GAO Peng, WANG Lingzhi, WU Ruiguang, et al. ESI-ion-trap MS study on fragmentation pathways of evodiamine and rutecarpine[J]. Chinese Journal of Pharmaceutical Analysis, 2012, 32(5): 772-774(in Chinese).
[22]马微,马强,朱明达,等. 超高效液相色谱-串联质谱测定减肥保健食品中辛弗林及其电喷雾质谱裂解途径研究[J]. 分析科学学报,2010,26(6):636-640.
MA Wei, MA Qiang, ZHU Mingda, et al. ESI fragmentation study and determination of synephrine in the weight-loss functional foods by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science, 2010, 26(6): 636-640(in Chinese).
[23]廖琼峰,谢智勇,张蕾,等. 吴茱萸中吲哚喹唑啉类生物碱和吴茱萸内酯的质谱裂解分析[J]. 中药材,2008,31(5):673-676.
LIAO Qiongfeng, XIE Zhiyong, ZHANG Lei, et al. Mass spectrometric analysis of quinazoline alkaloid and limonin from Fructus Evodiae[J]. Journal of Chinese Medicinal Materials, 2008, 31(5): 673-676(in Chinese).
[24]李丽. 吴茱萸碱、吴茱萸次碱和左旋四氢巴马亭在微生物和大鼠体内的代谢研究[D]. 沈阳:沈阳药科大学,2005.
[25]SUN H Z, FANG Z Z, CAO Y F, et al. Investigation of the in vitro metabolism of evodiamine characterization of metabolites and involved cytochrome p450 isoforms[J]. Phytotherapy Research, 2013, 27(5): 705-712.
[26]UENG Y F, DON M J, JAN W C, et al. Oxidative metabolism of the alkaloid rutaecarpine by human cytochrome P450[J]. Drug Metabolism and Disposition the Biological Fate of Chemicals, 2006, 34(5): 812-827.
[27]LIN L C, LI S H, WU Y T, et al. Pharmacokinetics and urine metabolite identification of dehydroevodiamine in the rat[J]. Journal of Agricultural and Food Chemistry, 2012, 60(7): 1 595-1 604.
Analysis ofEuodiarutaecarpaHepatotoxic Part and Absorbed Components in Rat Serum Based on UPLC-Q-TOF MS
LI Wen-lan1, SUN Xiang-ming2, CHEN Chen1, LIU Yue1, SONG Hui2, DING Jing-xin2, XU Bei-lei1, YAN Xin-jia1
(1.SchoolofPharmacy,HarbinUniversityofCommerce,Harbin150076,China; 2.ResearchCenteronLifeSciencesandEnvironmentalSciences,HarbinUniversityofCommerce,Harbin150076,China;
A method of ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF MS) was established to analyze the chemicals inEuodiarutaecarpahepatotoxic part and metabolic components in rat blood. Under the optimized condition of chromatography and mass spectrometry, the data collection for the compounds in the mass range ofm/z50-1 200 was performed using positive ion scanning mode within 12 min. The collected data were analyzed based on UNIFI software combined with artificial analysis. According to the precise mass information of precursor ions and fragment ions offered by high resolution mass spectrometry, the molecule composition of compound was preliminarily speculated. Finally, a total of 29 constituents in hepatotoxic part are identified combined with substances and reference data, including 9 indole alkaloids, 10 quinolone alkaloids, 5 triterpenoids, 3 flavonoids, one other alkaloid and one organic acid. 21 compounds in blood are characterized, including 15 prototypes and 6 metabolites (a compound unknown) by comparing the base peak ion chromatograms of samples in vivo and in vitro combined with MS data, compound fragmentation laws and published literatures. The metabolic pathways of metabolites were further speculated. This method can provide, a reliable data support to indicate hepatotoxic components ofEuodiarutaecarpa.
Euodiarutaecarpa; hepatotoxic part; constituent analysis; metabolites; ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF MS)
2016-06-30;
2016-09-13
哈尔滨市科技局科技创新人才项目(2015RQXXJ011);黑龙江省教育厅科研项目(12541192)资助
李文兰(1967—),女(汉族),河北人,教授,从事中药药效物质基础研究。E-mail: lwldzd@163.com
O657.63
A
1004-2997(2016)03-0282-12
10.7538/zpxb.youxian.2016.0065
——以吴茱萸为例

