问题引领下的习题教学能级目标设计
薛青峰+陈波
摘要:以“铝及其化合物”的高三化学习题教学过程中的问题设计及变式习题的选择为例,介绍了习题教学中的三层能级目标的设计,从习题教学应有的三个功能“问题解决、知识应用、思维迁移”出发,提出了“知事明理、举一反三、触类旁通”三层能级的教学目标。
关键词:习题教学;能级目标;问题引领;铝及其化合物;化学教学
文章编号:1005–6629(2017)5–0081–04 中图分类号:G633.8 文献标识码:B
习题教学是课堂教学的重要组成部分,是新课教学的有益补充和拓展,也是中学课堂培养学生迁移能力的一种重要途径。通过习题教学不但有助于学生更好地掌握相关的重点内容,强化学生对某些基本概念或原理的记忆或理解,而且也可以提高学生解题技巧,培养学生灵活运用所学知识解决实际问题的能力。因此,习题课已经成为高三课堂教学的一种重要组织形式,如何提升习题教学的有效性也成为广大一线教师教学研究的重点。笔者认为,在组织习题教学时应该设立知事明理(问题解决)、举一反三(知识应用)和触类旁通(思维迁移)三层能级目标,知事明理目标是指帮助学生解决习题本身必须解决的问题,并为灵活运用知识打下基础;举一反三目标是指在相应变式训练过程中加深对所学知识的理解与深化,培养学生知识类比和迁移的能力;触类旁通目标是指在相关延伸训练中培养学生方法类比和思维迁移的能力。
下面以“铝及其化合物”的高三习题教学为例探讨习题教学中的三层能级目标的教学设计,有不当之处请同行批评指正。
例题:现测得某0.1 mol/L AlCl3溶液的pH=1,取该溶液100mL,向其中逐滴加入0.1 mol/L的NaOH溶液,当生成0.39g沉淀时,求加入NaOH溶液的体积。
1 第一能级:知事明理——问题解决
习题教学的首要任务应该是通过教师的讲解或点拨,学生能领会解决本题的要点所在,理解解决本题的基本思路,并能最终独立解决本题。也就是说,学生不仅要知其然,还要知其所以然,这也是习题教学的基本要求。
第一层能级目标:通过图示和对比教学,让学生认识在铝盐溶液和强碱溶液反应中存在的“量”的变化规律,体会“两种可能性”结论存在的客观条件。
在实际教学中,笔者设计了如下问题引领学生思考:
问题1:生成沉淀的质量最多有多少克?
问题2:如果做此实验,你将会看到什么现象?并说明理由。
问题3:你能用坐标图像表示出生成沉淀的质量与滴加NaOH溶液的体积之间的关系吗?
问题4:如果滴加的是氨水,坐标图像与上述图像显著差异在哪儿?
问题1和问题2主要唤醒学生对此内容所涉及学科知识的记忆,让学生意识到试题结论存在“两种可能性”;问题3(图像如图1所示)采用数形结合的方式让学生直观体会“两种可能性”结论的存在;问题4让学生明确Al(OH)3沉淀只能溶于强碱而不能溶于氨水,因此其最大差异在于沉淀量达到最大后是不会随氨水加入而减少的,使学生进一步理解存在“两种可能性”结论的客观条件。
2 第二能级:举一反三——知识应用
为了提高学生解题能力和知识应用能力,适当的变式训练是必不可少的。同一知识点虽然可以在不同的问题情境中出现,但本质却是不变的。通过对习题所承载的知识系统的归纳整理,加深学生对本知识系统的理解,提高学生应用本知识体系解决具体问题的能力,使学生能够举一反三。这是习题教学的较高要求。
第二层能级目标:通过变式训练教学,让学生从多角度理解铝盐溶液与强碱溶液反应并能应用于新情境问题的解决。
变式1:在强力搅拌的条件下,向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液的体积的关系如图2所示。计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀。
求:(1)原混合溶液中:
c(Fe3+)= 。
(2)当生成的沉淀总物质的量为0.15mol时,则加入NaOH的物質的量是 。
变式1旨在帮助学生进一步熟悉有关铝盐溶液与强碱溶液反应时,两者的比例对沉淀量的影响;与原例题相比,只是增加了Fe(OH)3沉淀干扰项,因此问题解决思路与原例题也基本相同。但由于等物质的量的Fe3+和Al3+生成沉淀时消耗NaOH的量相同,因此在处理沉淀量与消耗NaOH的量之间关系时,可以将Fe3+等同于Al3+进行简化处理。
通过该变式训练,进一步帮助学生厘清铝盐溶液与强碱溶液反应时的变化规律,培养学生思维的灵活性和敏捷性,加深理解“量变”引发“质变”的辩证唯物主义观。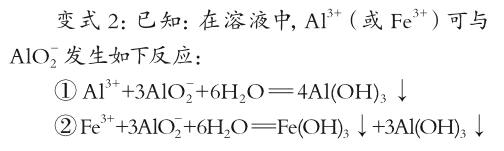
现向500mL某浓度的NaOH溶液中逐滴加入某FeCl3和AlCl3的混合溶液,生成沉淀的物质的量与滴加混合溶液的体积关系如图3所示。试回答下列问题:
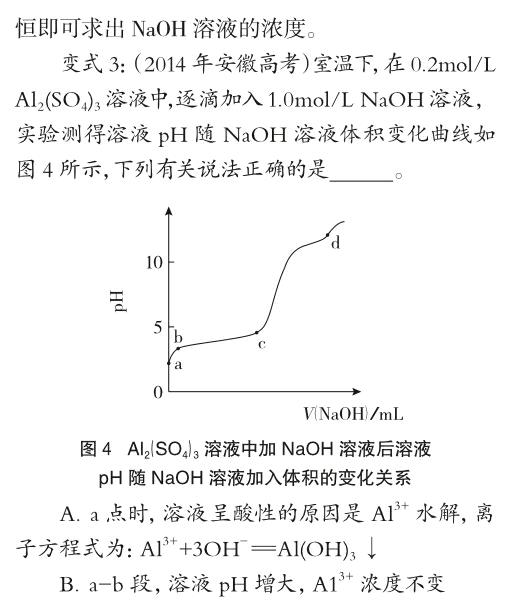
C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
变式3是变式1的另一种呈现方式,Al3+水解使溶液呈酸性,从图像可以看出,刚开始滴加的NaOH溶液会使溶液的pH突然变大,也就是说溶液的H+浓度突然变小,因此Al3+水解平衡向右移动,Al3+浓度变小;图像中的两段平缓部分应该是加入的NaOH都被消耗的缘故,第一段是生成Al(OH)3,第二段是Al(OH)3溶解,至d点曲线又突然变陡,即pH发生突变,说明Al(OH)3已完全溶解。

