重组腺病毒pCMV-NM23-IRES-EGFP载体的构建及鉴定
曾 理,唐泽飞,李春鸣
(遵义医学院附属医院 病理科,贵州 遵义 563099)
临床医学研究
重组腺病毒pCMV-NM23-IRES-EGFP载体的构建及鉴定
曾 理,唐泽飞,李春鸣
(遵义医学院附属医院 病理科,贵州 遵义 563099)
目的 构建携带有NM23的重组腺病毒载体并观察其对人胃癌细胞株BGC-823凋亡的影响。方法 以质粒NM23-PIRES2-EGFP为模版,采用PCR扩增NM23基因,克隆至腺病毒载体pCMV-MCS-IRES-EGFP上,形成重组腺病毒载体pCMV-NM23-IRES-EGFP并酶切鉴定及基因测序。将人胃癌细胞株BGC-823分为实验组(NM23-OE组,感染pCMV-NM23-IRES-EGFP)、空白组(Ctrl组),阴性对照组(NC组,感染pCMV-MCS-IRES-EGFP);Real Time PCR和Western Blot分别检测3组细胞中NM23mRNA和蛋白表达;流式细胞仪检测3组细胞凋亡率。结果 经酶切鉴定和基因测序证实成功构建重组腺病毒pCMV-NM23-IRES-EGFP;经扩增后,重组腺病毒的滴度为4.0×1010ifu/mL ;RT-PCR及Western blot结果显示,阴性对照组与空白组相比差异无统计学意义(P>0.05),而实验组的NM23的mRNA和蛋白表达显著高于其他两组(P<0.05);实验组BGC-823细胞的凋亡率也显著高于其他两组(P<0.05)。结论 成功构建了过表达NM23的重组腺病毒pCMV-NM23-IRES-EGFP载体,通过上调NM23基因的表达,可观察到胃癌细胞株BGC-823的凋亡水平有明显升高,为后续研究NM23基因对人胃腺癌细胞生物学功能的影响提供实验基础。
NM23;载体;BGC-823;腺病毒;凋亡
NM23基因最早发现于1988年,是由美国国立癌症研究所的Steeg等[1]用消减杂交分离的方法从7个K-1735小鼠黑色素瘤细胞株中分离出来并克隆成功。作为第一个被发现的肿瘤转移抑制基因,NM23基因在多种肿瘤细胞中呈现低表达或不表达[2-3],而这种表达的缺失对肿瘤的浸润转移起重要作用。Radovic等[4]研究发现,与正常胃黏膜相比NM23基因在胃腺上皮细胞癌中呈现低表达。孙端[5]发现胃癌组织中NM23基因表达的缺失可导致临床TMN分期的加重。
作为目前应用最为广泛的载体之一,腺病毒载体具有宿主范围广、感染率高、安全性好等诸多优点[6]。本实验采用AdMax系统的第三代腺病毒,通过构建携带NM23基因的重组腺病毒载体并感染人胃癌细胞株BGC-823,从而获得稳定过表达NM23基因的人胃癌细胞株BGC-823,为后续研究NM23基因对人胃腺癌细胞生物学功能的影响提供实验基础。
1 材料与方法
1.1 实验材料与试剂 质粒NM23-PIRES2-EGFP、人低分化胃腺癌细胞株BGC-823为本实验室保存。人胚肾细胞系HEK293购自中国科学院典型培养物保藏委员会细胞库。腺病毒载体pCMV-MCS-IRES-EGFP和Anti-Hexon一抗、HRP标记二抗购自上海和元生物技术有限公司。内切酶EcoR I-HF和BamH I-HF酶、T4 DNA连接酶购自上海碧云天生物技术公司代理Fermentas MBI(美国)产品;PCR相关试剂购自Takara公司;兔抗人Flag一抗购自Sigma公司;兔抗人NM23A一抗购自Abcam公司;内参Actin抗体及GAPDH抗体均购自Beyotime公司;ECL+plusTMWestern blotting system试剂盒购自Amersham公司;引物合成由上海和元生物技术有限公司完成。
1.2 主要仪器 JB-CJ-2FD型超净工作台(苏州佳宝净化工程设备有限公司);GHP-9050型隔水式恒温培养箱(上海一恒科学仪器有限公司);TDZ4-WS型低速离心机(上海卢湘仪离心机仪器有限公司);MHG-100B型荧光显微镜(日本Olympus公司);5417R台式冷冻高速离心机(Eppendorf 公司);3111型CO2培养箱(Thermo Fisher);4200型全自动化学发光成像系统(上海天能科技有限公司);-80 ℃超低温冰箱(Thermo Fisher)。
1.3 方法
1.3.1 PCR扩增NM23基因 收集正常的人胃黏膜并用Trizol法提取RNA,根据NM23基因序列设计引物,引物序列如下:上游引物:5′-AGCTTGGGCTGCAGGAATTCGCCACCATGGTGCTACTG-3′;下游引物:5′-TCATCCTTGTAGTCGGATCCTTCATAGATCCAGTTCTGAGCAC-3′;划痕为酶切位点。扩增程序:98 ℃ 10 s;55 ℃ 5/15 s;72 ℃ 1 min;30个循环。PCR扩增结束后进行琼脂糖凝胶电泳,用TaKaRa MiniBEST琼脂糖凝胶DNA抽提试剂盒(Ver.3.0)回收扩增片段。
1.3.2 重组腺病毒载体的构建及鉴定 将真核表达载体pCMV-MCS-IRES-EGFP与上述NM23扩增片段回收产物分别经EcoR I和BamH I双酶切,琼脂糖凝胶电泳分别回收酶切后片段,回收产物在T4DNA 连接酶的作用下于16 ℃连接过夜。将连接产物转化入DH5α的感受态细菌,于LB 中摇床孵育1.5 h,再在含有100 μg/mL Ampicillin(Amp)的固体LB 培养基培养12 h,Amp+固体培养基中筛选培养12 h,挑取菌落,克隆于LB(Amp +) 液体培养基培养12 h。抽提质粒并用EcoR I和BamH I双酶切鉴定,送苏州金唯智生物科技有限公司进行测序。软件比对测序结果后得到正确的重组腺病毒质粒pCMV-NM23-IRES-EGFP。
1.3.3 重组腺病毒的包装 将待转染的病毒载体质粒4 μg,溶于Opti-MEM培养基,总体积为250 μL;将8μL 轻混腺病毒包装转染试剂溶于Opti-MEM培养基,总体积为250 μL;将腺病毒包装转染试剂稀释液滴加于质粒稀释液中,混匀后室温静置20 min。在细胞培养板加入刚配好的DNA-转染试剂复合体,将其做好标记并放回培养箱孵育6 h;更换新鲜完全培养基培养;每3天补液1次,14d左右出现病毒空斑,待完全病变后收集上清液。
1.3.4 重组腺病毒的扩增 将HEK293细胞接种于30~40个10 cm 培养皿中,待细胞融合度至70%~80%时,每块板加入病毒(约107~108PFU/mL)10 μL进行感染,待2~3d后细胞全部病变,每块板中加入约500 μL 10% Nonidet P 40(NP40)以裂解细胞。收集细胞裂解物,12 000 rpm离心10 min,弃细胞碎片收集上清。每100 mL上清加入50 mL病毒沉淀液(20% PEG8 000,2.5 mol/LNaCl),冰上静置1 h以沉淀病毒。12 000 rpm离心上述混合物20 min,弃上清,将沉淀物悬浮在10 mL密度为1.10 g/mL的CsCl溶液中(溶剂为20 mmol/L Tris-HCl,pH 8.0)4°C 7 000 rpm离心5 min,收集病毒悬浮液分装后置-80 ℃冰箱中保存。
1.3.5 重组腺病毒滴度测定 将5.0×105个/mL的HEK293细胞接种于24孔板,1 mL/孔,37 ℃、5% CO2培养14~18 h。加入不同稀释浓度的病毒样品(10-5~10-8),每孔加入100 μL。37°C、5% CO2培养48 h。轻轻的去除培养液,沿着24孔板侧壁缓缓加入预冷的甲醇500 μL,-20°C固定20 min。使用PBS轻轻的冲洗细胞3次,每次5min。加入200μL 1%BSA 37 ℃封闭1 h。每孔加入200 μL的Anti-Hexon一抗溶液,37 ℃孵育1 h。使用PBS轻轻的冲洗细胞3次,每次5 min。每孔加入200 μL的HRP标记二抗,37 ℃孵育1 h。使用PBS轻轻的冲洗细胞3次,每次5 min。每孔加入200 μL新配置的工作液,室温孵育5~10 min。弃工作液,使用PBS清洗2次,每孔加入1 mL PBS。每孔随机选择5个视野进行观察,使用光学显微镜10×物镜下计算阳性细胞个数。计算每孔阳性细胞的平均个数和病毒滴度。
病毒滴度(ifu/mL)=阳性细胞平均数×每孔视野数×稀释倍数/0.1mL。
1.3.6 重组腺病毒感染人胃癌细胞株BGC-823 本实验所用BGC-823细胞培养在37 ℃含有5% CO2的恒温培养箱中,静置贴壁常规培养于含10%灭活胎牛血清、100 U/mL的青霉素及100 U/mL链霉素的DMEM培养液中。实验细胞BGC-823分组:感染重组腺病毒pCMV-NM23-IRES-EGFP载体的实验组(NM23-OE组)、空白组(Ctrl组,不做任何处理)和感染pCMV-MCS-IRES-EGFP的阴性对照组(NC组),每组3个孔。
按每孔5×105的细胞数将BGC-823细胞接种于6孔培养板中,待细胞融合度达到90%以上时,加入pCMV-NM23-IRES-EGFP病毒液作为NM23-OE组及pCMV-MCS-IRES-EGFP病毒液作为NC组进行感染,同时以无病毒感染的细胞作为Ctrl组。取新鲜的DMEM培养基按照最佳感染复数(MOI值)为80来稀释病毒原液,弃废旧培养基,将不含NM23的阴性腺病毒稀释液加到阴性对照组中,含有NM23基因的重组腺病毒液稀释液加到实验组中,轻摇混匀后,放入37°C、5% CO2培养箱中继续孵育。病毒感染48 h后,更换新鲜培养基;72 h后通过荧光显微镜观察绿色荧光EGFP表达,确定腺病毒感染胃癌细胞BGC-823成功以及感染效率。将NC组和NM23-OE组的细胞消化并用无菌PBS洗涤2次,收集BGC-823细胞上流式细胞仪(FCM)筛选EGFP阳性细胞。将两组筛选获得的BGC-823细胞继续在培养瓶中传代扩大培养4周。
1.3.7 BGC-823细胞NM23基因过表达检测
1.3.7.1 RT-PCR 检测BGC-823细胞中NM23的mRNA 根据Invitrogen公司的Trizol操作说明书进行提取细胞总RNA,将RNA逆转录成cDNA,并以其为模板进行PCR扩增,引物序列为:NM23上游引物:5′-GATCTTCTCAAGGAACACTAC-3′,NM23下游引物:5′-CCGTCTTCACCACATTCA-3′,内参Actin上游引物:5′-TTCTACAATGAGCTGCGTG-3′,下游引物:5′-CTCAAACATGATCTGGGTC-3′。设定程序为两步法 Real-TimePCR定量。预变性95°C,30 s,之后每一步变性95°C,5 s,退火延伸60°C,34 s,共进行40个循环。每次在延伸阶段读取吸光值。采用2-ΔΔCt对目的基因的mRNA进行相对定量分析。
1.3.7.2 Western blot检测BGC-823细胞中NM23蛋白水平 提取细胞中总蛋白,BCA法进行蛋白定量,电泳时每孔上样蛋白量为5 μL,经分离后,使用垂直电泳装置将蛋白转移至PVDF膜上,用含5%脱脂牛奶的TBST溶液4 ℃封闭过夜;洗膜:TBST洗膜3次,每次10 min;以GAPDH为内参室温下孵育PVDF膜2 h;洗膜:TBST洗膜3次,每次10 min;采用ECL+plusTMWestern blotting system试剂盒进行显色;天能4200全自动化学发光成像分析系统曝光,根据所用的蛋白Marker分析图片。
1.3.7.3 流式细胞仪检测BGC-823细胞凋亡 准备3组BGC-823细胞,样品收取都使用预冷的PBS洗涤2次,500 rpm离心5 min,弃上清;用90 μL 1×Binding Buffer重悬细胞,将细胞转移到5 mL流式管里,每管细胞数量5×105~1×106之间;加5 μL的PE Annexin V和5 μL 7-AAD。将细胞混匀后室温避光孵育15 min;每管加400μL的1×Binding Buffer到500μL体积。在1 h内上机检测计算细胞凋亡率。
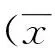
2 结果
2.1NM23扩增产物的鉴定NM23经PCR 扩增,产物经琼脂糖凝胶电泳分析观察,可见一条约577 bp 的特异性条带,大小与目的片段相符(见图1)。

1:PCR产物;2:DL2000 DNA Marker。图1 NM23 PCR 扩增产物电泳图
2.2 重组腺病毒载体的鉴定 经EcoR I-HF和BamH I-HF酶进行双酶切的产物可见5888bp的条带(见图2);菌落PCR鉴定结果可见835bp左右的条带(见图3)。将腺病毒重组载体pCMV-NM23-IRES-EGFP进行测序分析,与Genbank记录的NM23序列一致。图4所示为重组质粒测序部分序列图。
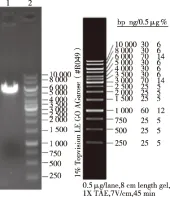
1:载体酶切后片段;2:1 kb DNA Marker。图2 腺病毒载体酶切电泳图
1:DL2000 DNA Marker;2~7:挑取的6个转化子。图3 菌落PCR鉴定结果
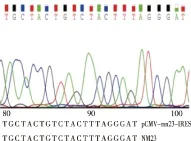
图4 重组质粒pCMV-NM23-IRES-EGFP部分序列图
2.3 BGC-823细胞NM23mRNA和蛋白质表达 利用实验组(NM23-OE组)中目的基因携带Flag标签,通过WB实验使用目的抗体NM23检测实验组(NM23-OE组)感染BGC-823的细胞样品。实验结果显示能观察到清晰的目的条带(见图5),证实实验组(NM23-OE组)在BGC823细胞中有表达。各组细胞灰度分析结果(见表1),统计分析结果显示,空白组(Ctrl组)与阴性对照组(NC组)中NM23的表达水平并无差异;而实验组(NM23-OE组)NM23表达水平相较于其他两组均显著增强(P<0.05)。
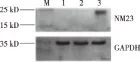
M:Maker;1:空白组(Ctrl组);2:阴性对照组(NC组);3:实验组(NM23-OE组)。图5 BGC-823细胞中NM23基因的蛋白表达
实验组(NM23-OE组)目的基因为NM23,与3Flag融合后预测对应蛋白大小约为19 kDa;实验结果表明,在Marker15-25 kDa之间处有条带出现,证实实验组(NM23-OE组)在BGC823细胞中有表达。
RT-PCR检测BGC-823细胞过表达NM23效率 RT-PCR结果显示:实验组(NM23-OE)BGC-823细胞的NM23mRNA表达量与空白组、阴性对照组相比明显升高,差异具有统计学意义(P<0.05,见表1)。


组别NM23蛋白水平NM23mRNA水平Ctrl0.25±0.090.83±0.04NC0.31±0.171.00±0.03NM23-OE1.27±0.13*#2.59±0.06*#
*:与Ctrl组比较,P<0.05;#:与NC组比较,P<0.05;Ctrl组与NC组比较,P>0.05。
2.4 过表达NM23促进人胃癌BGC-823细胞凋亡 流式细胞仪检测人胃癌BGC-823细胞凋亡率结果见图6和表2。NM23-OE组细胞凋亡率12.87%,明显高于NC组的1.90%和Ctrl组的1.74%(P<0.05)。而NC组和Ctrl组的细胞凋亡率差异无统计学意义(P>0.05)。
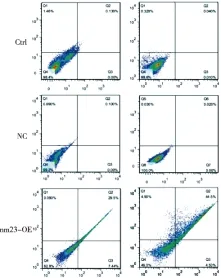
图6 各组细胞凋亡的流式细胞仪检测结果
表2 稳定过表达NM23各组细胞凋亡比例

组别细胞凋亡率(%)Ctrl1.74±0.98NC1.90±1.35NM23-OE12.87±3.02*#
*:与Ctrl组比较,P<0.05;#:与NC组比较,P<0.05;Ctrl组与NC组比较,P>0.05。
3 讨论
胃癌是全球最常见的恶性肿瘤之一[7-8]。由于早期胃癌无明显临床症状,导致患者就诊时多为进展期胃癌,而进展期胃癌的局部浸润和远处转移使得传统的治疗方法疗效十分有限。随着胃癌分子机制研究的不断深入,胃癌基因治疗成为当代胃癌治疗研究中的热点[9]。基因治疗是在基因调节水平上进行操作以杀伤或抑制肿瘤细胞,是一种对患者损伤性低、对肿瘤细胞选择性高的理想方法[10]。
有研究报道,在肿瘤动物模型中NM23的稳定高表达可以明显降低肿瘤细胞的转移潜能[11-12]。有观点认为NM23可能是通过调节其蛋白产物的表达水平从而对肿瘤细胞的转移潜能产生影响[13]。因此在肿瘤细胞中重新激活NM23可能会成为一种抗肿瘤转移治疗的新途径。但现今肿瘤的基因治疗在临床的应用中成效并不显著,究其原因与缺少有效的基因传递系统密不可分[14]。病毒载体作为一种较为理想的基因介导载体,在基因治疗领域中具有独特的优势。
在本实验中,我们构建了携带有NM23的重组腺病毒载体并观察其对人胃癌细胞株BGC-823细胞凋亡的影响。我们采用PCR法从课题组前期成功构建的重组质粒NM23-PIRES2-EGFP中扩增出NM23基因,并将其克隆至腺病毒载体pCMV-MCS-IRES-EGFP上,从而获得重组腺病毒载体pCMV-NM23-IRES-EGFP。此次,我们选用Admax系统的第三代腺病毒,不仅去除了载体自身所包含的结构蛋白,避免了免疫系统的攻击,同时针对静止期的细胞也有更为持久且稳定的表达功效。该病毒载体pCMV-MCS-IRES-EGFP因携带有特异性高且检测便捷的增强型绿色荧光蛋白EGFP,不仅可以通过荧光显微镜观察目的病毒的感染效率,同时也能通过流式细胞仪(FACS)快速筛选以获取阳性细胞。本实验采用Real-time PCR和Western Blot分别检测空白组、阴性对照组以及实验组BGC-823细胞中的NM23表达情况。结果显示,实验组中的NM23基因mRNA和蛋白表达高于其他两组,差异有统计学意义,说明我们所构建的重组腺病毒可以有效过表达NM23基因。
多数研究认为NM23基因可以通过诱导肿瘤细胞发生凋亡,从而起到抑制肿瘤的作用[15-16]。我们利用流式细胞检测发现,实验组与空白组、阴性对照组相比凋亡率有所升高且具有统计学意义,这说明重组腺病毒感染细胞后,NM23基因的高表达促进了肿瘤细胞的凋亡。
总之,在本实验中我们成功构建了携带NM23基因的重组腺病毒载体pCMV-NM23-IRES-EGFP,建立了稳定表达NM23基因的低分化人胃腺癌细胞株BGC-823,并对其中NM23在mRNA和蛋白水平的表达情况和对BGC-823细胞凋亡方面的影响进行了初步观察和探讨,为后续研究NM23基因对人胃腺癌细胞生物学功能的影响提供实验基础。
[1] Steeg P S,Bevilacqua G,Kopper L,et al.Evidence for a novel gene associated with low tumor metastatic potential[J].J Natl Cancer Inst,1988,80(3):200-204.
[2] 刘爱东,宋旭东,李双,等.胃腺癌中NM23、p53的表达与ki-67增殖指数关系的研究[J].西南国防医药,2014,24(11):1186-1188.
[3] 宁殿宾,祁红辉,赵玉哲.乳腺癌与乳腺癌复发患者VEGF及NM23的表达及临床意义[J].中国妇幼保健,2014,29(30):4983-4985.
[4] Radovic S,Hukic A,Kuskunovic S,et a1.Immunohisto-chemical expression and significance of NM23 suppressor protein in primary gastric adenocarcinoma[J].Bosn J Basic Med Sci,2013,13(2):72-77.
[5] 孙端.NM23H1基因蛋白在血清、胃癌组织的表达与胃癌临床TNM 分期的关系[J].中国药物现代应用,2014,8(11):86-87.
[6] 胡奇婵,陈玥,王丽,等.腺病毒载体用于基因治疗的研究进展[J].解放军医药杂志,2011,23(5):76-80.
[7] Hudler P.Challenges of deciphering gastric cancer heterogeneity[J].World J Gastroenterol,2015,21 (37):10510-10527.
[8] Liu H,Zhang H,Shen Z,et al.Increased expression of CSF-1 associates with poor prognosis of pat-ients with gastric cancer under going gastrectomy[J].Medicine (Baltimore),2016,95(9):e2675.
[9] Ge Z M,Ben Q W,Qian J B,et al.Diabetes mellitus and risk of gastric cancer:a systematic review and meta-analysis of observational studies[J].European Journal of Gastroenterology,2011,23(12):1127-1135.
[10] 邓洪新,魏于全.肿瘤基因治疗的研究现状和展望[J].中国肿瘤生物治疗杂志,2015,22(2):170-176.
[11] 李宗河,何学令,刘艳,等.腺病毒介导的NM23-H1对人恶性黑色素瘤A375体外抑制作用的研究[J].国外医药,2011,32(6):273-276.
[12] Boissan M,De Wever O,Lizarraga F,et al.Implication of metastasis suppressor NM23-H1 in maintaining adherens junctions and limiting the invasive potential of human cancer cells[J].Cancer Res,2010,70(19):7710-7722.
[13] 黄欢欢,李春鸣.NM23基因与消化道肿瘤的关系[J].遵义医学院学报,2013,36(6):590-592.
[14] Zhang T.Gene delivery for cancertherapy[J].Curr Drug Deliv,2014,11(2):233-242.
[15] 邓守恒,陈萍,蔡晓军,等.携带凋亡素基因重组腺病毒的制备及诱导结肠癌细胞凋亡的实验研究[J].肿瘤学杂志,2015,21(7):572-576.
[16] 邓莉,伍志盟,胡勤,等.SCAP重组腺病毒对ATDC5细胞增殖和凋亡的影响[J].第三军医大学学报,2016,38(14):1622-1628.
[收稿2017-02-01;修回2017-03-08]
(编辑:王福军)
Construction and identification of recombinant adenovirus pCMV-NM23-IRES-EGFP
ZengLi,TangZefei,LiChunming
(Department of Pathology,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To construct the re-combinant adenovirus vector carrying with geneNM23 and observe the influence on the apoptosis of human carcinoma of stomach cell line BGC-823.Methods TheNM23 gene was amplified by PCR using plasmid NM23-PIRES2-EGFP as templateand cloned into adenovirus vector pCMV-MCS-IRES-EGFP.The recombinant adenovirus vector pCMV-NM23-IRES-EGFP was identified by restriction enzyme digestion and gene sequencing.The human gastric cancer cell line BGC-823 was divided into experimental group (NM23-OE group,infected pCMV-NM23-IRES-EGFP),blank group (Ctrl group),negative control group (NC group,infected pCMV-MCS-IRES-EGFP).The mRNA and protein expressions of NM23 gene were detected by real Time PCR and western blot assay.The apoptosis was detected by flow cytometry.Results The recombinant adenovirus pCMV-NM23-IRES-EGFP was supported by restriction enzyme digestion and gene sequencing.After amplification,the titer of re-constructed adenovirus was 4.0×1010ifu/ml.Compared with the NC group,there was no significant difference between the Ctrl group and the NC group (P>0.05).The mRNA and protein expressions ofNM23 gene in the NM23-OE group were higher than those in the other two groups(P<0.05).The apoptosis rate of human gastric cancer cell line BGC-823 in the NM23-OE group was also higher than that in the other two groups (P<0.05).Conclusion The recombinant adenovirus pCMV-NM23-IRES-EGFP vector is successfully constructed.The expression ofNM23 gene is significantly increased by up-regulating the expression ofNM23 gene BGC-823.These data could provide an experimental basis for the subsequent study on the effect ofNM23 gene on the biological function of human gastric adenocarcinoma cells.
NM23; vector; BGC-823; adenovirus; apoptosis
贵州省科学技术基金资助项目(NO:黔科合SY字[2013]3001)。
李春鸣,女,硕士,教授,硕士生导师,研究方向:胃肠道肿瘤,E-mail:cmli@zmc.edu.cn。
R363
A
1000-2715(2017)02-0166-06

