XIAP和Smac在染锰大鼠生精细胞Caspase-9和Apaf-1表达中的作用
郭 海,宋 爽,陈 伟,才秀莲
(1.河南医学高等专科学校 组织学与胚胎学教研室,河南 郑州 451191;2.遵义医学院 组织学与胚胎学教研室,贵州 遵义 563099)
基础医学研究
XIAP和Smac在染锰大鼠生精细胞Caspase-9和Apaf-1表达中的作用
郭 海1,宋 爽1,陈 伟2,才秀莲2
(1.河南医学高等专科学校 组织学与胚胎学教研室,河南 郑州 451191;2.遵义医学院 组织学与胚胎学教研室,贵州 遵义 563099)
目的 研究氯化锰导致的大鼠生精细胞caspase-9及Apaf-1表达中XIAP和Smac的调节机制,探讨锰导致的雄性不育机制。 方法 雄性SD大鼠随机分为对照组、低剂量(15 mg/kg MnCl2)和高剂量(30 mg/kg MnCl2)组,腹腔注射MnCl24周和6周,免疫组织化学检测生精细胞caspase-9、Apaf-1、XIAP和Smac表达。结果 ①各组生精细胞caspase-9、Apaf-1和Smac表达均显著升高(P<0.01),XIAP表达降低(P<0.01)。②同时间的高剂量组与低剂量组比较,同剂量的6周组与4周组比较,生精细胞caspase-9、Apaf-1和Smac表达均显著升高(P<0.01),XIAP表达降低(P<0.01)。③各组caspase-9与Apaf-1表达呈正相关(r=0.862,P<0.05),XIAP与Smac表达呈负相关(r=-0.887,P<0.01)。 结论 锰可促进生精细胞caspase-9、Apaf-1和Smac表达,抑制XIAP表达,导致细胞凋亡,产生雄性生殖毒性效应。
锰;生精细胞;caspase-9;Apaf-1;XIAP;Smac
细胞凋亡过程中最关键的环节是半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase)家族的激活,caspase-9是该家族中在凋亡起始阶段最先激活的成员,通过与凋亡蛋白酶活化因子-1(apoptosis protease activating factor-1,Apaf-1)形成caspase-9-Apaf-1复合物而促进自身前体活化[1]。凋亡抑制蛋白家族(inhibitor of apoptosis proteins, IAPs)可直接抑制caspase家族各成员的活性, X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是IAP家族中最强大的凋亡抑制因子[2],它可直接抑制caspase家族多个成员活性[3],但其本身却受线粒体第二激活因子(second mitochondria-derived activator of caspases,Smac)的抑制[4]。随着汽车的普及,作为汽油抗爆剂成分之一的锰在环境中的含量也随之上升。其作为一种生殖毒性金属,可以直接诱发caspase家族的激活,最终导致生精细胞的凋亡[5],抑制雄性生殖作用。但在caspase家族所介导的细胞凋亡过程中,最先发生的是caspase-9和Apaf-1的结合,同时该家族的其他成员活性又受XIAP和Smac的调节,共同维持生精细胞数量稳定。本实验拟通过检测锰中毒大鼠睾丸caspase-9、Apaf-1、XIAP及Smac的表达情况,探寻锰的雄性生殖毒性机制。
1 材料与方法
1.1 实验动物 60只健康雄性SD大鼠,35日龄,体重110~130 g,由四川大学华西医院实验动物中心提供,许可证号:SYXK(川)2003-0001。设定对照组、低剂量(15 mg/kg)组和高剂量 (30 mg/kg)组,每组内再分为4周和6周组,共6组,每组10只。均为腹腔注射给药,对照组以生理盐水代替,每周5 d,每天1次,饲养及实验温度(20±1) ℃,湿度30%~50%,光照12 h/d。
1.2 主要试剂及仪器 分析纯MnCl2·4H2O购于上海化学试剂公司;caspase-9和Apaf-1兔抗鼠单克隆抗体购于北京中杉金桥生物工程公司;XIAP和Smac小鼠抗大鼠单克隆抗体购于德国Roche公司;SABC免疫组织化学试剂盒购于北京中杉金桥生物工程公司;DMLB2HC型细胞图像分析系统购于德国LEICA公司。
1.3 标本采集 分别于第4周末和第6周末处死各自时间段的对照组、低剂量组和高剂量组,分离双侧睾丸,纵切后4%多聚甲醛固定,石蜡包埋,片厚4 μm进行冠状位切片,免疫组织化学检测生精细胞caspase-9、Apaf-1、XIAP及Smac表达。以PBS代替一抗作为阴性对照,以已知的caspase-9和Apaf-1表达阳性的乳腺癌切片及XIAP和Smac表达阳性的胃癌切片作为阳性对照,具体步骤按照说明书进行。
1.4 观察指标及方法 Caspase-9、Apaf-1、XIAP及Smac阳性产物均呈棕黄色,位于生精细胞的细胞质,各组大鼠均可见,主要位于精母细胞。每例切片在冠状位从左至右连续观察10个生精小管,分别计数caspase-9、Apaf-1、XIAP及Smac表达阳性的生精细胞数占总生精细胞数的百分率,即为各自的阳性细胞率。
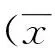
2 结果
2.1 锰对大鼠生精细胞caspase-9和Apaf-1表达的影响 Caspase-9和Apaf-1阳性产物均呈棕黄色,主要位于精母细胞的细胞质,其余各级生精细胞可见少量表达。与对照组比较,低剂量、高剂量组caspase-9和Apaf-1表达均升高(P<0.01)。同时间的高剂量组与低剂量组比较,以及同剂量的6周组与4周组比较,caspase-9和Apaf-1表达均升高(P<0.01,见表1和图1)。


组别caspase-9阳性细胞率4周6周Apaf-1阳性细胞率4周6周空白对照5.26±1.574.38±2.713.94±1.622.84±0.5715mg/kgMnCl235.84±5.13a52.92±4.42ab43.25±5.37a61.27±4.68ab30mg/kgMnCl254.41±6.32ac62.34±5.65abc62.81±7.34ac77.56±5.73abc
a: 与同时间点对照组相比; b: 与同剂量4周组相比; c: 与同时间点低剂量组相比;P<0.01。
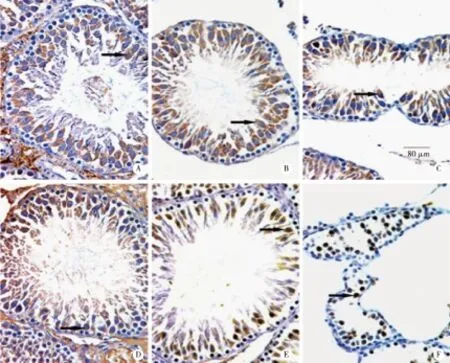
A:caspase-9,对照组;B:caspase-9,4周低剂量组;C:caspase-9,6周低剂量组;D:Apaf-1,对照组;E:Apaf-1,6周低剂量组;F:Apaf-1,6周高剂量组。↗表示阳性细胞。 图1 各组大鼠生精细胞caspase-9和Afaf-1表达(SABC,×400)
2.2 锰对大鼠生精细胞XIAP和Smac表达的影响 XIAP和Smac免疫阳性产物均呈棕黄色或棕褐色,主要表达于精母细胞的细胞质,其余各级生精细胞可见少量表达,各组大鼠均可见。与对照组比较,除4周低剂量组XIAP和Smac表达没有明显差异外,各组XIAP表达显著降低,Smac表达显著升高(P<0.01)。同时间的高剂量组与低剂量组比较,以及同剂量的6周组与4周组比较,XIAP表达显著降低,Smac表达显著升高(P<0.01,见表2和图2)。


分组XIAP阳性细胞率4周6周Smac阳性细胞率4周6周空白对照45.52±5.3647.83±3.678.26±1.547.98±1.3315mg/kgMnCl243.41±4.2332.77±3.94ab35.16±5.21a56.31±6.62ab30mg/kgMnCl224.78±3.25ac19.13±4.38abc64.14±6.17ac76.53±5.47abc
a: 与同时间点对照组相比;b: 与同剂量4周组相比;c: 与同时间点低剂量组相比,P<0.01。

A:XIAP,对照组;B:XIAP;6周低剂量组;C:XIAP, 6周高剂量组;D:Smac, 对照组;E:Smac, 6周低剂量组;F:Smac, 6周高剂量组。↗表示阳性细胞。图2 各组大鼠生精细胞XIAP和Smac表达(SABC,×400)
2.3 染锰大鼠生精细胞caspase-9、Apaf-1、XIAP及Smac表达间相关关系 各组大鼠生精细胞caspase-9阳性细胞率与Apaf-1阳性细胞率呈正相关(r=0.862,P<0.05),XIAP阳性细胞率与Smac阳性细胞率呈负相关(r=-0.887,P<0.01)。
3 讨论
锰是体内多种酶的活性中心[6],但过量的锰蓄积于体内可以穿过血睾屏障,破坏生精微环境,导致生精细胞特别是精母细胞凋亡[5],其直接后果为精子数量下降和雄性不育。
细胞凋亡的内源性线粒体途径和外源性死亡受体途径最终都将导致caspase家族成员的激活,其中caspase-2,-8,-9,10是凋亡途径的启动酶,caspase-3,-6,-7是凋亡途径的效应酶[7]。通常情况下caspase-9以前体酶原pro-caspase-9的形式存在,在线粒体释放的细胞色素C的作用下,一方面使pro-caspase-9发生水解而自身激活,另一方面促使同样在线粒体内部的Apaf-1释放,共同组成Cyto-c-Apaf-1-caspase-9凋亡复合体[8]。该复合体再激活caspase-3,最终导致不可逆的凋亡发生。在此过程中,Apaf-1起到承上启下的关键作用,是整个凋亡复合体的核心[9]。染锰后Apaf-1主要表达于精母细胞细胞质,与caspase-9表达区域一致,且二者之间存在正相关。说明生精细胞凋亡过程中,首先被激活的是Apaf-1,其释放后与同时表达增加的caspase-9形成凋亡复合体,最终使细胞质中caspase-3表达上调,并发生由细胞质向细胞核的转移导致生精细胞凋亡。
X染色体连锁凋亡抑制蛋白(XIAP)是凋亡抑制蛋白家族中最强大最有效的caspase家族抑制剂,也是唯一能够同时抑制凋亡起始阶段caspase-9和凋亡执行阶段caspase-3的凋亡抑制蛋白[10]。XIAP由3个杆状病毒caspase抑制因子重复区(baculovirus IAP repeats domain,BIR)的结构域组成,分别是BIR1,BIR2和BIR3,BIR1和BIR2主要抑制caspase-3和caspase-7的活性,而BIR3主要通过在氨基酸组成序列上与Apaf-1高度同源的RING结构域竞争性抑制Apaf-1-caspase-9凋亡复合体的形成,使Apaf-1维持单体形态而丧失催化活性,进而抑制caspase-9的激活[11]。因此,XIAP不仅在上游途径通过对pro-caspase-9的抑制阻止凋亡发生,而且还通过对caspase-3和caspase-7的直接抑制作用,在下游途径阻止后续级联反应的进行。本实验显示,随着染锰时间延长和剂量增加,XIAP的活性逐渐被抑制,导致原本受其控制的Apaf-1和caspase-9表达增加,最终导致生精细胞发生凋亡。
Caspase家族的线粒体第二激活因子(Smac)也位于动物细胞线粒体内,在人体各个器官中以睾丸表达最高,卵巢次之[12]。单体的Smac并无促凋亡作用,当其自身剪切活化形成二聚体后,通过N端的丙氨酸-缬氨酸-脯氨酸-异亮氨酸(AVPI)序列可以与包括XIAP在内的多种凋亡抑制蛋白结合,使caspase-3,-7,-9从XIAP释放,解除XIAP对它们的抑制作用,促进凋亡发生[13]。还可以诱导pro-caspase-3的活性上升,使其更容易被caspase-9识别并激活,直接导致细胞凋亡[14]。最后,Smac还可以通过反向激活Bax,再次使细胞核释放细胞色素C,形成凋亡内源性途径的自身循环,加速凋亡进程[15]。染锰后,作为caspase家族底物的Apaf-1随同细胞色素C一同自线粒体释放,二者共同激活caspase-9,进而激活家族核心成员caspase-3,直接导致生精细胞凋亡。同时,具有抑制凋亡作用的XIAP表达下降,同时促进caspase-3,-7,-9释放,诱发凋亡的Smac表达增加,说明锰一方面通过诱发凋亡内源性的线粒体途径激活,同时破坏凋亡抑制蛋白,促进caspase家族成员与其分离,最终导致生精细胞的破坏和雄性生殖功能的抑制。
[1] Li P,Nijhawan D,Budihardjo I,et al.cytochrome c and dATP-dependent formation of Afaf-1/caspase-9 complex initates an apoptotic protease cascade[J].Cell,1997,91(4):479-489.
[2] Holcik M,Korneluk R G.XIAP,the guardian angel[J].Nature Reviews Molecular Cell Biology,2001,2(7):550-556.
[3] Chai J,Shiozaki E,Srinivasula S M,et al.Structural basis of caspase-7 inhibition by XIAP[J].Cell,2001,104(5):769-780.
[4] Du C,Fang M,Li Y,et al.Smac,a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J].Cell,2000,102(1):33-42.
[5] 郭海,才秀莲,王国秀.Caspase-3 mRNA与PARP在染锰大鼠生精细胞中的表达变化[J].解剖科学进展,2015,21(6):582-585.
[6] 詹平,陈华.环境卫生学[M].北京:科学出版社,2008:158-161.
[7] 郭海,才秀莲,王国秀.锰对大鼠生精细胞凋亡的影响[J].解剖科学进展,2015,21(5):547-551.
[8] Marsden B V,Connor L O,Reilly L A O,et al.Apoptosis initiated by Bcl-2- regulated caspase activation independently of the cytochrome c/Apaf1/caspase-9 apoptosome[J].Nature,2002,419(6907):634-637.
[9] 李淑玲,宋小峰.大鼠肾发育中凋亡活化因子-1的表达[J].中国现代医学杂志,2014,24(17):6-9.
[10] Mace P D,Shirley S,Day E L.Assembling the building blocks:structure and function of inhibitor of apoptosis proteins[J].Cell Death Differentiation,2010,17(1):46-53.
[11] Eckelman B P,Salvesen G S,Scott F L.Human inhibitor of apoptosis proteins:why XIAP is the black sheep of the family[J].EMBO Report,2006,7(10):988-994.
[12] Schenk B,Fulda S.Reactive oxygen species regulate Smac mimetic/TNFα-induced necroptotic signaling and cell death[J].Oncogene,2015,34 (47):5796-5806.
[13] Zeng H,Zhang S,Yang K Y,et al.Knockdown of second mitochondria-derived activator of caspase expression by RNAi enhances growth and cisplatin resistance of human lung cancer cells[J].Cancer Biotherapy and Radiopharmaceuticals,2010,25(6):705-712.
[14] Bank A,Wang P,Du C,et al.SMAC mimetics sensitize nonsteroidal anti-inflamma tory drug-induced apoptosis by promoting caspase-3-mediated cytochrome-c release[J].Cancer Research,2008,68(1):276-284.
[15] Wenbin H,Fang W,Jingsheng T,et al.Proapoptotic protein Smac mediates apoptosis in cisplatin-resistant ovarian cancer cells when hyperlink treated with the anti-tumor agent AT101[J].Journal of Biological Chemistry,2012,287(1):68-80.
[收稿2016-12-31;修回2017-02-28]
(编辑:王静)
Effects of XIAP and Smac on the expressions of Caspase-9 and Apaf-1 in spermatogenic cells of rats exposed to manganese
GuoHai1,SongShuang1,ChenWei2,CaiXiulian2
(1.Department of Histology and Embryology, Henan Medical College, Zhengzhou Henan 451191, China; 2.Department of Histology and Embryology, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To determine the regulatory effects of XIAP and Smac on the expressions of caspase-9 and Apaf-1 in spermatogenic cells of rats exposed to manganese and further explore the mechanisms through which male sterility caused by manganese. Methods Male Sprague Dawley rats were divided into control and MnC12(15 and 30 mg/kg) groups. After exposed to manganese for 4 or 6 weeks, the expressions of caspase-9, Apaf-1, XIAP and Smac were detected by immunohistochemistry (SABC) assay. Results 1) The caspase-9-positive-cell rate, the Apaf-1-positive-cell rate and the Smac-positive-cell rate were increased (P<0.01) while the XIAP-positive-cell rate was decreased (P<0.01). 2) Among the same dose and same time manganese groups, caspase-9-positive-cell rate, the Apaf-1-positive-cell rate and the Smac-positive-cell rate were increased (P<0.01) while the XIAP-positive-cell rate was decreased (P<0.01). 3)There was a positive correlation between caspase-9-positive-cell rate and Apaf-1-positive-cell rate (r=0.862,P<0.05), and a negative correlation between XIAP-positive-cell rate and Smac-positive-cell rate (r=-0.887,P<0.01). Conclusion Manganese could promote the expressions of caspase-9,Apaf-1 and Smac and inhibit the expression of XIAP, which might lead to male reproductive toxicity.
manganese; spermatogenic cells; caspase-9; Apaf-1; XIAP; Smac
遵义市科技局社会发展资助项目(NO: 遵市科合社字[2007]07); 遵义市红花岗区科技局社会发展资助项目(NO: 遵红科合[2006]22)。
才秀莲,女,教授,硕士生导师,研究方向:生殖毒理学,E-mail:lianxiucai@163.com。
R114
A
1000-2715(2017)02-0156-05

